妊娠期糖尿病患者血清IL-17、IL-17R、IL-23水平與腸道菌群的相關性
肖維薇,陶明進
同濟大學醫學院/同濟大學附屬第一婦嬰保健院檢驗科,上海 200092
妊娠期糖尿病(GDM)是指發生在妊娠期的糖耐量異常或糖尿病,是妊娠期常見并發癥。GDM會增加孕產婦出現不良妊娠結局的概率,如早產、胎盤早剝、先兆子癇、新生兒窒息、產后出血等,對母嬰健康帶來嚴重威脅[1]。近年來,有研究表明,糖尿病的發生與腸道菌群失調及炎性反應有密切關系[2]。白細胞介素-17(IL-17)主要由活化的CD4+T淋巴細胞Th17亞群分泌,其可與其受體白細胞介素-17受體(IL-17R)特異性結合,進而促進炎性反應發展[3]。IL-23屬于IL-12家族成員,是一種前炎性因子,參與抗感染、抗腫瘤及自身免疫疾病等過程,有研究顯示其與GDM有關[4-5]。為分析GDM患者腸道菌群與血清IL-17、IL-23、IL-17R的相關性,選取122例在本院產檢的孕婦作為觀察對象。現將研究結果報道如下。
1 資料與方法
1.1一般資料 選取2019年1月至2020年1月于本院進行產檢的122例孕婦作為研究對象。根據是否合并糖尿病分為GDM組(62例)和糖代謝正常(NGT組)(60例)。GDM組納入標準:(1)均符合中華醫學會糖尿病分會2018年制訂的《中國2型糖尿病防治指南》中的GDM相關標準[6];(2)全部是單胎;(3)孕婦及其家屬知情同意;(4)經本院倫理委員會批準。排除標準:(1)孕婦懷孕前出現糖耐量異常情況;(2)合并嚴重臟器功能障礙;(3)合并血液、免疫系統疾病;(4)過往實施腸道手術或有胃腸道疾病史;(5)長期使用抗菌藥物、益生菌等藥物。
1.2研究方法 (1) 臨床資料:記錄年齡、孕次、妊娠時間,測量身高、體質量,計算體質量指數(BMI);所有研究對象抽取清晨空腹靜脈血6 mL,在3 000 r/min下離心10 min,獲得血清,分為兩份保存待檢。采用日本日立7180生化儀檢測空腹血糖(FPG)、總膽固醇(TC)、三酰甘油(TG)、高密度脂蛋白膽固醇(HDL-C)、低密度脂蛋白膽固醇(LDL-C);糖化血紅蛋白(HbA1c)檢測;(2) 腸道菌群及腸道定植抗力:采用無氧罐收集全部產婦的30 g新鮮糞便,30 min內送檢。用生理鹽水稀釋1.0 g樣本糞便,依據10倍連續稀釋方式將其稀釋至10-8濃度,振蕩混勻為混懸液。于對應的培養基上涂上不同的稀釋度糞便50 μL,其中需氧的乳酸桿菌、雙歧桿菌放置于35℃孵箱中培養1 d,利用抽氣換氣培養法培養腸球菌、腸桿菌等厭氧菌2 d。利用ATB半自動微生物鑒定系統(購自法國生物梅里埃公司)鑒定細菌。(3) 血清IL-17、IL-17R、IL-23檢測:IL-17、IL-17R和IL-23均利用酶聯免疫吸附試驗檢測,試劑盒購自上海美聯生物科技有限公司,檢測設備為 F50酶標儀(購自瑞士帝肯公司)。
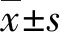
2 結 果
2.1兩組臨床資料的比較 兩組患者的孕次、年齡、妊娠時間、BMI差異均無統計學意義(P>0.05),相比于NGT組,GDM組TC、TG、LDL-C、FPG、HbAlc更高,差異有統計學意義(P<0.05),HDL-C更低,差異有統計學意義(P<0.05)。結果見表1。

表1 兩組臨床資料的比較或n(%)]
2.2兩組腸道菌群含量的比較 相較于NGT組,GDM組雙歧桿菌、乳酸桿菌更低,差異有統計學意義(P<0.05),腸桿菌、腸球菌更高,差異有統計學意義(P<0.05)。結果見表2。

表2 兩組腸道菌群含量的比較
2.3兩組血清IL-17、IL-23、IL-17R水平的比較 相較于NGT組,GDM組血清IL-17、IL-17R、IL-23水平更高,差異有統計學意義(P<0.05)。結果見表3。

表3 兩組血清IL-17、IL-17R、IL-23水平的比較
2.4GDM患者腸道菌群和炎癥因子水平的相關性分析 Pearson相關性分析發現,GDM患者IL-17、IL-23、IL-17R與腸球菌、腸桿菌呈正相關(P<0.05),與乳酸桿菌、雙歧桿菌均呈負相關(P<0.05)。結果見表4。

表4 GDM患者IL-17、IL-17R、IL-23與腸道菌群的相關性分析(r)
3 討 論
GDM是產科常見病,且近年來該病的發病率不斷升高。GDM患者的糖代謝異常在產后大多都能恢復,但妊娠期糖代謝異常會對母嬰的健康造成嚴重影響。近年來有研究表明,糖尿病的發生、發展與腸道菌群失調有關[7]。人體腸道內寄存在著大量菌群,并保持著動態平衡,組成人體重要的微生態系統。腸道菌群作為一個天然保護屏障,可抵抗外來病原菌的侵襲,改善機體免疫功能[8]。其中雙歧桿菌、乳酸桿菌、擬桿菌等是有益菌群,可以改善腸道酸性環境、抑制有害菌的生長繁殖、增強機體免疫功能等,當由于各種原因導致腸道菌群的有益菌減少,有害菌過度生長繁殖時,腸道微生態就會失衡,使腸道天然屏障被破壞,影響機體的消化吸收和免疫功能[9]。GDM患者由于處于高糖狀態,腸道的內環境、pH值等受到影響,會導致體內有益菌數量顯著下降[10]。本研究結果顯示,GDM與腸道菌群失調有密切關系。相較于NGT組,GDM組雙歧桿菌、乳酸桿菌更低,差異有統計學意義(P<0.05),腸桿菌、腸球菌更高,差異有統計學意義(P<0.05),提示GDM患者存在腸道菌群失調,GDM的發生、發展可能與菌群失調有關。另外,本研究結果還表明,相較于NGT組,GDM組TC、TG、LDL-C、FPG、HbAlc水平更高,差異有統計學意義(P<0.05),HDL-C水平更低,差異有統計學意義(P<0.05)。提示GDM患者除了血糖高,還存在脂質代謝紊亂。
本研究結果表明,相較于NGT組,GDM組血清IL-17、IL-17R、IL-23水平更高,差異有統計學意義(P<0.05)。提示IL-17、IL-17R、IL-23與GDM有關。另外,經過Pearson相關性分析,GDM患者IL-17、IL-17R、IL-23與雙歧桿菌、乳酸桿菌均呈負相關(P<0.05),與腸桿菌、腸球菌均呈正相關(P<0.05),說明IL-17、IL-17R、IL-23與GDM的腸道菌群紊亂有關。分析其可能原因是GDM患者機體處于高糖狀態,導致患者腸道內環境、pH值等的變化,使腸道菌群失調,腸道微生態環境被破壞,進一步導致機體循環系統中內毒素增加,引起慢性炎癥,從而使IL-17、IL-17R、IL-23等炎性因子水平增加,而這些炎性因子又會加劇腸道炎性反應,并損傷胰島細胞,引起胰島素抵抗[11]。
有研究顯示,GDM也存在慢性低水平炎癥,多種炎性細胞因子參與其發病過程[12]。血清IL-17主要由活化的CD4+T淋巴細胞Th17亞群分泌,通過與其受體IL-17R特異性地結合,參與炎性反應及免疫應答[13]。有研究表明,IL-17與其受體IL-17R結合后,可通過激活核因子(NF-κB)途徑和有絲分裂原活化蛋白激酶(MAPK)信號途徑,參與炎性反應和胰島細胞的損傷,從而在GDM發病中起重要作用[14-15]。李慶[16]研究表明,IL-17可能通過胰島素抵抗,促進GDM的發生、發展。IL-23作為一種促炎因子,主要由單核巨噬細胞和B淋巴細胞分泌,能夠激活Th17細胞,同時加劇腸黏膜的炎性反應[17]。朱潔等[18]研究表明,糖尿病患者血清IL-23水平顯著高于健康人群,且是隱匿性自身免疫糖尿病的重要促炎因子。馬旭園等[19]研究表明,IL-23/ IL-17炎癥軸與潰瘍性結腸炎的發生、發展有關,且與腸道菌群數量及炎癥程度均有關系。綜上所述,GDM患者存在腸道菌群失調,導致免疫功能的異常,引起炎性因子IL-17、IL-17R、IL-23水平的變化。
本研究樣本量較少,還需多中心、大樣本、前瞻性研究證實。并且本研究推測IL-17、IL-17R、IL-23可能存在相互作用的關系,且與不同類型的腸道菌群有不同的關系,因此下一步將深入探討三者之間的關系及與不同腸道菌群的關系。

