長春新堿逆轉骨髓間充質干細胞對白血病兒童門冬酰胺酶耐藥的研究*
徐清云 盧婕倫 曾曉珍 衛風桂 吳澤霖 鄒亞偉
廣州醫科大學附屬第一醫院兒科,廣東省廣州市 510000
聯合應用左旋門冬酰胺酶(L-asp)治療后,兒童急性淋巴細胞白血病(ALL)的完全緩解率及長期無病生存率有了顯著提高[1],作為兒童ALL化療的一線藥物,L-asp在ALL患兒誘導緩解中有著不可替代的地位,卻容易產生耐藥[2],對L-asp治療的耐藥與其臨床療效差存在直接相關性。關于L-asp的耐藥機制,目前尚未有定論,但有研究表明,可能與白血病細胞賴以生存的骨髓微環境中骨髓間充質干細胞(MSCs)的ASNS高表達有關[3]。白血病的發生發展過程中,骨髓間充質干細胞通過直接黏附和分泌細胞因子等機制對白血病細胞增殖、分化、遷移、凋亡有重要作用[4-5]。白血病細胞與骨髓微環境的相互作用成為研究兒童白血病耐藥的一個重要方面。從干擾或切斷ALL細胞與MSCs的聯系著手,可能會找到更多解決門冬酰胺耐藥問題的辦法,從而改善ALL的預后。現今兒童ALL常用化療方案中均采用長春新堿(VCR)和L-asp序貫治療[6]。VCR預處理MSCs,能否降低MSCs中ASNS的表達并逆轉共培養系統中MSCs介導的L-asp耐藥,這尚有待證實。本項目研究以體外模擬骨髓微環境中的白血病細胞為靶點,建立骨髓間充質干細胞—白血病細胞共培養模型,并對其進行L-asp處理。通過比較L-asp處理前后白血病細胞的凋亡情況及其ASNS mRNA的表達水平,評估MSCs對白血病兒童L-asp治療耐藥的影響,并探索VCR能否逆轉MSCs介導的白血病細胞對門冬酰胺酶耐藥及其機制,為進一步理解L-asp的化療耐藥機制并克服ALL細胞對L-asp的耐藥問題奠定理論基礎。
1 材料與方法
1.1 試劑與儀器 Ficol淋巴細胞分離液(天津TBD 公司),胎牛血清(美國Hyclone 公司),低糖DMEM 培養基(DMEM-LG),1640 培養液(美國Gibco 公司),流式細胞術、抗體(美國BD PharMingen公司),核酸提取、逆轉錄試劑盒(Bio-Rad公司)、qPCR試劑盒(Thermo公司),引物(Invitrogen公司),低溫高速離心機(Beckman公司),細胞培養箱(SANYO公司),倒置光學顯微鏡(Leica 公司),PCR儀C1000(Bio-RAD公司),實時熒光定量PCR儀ABI-7900HT(ABI公司)。
1.2 標本采集 所有病例來自廣州醫科大學附屬第一醫院兒科ALL患兒。在知情同意下收集15例ALL患兒骨髓標本,其中初治3例,化療緩解或部分緩解12例,平均年齡(5.53±3.18)歲,男7例,女8例。15例骨髓標本全部用于體外培養,12例化療緩解或部分ALL骨髓標本經分離培養及傳代后進行后續實驗。
1.3 實驗方法
1.3.1 MSCs的體外分離、培養及鑒定:MSCs的體外分離、培養方法參考相關文獻[7],用流式細胞儀檢測MSCs的免疫表型。
1.3.2 MTT 法檢測細胞株Jurkat L-asp IC50濃度:取對數生長期的Jurkat細胞,按1×105/孔,L-asp的終濃度分別為0.00、0.01、0.10、1.00、10.00IU/ml,每一濃度設6個復孔;培養48h,加入MTT(5mg/ml)/孔,4h后終止培養,離心、吸掉上清;加入DMSO溶解MTT,酶標儀490nm測A值;重復實驗3次。
1.3.3 建立MSCs-Jurkat共培養模型:取第2~5代MSCs按2×104/ml 的密度接種,待細胞鋪滿孔底80%~90%時,加入1 800μl(細胞懸液∶生理鹽水=19∶1,每孔共2 000μl)按5×105/ml密度重懸的Jurkat細胞,建立MSCs-Jurkat共培養模型,為共培養對照組;共培養實驗組1為加入IC50濃度的L-asp 200μl[細胞懸液∶L-asp(IC50的濃度)=19∶1,每孔共2 000μl]處理組共培養模型,培養48h后終止培養,收取Jurkat細胞;共培養實驗組2為加入含VCR 0.1μmol/ml(濃度相當于臨床用藥濃度)的低糖DMEM完全培養液2 000μl預處MSCs,培養72h(VCR的生物半衰期在25.5h左右)后棄培養液,清洗,用VCR處理后的MSCs與Jurkat細胞建立共培養模型,后續步驟同共培養實驗組1。
1.3.4 細胞凋亡率的測定:收集各組Jurkat細胞,沖洗后按每(1~5)×105細胞加入5μl AnnexinV-FITC和5μl PI,室溫避光染色15min;用AnnexinV-FITC/PI雙參數法流式細胞術定量測定細胞凋亡率(每組重復實驗3次)。
1.3.5 Real-Time qPCR檢測ASNS mRNA表達:ASNS cDNA提取步驟參考相關文獻[8],引物設計在Pubmed網站中查出Genebank提供的GAPDH和ASNS的 mRNA 序列,采用Primer premier 5.0軟件設計目的基因引物:SYBR實時熒光定量PCR引物序列GAPDH上游:5’-AATCCCATCACCATCTTCCA-3’,下游:5’-CCTGCTTCACCACCTTCTTG-3’產物大小77bp;ASNS上游:5’-GGCAAATGCAGCCCAGAAAT-3’,下游:5’-GGCGTTCAAAGACTTGACGG-3’,產物大小80bp。擴增的具體循環參數95℃ 3min;95℃3s,60℃20s,共40個循環;95℃5s,60℃1min,97℃30s。記錄Ct值并進行數據分析。計算公式:目的(ASNS)mRNA的表達量=2-ΔΔCt,ΔΔCt=(Ct目的-Ct內參)實驗組-(Ct目的-Ct內參)對照組,Ct值就是熒光值達到閾值時候的PCR循環次數,根據Ct值計算ASNS mRNA進行相對定量。目的基因的Ct值通過內參基因的Ct值進行校正。

2 結果
2.1 MSCs原代分離培養后流式細胞術鑒定 分離擴增的MSCs表達CD105、CD29、CD90陽性,CD14、CD19、CD11B、CD79a、HLADR、CD34和CD45表達陰性(圖1),符合MSCs抗原標志物表達特征,且隨著細胞的傳代免疫表型無變化[9]。
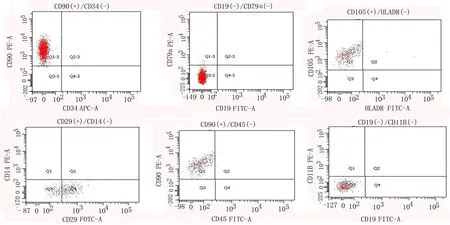
圖1 MSCs鑒定
2.2 白血病細胞株Jurkat IC50的測定 急性白血病細胞株Jurkat經不同濃度L-asp(0.01IU/ml、0.1IU/ml、1IU/ml、10IU/ml)處理48h后細胞存活率分別為(76.33±3.44)%、(57.23±3.55)%、(50.17±3.09)%、(39.27±4.37)%,可知Jurkat細胞株L-asp IC50濃度為(1.08±0.86)IU/ml。
2.3 共培養及L-asp對Jurkat細胞凋亡率的影響 通過FITC-PI雙染色法檢測Jurkat細胞凋亡率,FITC-Annexin V(+)/PI(-)細胞的百分比(A4象限),即為凋亡率。見圖2。

圖2 1例標本不同培養及處理組中Jurkat細胞凋亡率
2.3.1 L-asp對Jurkat細胞株凋亡率影響:通過流式細胞儀檢測Jurkat細胞株的凋亡率,發現單獨培養的Jurkat經L-asp處理后細胞凋亡率(36.83±5.69)%較對照組的(24.83±1.99)%增高,差異有統計學意義(P<0.01);同時發現L-asp處理的共培養實驗組1中Jurkat凋亡率(17.83±3.80)%也較共培養對照組(9.15±3.21)%高,差異有統計學意義(P< 0.01)。
2.3.2 MSCs對Jurkat細胞株凋亡率的影響:共培養對照組中Jurkat凋亡率(9.15±3.21)%較單獨培養對照組(24.83±1.99)%低,差異有顯著統計學意義(P<0.01)。且L-asp處理的共培養實驗組1(17.83±3.80)%比單獨培養實驗組Jurkat凋亡率(36.83±5.69)%低,差異有顯著統計學意義(P<0.01),說明MSCs對Jurkat細胞有保護作用。
2.3.3 VCR預處理MSCs對Jurkat細胞株凋亡率的影響:VCR預處理的共培養實驗組2 Jurkat凋亡率(25.87±4.68)%較無VCR預處理共培養實驗組1(17.83±3.80)%高,差異具有統計學意義(P<0.01),說明VCR預處理MSCs可降低MSCs對Jurkat細胞的保護作用。
2.4 共培養及L-asp對Jurkat細胞ASNS mRNA的影響
2.4.1 L-asp對Jurkat細胞株ASNS mRNA表達的影響:通過RT-PCR檢測ASNS表達水平,在單獨培養組中,L-asp處理后ASNS mRNA表達水平升高(2-ΔΔCt=1.846±0.038,P<0.05);在共培養組中,L-asp處理后ASNS mRNA表達水平也升高(2-ΔΔCt=4.102±2.212,P<0.05),差異有統計學意義。
2.4.2 MSCs對Jurkat細胞株ASNS mRNA的表達的影響:共培養對照組中ASNS mRNA的表達水平比Jurkat細胞單獨培養對照組低(2-ΔΔCt=0.057±0.030),差異有統計學意義(P<0.05)。但L-asp處理的共培養組實驗組1與單獨培養實驗組ASNS的mRNA表達水平無明顯變化(2-ΔΔCt=1.296±1.091),差異無統計學意義(P>0.05)。
2.4.3 VCR預處理MSCs對Jurkat細胞株ASNS mRNA表達的影響:VCR預處理的共培養實驗組2 ASNS mRNA的表達水平較無VCR預處理共培養實驗組1無明顯變化(2-ΔΔCt=1.101±0.586),差異無統計學意義(P>0.05)。
3 討論
目前對BM-MSCs的分離鑒定主要有三個方面:梭形細胞,呈貼壁性生長;細胞表面分子陽性和陰性選擇標記;自身增殖能力強,具有多向分化能力[9]。作為骨髓微環境主要組成部分之一,MSCs可以通過阻止藥物滲透入腫瘤細胞促進抗藥性(被動性),也通過分泌保護細胞因子或改變腫瘤細胞基因轉錄覆蓋的抗癌藥物的細胞毒作用(主動性)[4,10,11]。
與其他抗腫瘤藥物相比,L-asp的療效好、骨髓抑制等不良反應相對較輕,臨床研究表明ALL的預后和門冬酰胺酶治療的劑量強度有直接關系[1,6]。然而,L-asp耐藥限制了其在ALL中發揮更好的療效,人們觀察到對L-asp治療耐藥與其臨床療效差存在直接相關性,通常認為L-asp耐藥這可能與谷氨酰胺依賴性天冬酰胺合成酶(ASNS)酶的上調有關[2]。但是,一項臨床ALL樣本中ASNS mRNA水平的研究質疑了ASNS在L-asp耐藥性中的重要性。在16個細胞系中,ASNS基線基因表達模式將L-asp敏感性與耐藥性區分開來。但是,對于28個兒科ALL樣本,沒有一致的基線表達模式與對L-asp敏感性相關[12]。這些結果表明,ALL樣本中ASNS以外的因素會影響L-asp的易感性。直到Iwamoto等人[3]發現MSCs細胞可分泌大量的ASNS,補充ALL細胞L-asp化療后門冬酰胺的消耗而導致耐藥。
在本研究中,L-asp處理單獨培養組后,Jurkat細胞株細胞凋亡率升高,其ASNS的mRNA表達水平升高,說明Jurkat細胞株對L-asp敏感,L-asp消耗ASN后可至Jurkat細胞株中ASNS代償性升高;用L-asp處理共培養組后,Jurkat細胞的凋亡率也有升高,但ASNS mRNA表達水平明顯降低,這提示共培養組中MSCs可通過減少Jurkat細胞株的凋亡從而影響L-asp治療的敏感性,其ASNS mRNA的表達降低,可能是因共培養模型中的MSCs高表達ASNS mRNA,從而減少Jurkat細胞株ASNS mRNA的表達。
在評估MSCs對Jurkat的影響時筆者發現,共培養組中Jurkat凋亡率較單獨培養組低,其ASNS mRNA表達水平明顯降低;L-asp處理的共培養組與單獨培養組相比,Jurkat細胞株的凋亡率也降低,ASNS mRNA的表達水平卻無明顯變化。說明骨髓MSCs雖然可以增強Jurkat細胞株的抗凋亡能力,但在共培養模型中L-asp仍可起部分作用,MSCs高表達ASNS mRNA并抑制Jurkat中ASNS mRNA的表達,L-asp可使Jurkat中ASNS mRNA的表達升高,在MSCs與L-asp兩者的共同作用下,共培養組中Jurkat細胞株的ASNS mRNA表達無明顯變化。
現今兒童ALL常用化療方案中均采用長春新堿(VCR)和L-asp序貫治療,這種序貫治療的原則是,VCR可能有助于抑制對L-asp的過敏性反應[6]。同時,Li等[13]的研究發現,MSCs對抗微管藥物敏感,如VCR。Fung等[14]的研究結果發現通過VCR預處理共培養系統中的MSCs,可抑制部分MSCs對ALL保護作用。在本實驗中用VCR預處理MSCs后,共培養組中Jurkat細胞株的凋亡率升高,證實了這理論。假設VCR可通過抑制MSCs ASNS mRNA的表達,減少天冬酰胺的分泌來抑制對ALL的保護作用,那么經VCR預處理的共培養組中Jurkat細胞株經L-asp誘導后其內源性ASNS mRNA的表達水平會升高。而本實驗數據卻顯示內源性ANSN mRNA的表示水平只是稍有升高,差異無統計學意義。
究其原因,可能為VCR預處理MSCs后,只是部分抑制了MSCs的作用,而MSCs高表達ASNS mRNA,仍可部分或少量表達ASNSmRNA,分泌一些門冬酰胺來補償L-asp引起的消耗,因而共培養組中Jurkat細胞株不受L-asp的細胞毒性而致ASNS mRNA表達升高,比較L-asp處理的單獨培養組的凋亡率比共培養組高,與這一假設吻合。另一可能原因是VCR預處理MSCs 3d后,洗掉殘留的VCR,再用此MSCs共建培養組培養2d,此時MSCs細胞的已部分得到恢復,可部分表達ASNSmRNA。Li等[13]的研究也發現,予臨床用藥濃度VCR(0.1μmol/L),處理MSCs 3d后,可使MSCs的早期及晚期凋亡率達57.7%,然而撤藥后MSCs的凋亡率可得到部分恢復。
關于MSCs對白血病細胞的保護作用眾多復雜,如,有研究發現在酪氨酸激酶抑制劑(TKI)治療慢性髓性白血病期間,成纖維細胞生長因子2(FGF2)在MSCs中的表達增加,并保護白血病細胞[15]。Park等[16]的研究表明基質細胞中蛋白激酶C-β(PKC-β)的表達對腫瘤細胞的植入和正常B1細胞的發育至關重要,抑制基質細胞中的PKC-β可減輕環境介導的耐藥性。因此,不排除其他凋亡機制引起的共培養模型中Jurkat細胞株的凋亡率改變。
綜上所述,本文再次闡明ALL兒童骨髓MSCs影響白血病細胞對治療的敏感性及可能作用機制,下一步應該更深化相關機制及其與臨床治療反應、預后關系的研究,靶向MSCs或其分泌的因子可能是克服耐藥問題的有效策略。

