非酒精性單純性脂肪肝與非酒精性脂肪性肝炎患者血清脂質組學比較*
王 琳,林雪松,丁 楠
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)是一種常見的慢性肝病,我國NAFLD患病率大約為6%~38%[1]。NAFLD包括非酒精性單純性脂肪肝(nonalcoholic fatty liver,NAFL)、非酒精性脂肪性肝炎(non-alcoholic steatohep atitis,NASH)、非酒精性脂肪性肝病相關肝硬化和肝細胞癌(HCC)。NASH為NAFL發展至肝硬化的必經階段。若不能及時干預治療,NASH將逐漸進展成為肝纖維化、肝硬化和HCC[2]。通常,NAFL為良性病變,發展較為緩慢,但有20%左右NASH患者在10年內可能會進展為肝硬化,其中8%患者可能死亡。此外,NASH也是導致肝移植或HCC發生的第二常見病因[3]。因此,早期明確NAFLD臨床類型具有重要的意義。肝臟穿刺活檢是診斷NAFLD的“金標準”,但存在創傷性、術后可能出現并發癥等缺點,難以在患者病情動態監測過程中廣泛應用[4]。脂質組學是一種對組織、細胞或者血液脂質進行研究的科學,能對闡明NAFLD發生、發展機制和尋找疾病診斷標志物提供有力的支持[5]。本研究分析比較了不同臨床類型的NAFLD患者血清脂質組學的變化差異,現報道如下。
1 資料與方法
1.1 一般資料 2015年5月~2020年5月我院診治的NAFLD患者199例,男性124例,女性75例;年齡為30~59歲,平均年齡為(47.8±9.0)歲。符合中華醫學會肝病學分會脂肪肝和酒精性肝病學組以及中國醫師協會脂肪肝專家委員會發布的非酒精性脂肪性肝病防治指南 (2018年版)的標準診斷[6]。其中NAFL患者107例,男性65例,女性42例;平均年齡為(47.0±8.8)歲;NASH患者92例,男性59例,女性33例;平均年齡為(48.7±9.5)歲。排除標準:(1)合并終末期肝病;(2)先天性肝臟疾病;(3)自身免疫性肝病、藥物性肝損傷和酒精性肝病;(4)各種惡性腫瘤。本研究依據《赫爾辛基準則》開展,并通過我院醫學倫理委員會審核,患者簽署知情同意書。
1.2 臨床資料的收集 收集患者基本資料、血常規、肝腎功能、血糖、血脂等實驗室指標和Fibrotouch檢測的肝臟硬度檢測(LSM)和受控衰減參數(CAP)結果。
1.3 血清脂質組學分析 空腹采集靜脈血,采用超高液相色譜(美國Waters公司,Waters ACQUITY UPLC I-Class液相系統)和Waters Xevo G2-S Q-TOF高分辨飛行時間質譜系統進行血清脂質組學分析。色譜條件:C18 CSH 色譜分析柱,柱溫55℃,流動相A:乙腈和水比例為3:2;流動相B:異丙醇和乙腈比例為9:1;流動相A/B含有甲酸銨(10 mmol/L),線性梯度洗脫,流速為400μL/min,進樣量為1μL。質譜條件:ESI離子源,全信息串聯質譜(MSe)掃描模式。ESI選擇正負離子掃描模式,參數如下:碰撞電壓2500 v,錐孔電壓40 v,離子源溫度120℃,脫溶劑氣溫度500℃,脫溶劑氣流量為900 L/h,錐孔氣流量為50 L/h,采集質量數范圍為m/z 100~2000,其中ESI+模式下m/z為556.2771,ESI-模式下m/z為554.2615,注入流率為10 μL/min。

2 結果
2.1 兩組一般資料比較 NASH患者血清ALT、AST、GGT、ALP、TG和LSM水平顯著高于NAFL患者(P<0.05),兩組WHR、BMI、TC、HDL、LDL、FBG和CAP比較,差異均無統計學意義(P>0.05,表1)。
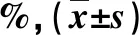
表1 兩組基線資料【】比較
2.2 脂質組學分析 基于UPLC-MS/MS方法對199例血清進行非靶向檢測,共檢測到2208個可定量的峰,去掉假陽性和噪音,最后檢測到脂質596個,建立OPLSDA模型,模型參數R2=0.73,Q2=0.46,提示建立的OPLSDA模型穩定合理。同時,根據NAFL組和NASH組每個樣本對應的積分建立OPLSDA散點得分圖,樣本坐標位于置信區間內且分散開來,表明NAFL組和NASH組患者血清脂質分布存在差異性(資料未列出)。
2.3 兩組脂質組學比較 根據OPLSDA模型計算變量權重值VIP。當VIP>1,說明血清樣品中存在明顯濃度變化的脂類代謝物,最終發現223個物質VIP>1,其中共有59個脂類物質在NAFL組和NASH組差異存在統計學意義(P<0.05)。與NAFL組比,NASH組有3種FFA、2種DAG、16種TAG、2種PC、1種PS、2種LPE、2種CE、4種SM、3種Cer水平升高(P<0.05),3種FFA、1種TAG、3種PC、5種PI、5種PlsCho、7種PlsEtn水平降低(P<0.05,表2~4)。

表2 兩組差異脂質代謝產物比較

表3 兩組差異脂質代謝產物比較

表4 兩組差異脂質代謝產物比較
3 討論
研究顯示[7-10],胰島素抵抗、炎癥、氧化應激、脂毒性和膽汁酸毒性均與NASH發展存在聯系。脂質代謝紊亂是NAFLD患者的一項重要特征,并與NAFLD從脂肪變性到NASH進展有關[11]。脂質組學作為一種廣泛用于分析脂質代謝的分析技術,有助于尋找NAFLD相關生物標志物[12]。本研究發現,NASH組有3種FFA、2種DAG、16種TAG、2種PC、1種PS、2種LPE、2種CE、4種SM和3種Cer水平升高,而有3種FFA、1種TAG、3種PC、5種PI水平、5種PlsCho和7種PlsEtn降低,提示NAFL和NASH患者發生變化的脂質成分主要為甘油磷脂、TG和鞘脂。
甘油磷脂為生物膜的重要組成部分,在人體內以PC和LPE最為豐富[13]。一旦體內PC合成受阻,就會抑制極低密度脂蛋白膽固醇的分泌、釋放,致使肝組織TG無法與其結合轉運出肝臟,進而導致肝組織TG堆積,最終推動NAFLD的發生和發展[14]。文獻[15]研究顯示,PE濃度在健康對照、NAFL和NASH患者中逐漸升高,NAFL存在脂質代謝紊亂,而NASH更為明顯。本研究中,有2種PC、2種LPE和1種PS水平升高,3種PC、5種PI水平降低。其原因可能與磷脂酰乙醇胺N-甲基轉移酶功能出現障礙,進而抑制LPE轉化為PC,導致LPE不斷積累,增加LPE轉化為PC有關。NAFLD患者TG所含飽和或者單不飽和脂肪酸相對含量與肝臟脂肪沉積程度呈正相關[16]。在本研究中,NASH患者TG水平高于NAFL,相比于NAFL,NASH患者有16種TAG、2種DAG、3種FFA水平升高,而有1種TAG和3種FFA水平降低,提示NASH患者脂質代謝紊亂更加嚴重。NASH患者DAG轉移酶活性升高,導致TG在肝臟內積累。因此,DAG和TAG與NASH脂質水平變化密切相關,可能是推動NAFL向NASH進展的重要脂質信號分子。鞘脂不僅是細胞膜的組成成分,也可參與細胞內信號通路以及細胞增殖和凋亡的調節[17]。本研究中,與NAFL患者比,NASH患者有4種SM和3種Cer水平升高。報道[18]也指出,NASH患者Cer和神經酰胺相關種類水平顯著高于NAFL患者。毒性脂質經β氧化后可產生大量的活性氧物質,進而損傷線粒體功能。同時,毒性脂質還會誘發內質網應激,刺激炎性細胞因子釋放,造成肝功能損傷[19]。內源性抗氧化劑在預防或者延遲脂質氧化過程中發揮著重要的作用[20]。本研究中,NASH患者PlsCho和PlsEtn水平明顯低于NAFL患者,提示氧化應激增強在NASH進展過程中起著重要的作用。總之,本研究表明NAFL和NASH患者血清脂質代謝發生了明顯的變化,進而促使脂毒性的發生,導致NAFL進展為NASH。

