超聲與CT診斷單囊型肝囊性包蟲病的價值*
齊寶文 張夢琪 張 利 馬志剛
新疆維吾爾自治區人民醫院 1 超聲科 2 放射影像中心 3 肝膽外科,新疆烏魯木齊市 830001
肝包蟲病是由棘球絳蟲寄生在機體肝臟后引起的一種人畜共患的常見寄生蟲病,主要分為囊型肝包蟲病和泡型肝包蟲病,其中以囊型為主[1]。世衛組織[2]將囊型肝包蟲病根據其影像學特征分為五型:單囊型、多子囊型、內囊塌陷型、實變型、鈣化型。根據包蟲的病理及病程分為活性、交界性、非活性三類,從Ⅰ型肝包蟲囊腫到Ⅴ型內囊的活性是一個由高到低的過程,目前一致認為CE Ⅰ型、CE Ⅱ型為有活性,CE Ⅲ型為過渡型,CE Ⅳ、 CE Ⅴ型為非活性[3]。由于單囊性囊型肝包蟲病的寄生蟲活性高,包蟲囊在體內呈膨脹性生長,可出現壓迫癥狀且易出現并發癥,包括感染、過敏、門靜脈高壓等,甚至包蟲囊腫破入腹腔,尤其以CE Ⅰ型[4]居多,但是在實際工作中,此型包蟲極其容易誤診,因此早發現、準確診斷、及時治療具有重要的臨床意義,故本研究中討論單囊型肝囊性包蟲病超聲與CT影像學診斷對于臨床診療的價值。
1 資料與方法
1.1 一般資料 選擇2013年1月—2019年12月我院臨床懷疑的單囊型肝囊性包蟲病140例患者,共計155個病灶為研究對象,術前均行CT和超聲檢查,經手術和病理確診,其中男84例,女56例,年齡3~65歲,平均年齡(35.56±6.61)歲。部分患者無臨床體征,體檢發現,有癥狀的患者臨床主要表現為右上腹隱痛、消瘦、消化不良等。
1.2 診斷與排除標準 根據《肝兩型包蟲病診斷與治療專家共識(2015版)》的診斷標準,結合流行病學史、典型影像學特征、免疫學診斷及術中病理,診斷為單囊型肝囊型包蟲病。所有CT檢查結果均由2名高年資醫師進行評判,對有爭議的結果經討論后統一結論;所有超聲檢查由2名超聲醫師共同完成,結果不一致時經討論后統一結論。排除其他肝臟囊性占位灶,以及除CE Ⅰ型以外的肝囊性包蟲病病例。
1.3 方法
1.3.1 超聲檢查:使用GE logiq E9 型、飛利浦IU22型彩色多普勒超聲診斷儀進行檢查,超聲儀器配備凸振探頭(3.5~5.0MHz),進行肝臟及腹腔補充探查,發現肝內囊性病灶后切換至線振探頭(5.0~12.0MHz),重點觀察囊性病灶壁厚及有無雙層壁結構,如若高頻探頭穿透力有限,需切換至凸振探頭、局部放大,觀察有無雙層壁結構及壁厚,記錄病灶大小、位置、內部回聲、血流信號及毗鄰關系,并將這些信息取圖存檔。所有患者須空腹8h以上,檢查過程中患者取左側臥位或者仰臥位,仔細多切面探查肝臟,并詢問患者既往病史和有無牧區生活的流行病學史。
1.3.2 CT檢查:使用GE或者飛利浦128排CT掃描,檢查范圍自膈頂至盆腔,層厚為5mm,層間距為5mm,增強掃描造影劑使用非離子型碘海醇。所有圖像上傳至工作站,記錄病灶大小、位置及測定CT值。
1.4 統計學方法 采用 SPSS25.0軟件分析數據,計數資料采用χ2檢驗; 診斷效能通過靈敏度、特異度等指標反映; 超聲、CT與病理診斷的一致性分析采用 Kappa 檢驗,P<0.05時差異有統計學意義。
2 結果
2.1 超聲與CT在單囊型肝囊性包蟲病影像特征分析 單囊型肝囊性包蟲病超聲聲像圖表現為圓形的囊性占位,囊壁增厚,呈“雙壁征”,后方回聲增強,箭頭所示處見雙層囊壁回聲,囊內見細小點狀強回聲(圖1a、b),而厚壁囊腫超聲聲像圖顯示囊壁厚,未觀察到雙層壁結構(圖1d、e)。單囊型肝囊性包蟲病的CT圖像為病灶處出現類圓形的,呈低密度影,邊界清晰,增強掃描時均無明顯變化,類似于囊腫,未顯示雙層壁(圖1c),厚壁囊腫的CT圖像為囊腫(圖1f)。
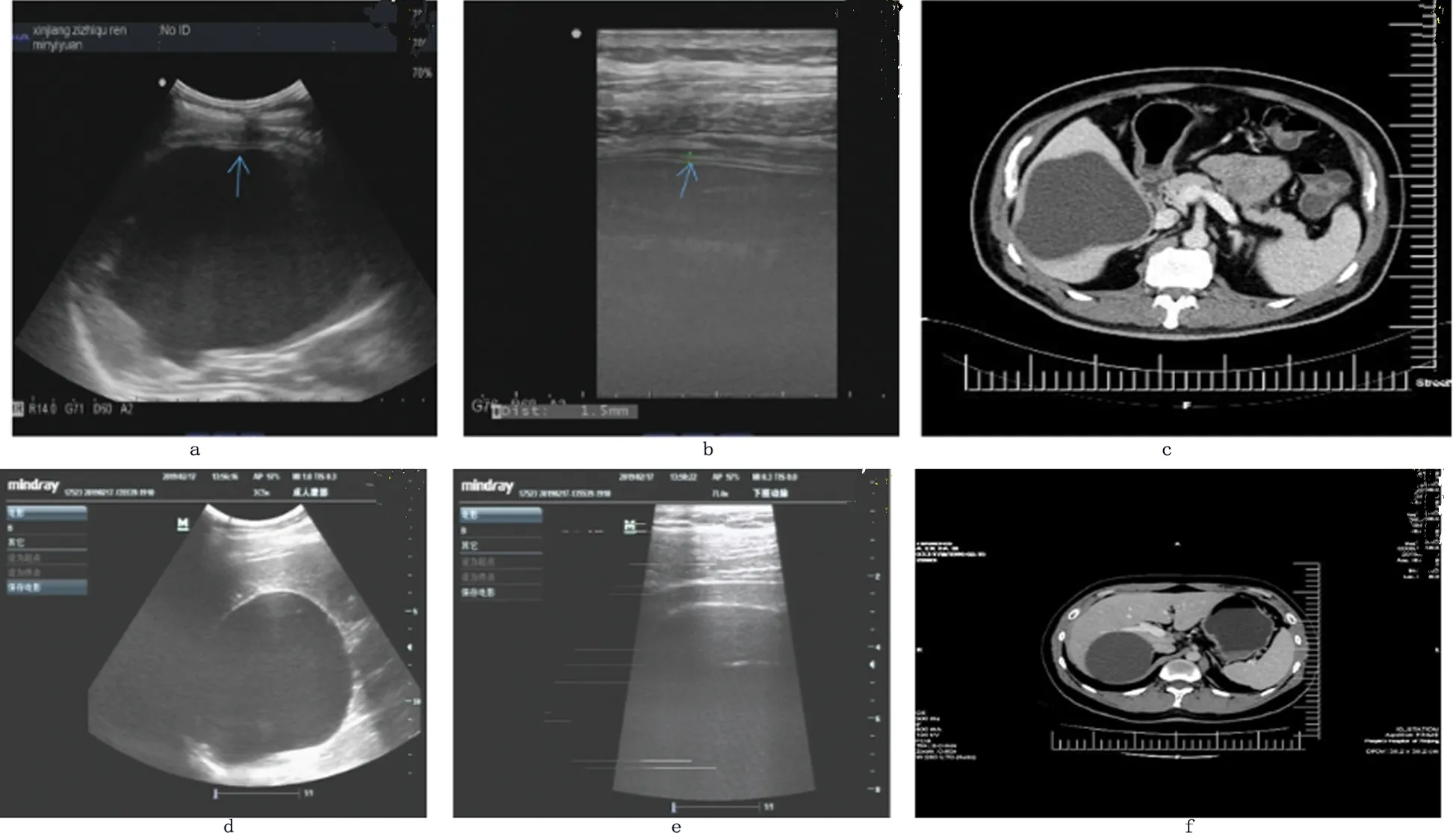
圖1 超聲與CT在單囊型肝囊性包蟲病影像特征
2.2 超聲、CT與病理檢查的診斷效能 140例疑似包蟲患者,共計155個病灶,經手術病理證實135個病灶為包蟲囊腫,20個為非包蟲病灶。超聲檢測囊性包蟲病灶134個;非包蟲病灶為21個。超聲與病理一致性比較,Kappa值為0.747(P<0.001),見表1。CT檢測囊性包蟲病灶115個,非包蟲病灶為40個。CT檢測與病理一致性比較,Kappa值為0.436(P<0.001),見表2。這些結果表明超聲與病理一致性較好,CT與病理一致性一般。

表1 超聲對單囊型肝囊性包蟲病患者的診斷效能分析(n)

表2 CT對單囊型肝囊性包蟲病患者的診斷效能分析(n)
2.3 超聲與CT對單囊型肝囊性包蟲病的診斷價值 按診斷性試驗的評價標準計算,計算超聲與CT診斷單囊型肝囊性包蟲病的敏感度、特異度、準確率、繪制ROC曲線,見超聲的AUC為0.881,95%可信區間0.776~0.987,差異有統計學意義(P<0.001)。CT的AUC為0.811,95%可信區間0.703~0.919,差異有統計學意義(P<0.001),見表3、圖2。
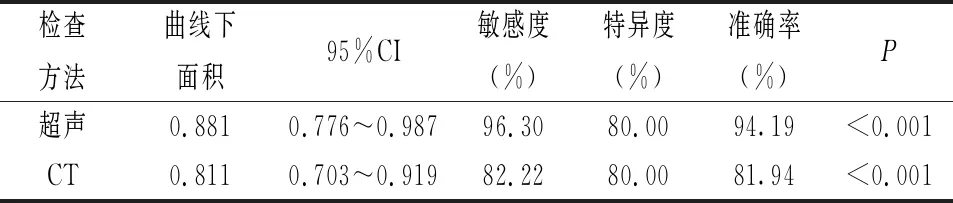
表3 超聲與CT對單囊型肝囊性包蟲病的診斷價值
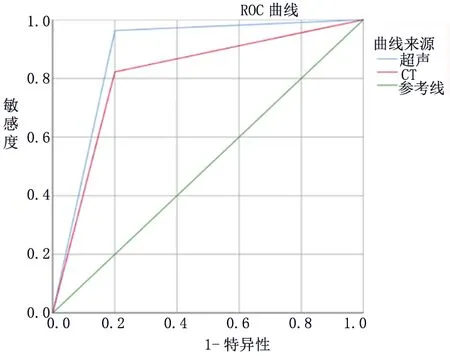
圖2 CT和超聲ROC分析
2.4 單囊型肝囊性包蟲病灶大小與囊壁厚度相關性分析 根據包蟲大小和囊壁厚度的相關性分析可以看出,包蟲大小和囊壁厚度呈顯著負相關(r=-0.870,P<0.05),見圖3。
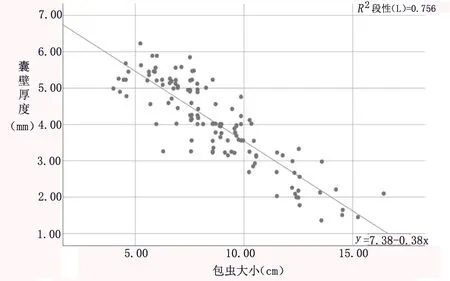
圖3 包蟲大小與囊壁厚度相關性散點圖
3 討論
超聲檢查是一種無創、快速、簡便的檢查手段,是目前主要的檢查方法之一。單囊型肝包蟲具有內囊、外囊結構,外囊屬于宿主免疫功能生成的屏障,內外囊之間無血管聯系,構成了影像學雙層壁顯像的基礎[5]。單囊型肝囊型包蟲病的超聲表現為單發的圓形或橢圓形無回聲區,囊壁光滑、厚壁,內、外囊的雙層壁征象,此結構是單囊型肝囊性特征性征象,囊內可出現囊沙征象,但是超聲診斷結果易受檢查者對此病主觀認知不足、操作手法及經驗等因素影響,易與肝囊腫或者肝膿腫混淆,從而降低了檢查結果的準確性。本實驗中超聲誤診3例肝囊腫為肝包蟲的病例也表現為厚壁,誤認為雙層壁結構,其內也表現為云霧狀及絮點狀回聲蠕動,術后發現2例為肝囊腫合并感染、1例為肝囊腫合并出血,既往文獻報道[6]囊沙征是診斷單囊型囊性包蟲病的特異征表現,但是在實際工作中發現囊沙征不僅在囊型包蟲病聲像圖中可出現,肝囊腫[7]合并出血、感染或者液化較好的細菌性肝膿腫亦可出現,故需結合患者病史、臨床癥狀及血的包蟲血清學綜合判斷。本實驗中所有病例超聲檢查均運用到高頻超聲及低頻超聲檢查及相互結合[8-9],為提高診斷的準確性應著重觀察有無雙層壁結構,總結檢查經驗如下:(1)對于體積較大的病灶,使用高頻探頭在病灶近體表處觀察病灶囊壁;(2)對于病灶位置較深,高頻探頭因穿透力有限需使用低頻腹部探頭局部放大觀察囊壁;(3)不論病灶大小,最后使用低頻腹部探頭觀察病灶整體結構、囊壁有無鈣化、囊內容物及血流信號,以及膽管、血管解剖關系,肝內有無多發的病灶。Ran等[10]的研究中96.00%的病例顯示了雙層壁結構,本次實驗中的準確性為94.19%,ROC曲線下的面積為0.881,準確性與已有報道相似,但本次研究采取的結合診斷方法有利于檢測的準確性提升。
單囊性肝囊型包蟲病的CT表現為類圓形的低密度影,囊內類似于水樣密度,CT值約10~20Hu,界限清晰,囊壁光滑,增強掃描時囊壁無強化,與肝囊腫十分相似,故易與肝囊腫混淆,CT對于單囊性肝囊性包蟲囊壁的顯示率約75%[11-12]。本研究中準確性為81.94%,ROC曲線下的面積為0.811,有24例包蟲誤認為肝囊腫。其準確性明顯低于超聲檢測。
本次研究中超聲在顯示雙層壁結構比CT有優勢,能夠對CEⅠ型定性診斷,但是CT能夠提供肝包蟲囊壁細小鈣化[13],尤其在發生并發癥[14]與膽管、血管的空間關系,能夠給手術提供較多的信息。鈣化也是包蟲病的病理性特征之一,是與肝內其他囊性病變的鑒別標志,鈣化存在于囊性肝包蟲病的各個時期,且鈣化形式多種多樣[15]。謝天皓等[16]報道的217個病灶中,單囊性肝囊型包蟲病以囊壁小點狀及線狀鈣化常見,CE Ⅰ型鈣化的發生率約10.9%,雖然鈣化出現率較低,但是在體積較大的單囊型肝包蟲病例診斷中超聲是很困難的,超聲也易受到過度肥胖、積氣及肋骨的以及本身包蟲在肝內位置等因素的影響,所以二者具有互補性,從而為手術決策提供更多信息。
本研究還發現在單囊型肝囊性包蟲病病例中,超聲測量的囊腫大小與內外囊之間的距離有相關性,由于CEⅠ型包蟲活性強,一般每年生長5~10mm,隨著內囊及子囊的生長,囊腔內壓力逐漸增高,而外囊是包繞內囊的且限制內囊的生長,二者之間的距離理論上應該有變化。早期肝囊性包蟲的壓力高達30~80cmH2O(1cmH2O=0.098kPa)[16],李江等[17]研究表明CEⅠ型囊內壓力最高,Ⅰ型到Ⅳ型包蟲囊腫囊內壓呈逐漸下降的趨勢,多項文獻[4,18-20]報道術中發現破裂的囊性包蟲病以CEⅠ型居多,且囊腫體積大、囊壁菲薄且高張力,王瑞濤等[21]在包蟲囊腫破入腹腔的薈萃分析中385例患者,其中98例直徑>10cm,都符合CEⅠ型囊性包蟲呈膨脹性、有張力的生長方式。雖然導致CEⅠ型破裂的外在因素比較多,但CEⅠ型包蟲的膨脹性生長、囊腫體積大、囊內高壓也是不能忽略的因素,囊內高壓、囊腫大小是否會導致內外囊之間間距的變化(以往文獻稱為囊壁厚度)既往報道較少,本研究表明了內外囊之間的間距與囊腫大小呈負相關,也增加了較大的CEⅠ型囊腫識別雙層壁的難度,故檢查中應用高頻探頭是很有必要的。
綜上所述,超聲的診斷單囊型肝囊型包蟲病價值較CT高,是一種簡單、無創、費用低的實用檢查方法,也便于在流行病疫區開展篩查工作,使用高頻探頭及低頻的探頭相互結合,很好地辨識了單囊型肝囊性包蟲病的雙層壁,提高了診斷準確性,易與肝內非包蟲囊性病灶鑒別。

