茶多酚對膿毒癥大鼠肝損傷的作用研究*
張鳳偉,桑珍珍,王淑娟,賈春梅,王 偉
(滄州市中心醫院急診醫學部,滄州 061000)
膿毒癥是感染、燒傷、創傷、休克等急危重患者的嚴重并發癥,患者機體難以控制的炎癥反應導致機體多個器官出現急性功能損傷,發展為膿毒性休克和多器官功能衰竭[1]。膿毒癥患者病情發展十分迅速,盡管目前有良好的監護措施及診療技術,但其發病率和病死率仍較高。肝臟血運豐富,并且具有免疫、代謝、解毒等重要功能,是膿毒癥最常受累的器官之一,膿毒癥病理過程涉及炎癥、氧化應激的過度激活,釋放大量炎癥因子,導致肝損傷[2]。肝損傷可出現在膿毒癥的各個時期,是多器官功能衰竭和死亡的獨立危險因素,盡早發現和干預可以改善膿毒癥肝損傷患者的預后[3]。茶多酚(tea polyphenols,TP)是綠茶葉中酚類化合物及其衍生物的總稱,主要包括表沒食子兒茶素沒食子酸酯、沒食子兒茶素沒食子酸酯、表兒茶素沒食子酸酯、表沒食子兒茶素、咖啡堿、表兒茶素及兒茶素等,是綠茶的主要活性物質。國內外大量研究顯示,TP在調節炎癥反應、細胞凋亡、氧化應激、抗腫瘤等方面發揮了重要作用[4-5],亦有學者發現其可參與膿毒癥的發生發展和調控的過程[6]。但TP 是否對膿毒癥肝損傷具有保護作用目前相關報道仍較少。因此,本研究通過探討TP 對膿毒癥大鼠肝損傷的保護作用及其作用機制,以期為膿毒癥臨床治療尋求新的方向,減少膿毒癥引起的肝功能衰竭,改善患者的預后,并且為明確TP改善肝損傷的藥理作用提供科學依據。
1 材料與方法
1.1 大鼠盲腸結扎穿刺法(cecum ligation and puncture,CLP)模型的建立及分組 40 只7 周齡健康雄性成年SD大鼠購自東方生物服務公司(南京)。實驗方案經滄州市中心醫院倫理委員會批準,符合《實驗動物護理與使用指南》(IACUC-190525-12)。所有大鼠維持12 h的光/暗循環,并隨意喂食食物和水。實驗前,讓大鼠適應環境1周。將SD大鼠隨機分為4組:Sham組(術后每天300 mg/kg生理鹽水灌胃)、Sham+TP 組(CLP 術后每天300 mg/kg TP 灌胃)、CLP 組(CLP 術后每天300 mg/kg 生理鹽水灌胃)、CLP+TP 組(CLP 術后每天300 mg/kg TP 灌胃),每組10 只。采用CLP 建立膿毒癥模型[7]:異氟醚麻醉下,正中切口1.5 cm 暴露盲腸,隨后在距盲腸尖端1 cm處用5-0絲線結扎,用18號針頭穿刺盲腸,擠壓出少量糞便,然后用無菌4-0 絲線縫合切口。Sham組和Sham+TP組行剖腹手術,但不結扎、不穿孔。術后皮下注射1 mL 生理鹽水進行液體復蘇。7 d后麻醉處死大鼠,并取出肝臟組織、全血。
1.2 大鼠肝臟組織形態學檢查 大鼠肝臟組織用4%多聚甲醛固定24 h后進行切片,進行蘇木精-伊紅(HE)染色(麥克林,上海):對切片用無水乙醇-二甲苯溶液脫蠟,洗滌后浸入蘇木精溶液中染色5~8 min 取出洗滌,浸入伊紅溶液染色3 min 取出洗滌,依次放入無水乙醇—二甲苯中5 min,使用中性樹膠封片。400 倍光學顯微鏡(Olympus,日本東京)下觀察并采集圖像,重復3次。
1.3 大鼠血清肝功能檢測 取全血3 000 r/min 離心15 min,收集上層血清待測。采用微量法活性檢測試劑盒(索萊寶,北京)檢測大鼠血清谷草轉氨酶(aspertate aminotransferase,AST)及谷丙轉氨酶(alanine aminotransferase,ALT)等肝臟功能的指標。根據試劑盒說明書操作,重復3次。
1.4 大鼠肝臟細胞凋亡測定 使用脫氧核糖核苷酸末端轉移酶介導的缺口末端標記法(TdT-mediated dUTP Nick-End Labeling,TUNEL)試劑盒(Roche,德國)評估大鼠肝臟細胞凋亡情況。剪取少量肝臟組織,加入胰蛋白酶-EDTA 消化液,置于37 ℃培養箱中20 min,收集上清液過濾,800 r/min離心5 min,收集底層肝臟細胞,PBS 洗滌5 組肝臟細胞后,利用4%多聚甲醛固定細胞30 min 后再次進行洗滌,隨后用含0.1%Triton X-100 的PBS 重懸細胞,冰孵2 min 后再次洗滌2 次。加入50 μL TUNEL 檢測液,37 ℃避光孵育60 min,PBS 洗滌2 次,250 μL PBS懸浮細胞,涂片后在熒光顯微鏡下觀察并進行定量分析,重復3次。
1.5 大鼠肝臟組織白細胞介素-6(IL-6)的表達
肝臟組織在10%福爾馬林溶液中置于4 ℃冰箱固定72 h。然后,對樣品進行常規處理和石蠟包埋。然后將組織切成4 μm 厚度使用IL-6 兔抗大鼠一抗(Abcam,美國,稀釋濃度1∶50)、山羊抗兔二抗(索萊寶,北京,稀釋濃度1∶200)進行免疫組化染色(Immuno histochemistry,IHC),根據SP 試劑盒(中山金橋,北京)說明書操作,顯微鏡觀察染色情況,重復3次。
1.6 大鼠肝組織IL-6和腫瘤壞死因子-α(TNF-α)檢測 采用酶聯免疫吸附試劑盒(建成,南京)測定4 組大鼠肝組織IL-6 和TNF-α,重復3 次,參照試劑盒說明書操作。
1.7 大鼠肝臟組織氧化應激標志物檢測 檢測肝臟勻漿的上清液氧化應激標記物水平。根據生物診斷試劑盒(Dokki,埃及)說明書,對過氧化氫酶(catalase,CAT)及超氧化物歧化酶(superoxide dismutase,SOD)進行檢測,重復3次。
1.8 統計學方法 采用SPSS 21.0軟件進行統計分析。計量資料以均數±標準差(±s)表示,多組間比較采用單因素方差分析(one-way ANOVA),組間兩兩比較采用LSD-t檢驗,以P<0.05為差異有統計學意義。
2 結果
2.1 TP對膿毒癥大鼠肝損傷具有保護治療作用
Sham 組大鼠肝形態正常,與Sham 組比較,Sham+TP 組肝形態無明顯改變,說明TP 對大鼠肝臟無明顯毒副作用;CLP 組大鼠肝臟出現大空泡,說明肝臟受到損傷;而CLP+TP 組大鼠肝臟大空泡較CLP 組明顯減少,說明TP 可改善膿毒癥大鼠肝臟組織形態學表現,見圖1。與Sham 組相比,Sham+TP組AST及ALT的水平比較,差異無統計學意義(P>0.05);CLP 組與Sham 組相比,AST 及ALT 的水平增高(P<0.001);CLP+TP 組與CLP 組相比,AST及ALT的水平降低(P<0.01),見表1。
表1 TP處理對膿毒癥大鼠血液中AST、ALT含量的影響U/L, ±s

表1 TP處理對膿毒癥大鼠血液中AST、ALT含量的影響U/L, ±s
與Sham組相比,###P<0.001;與CLP組相比,**P<0.01。
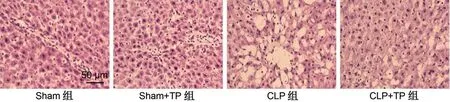
圖1 各組大鼠肝臟組織形態學(HE,×400)
2.2 TP可減少膿毒癥大鼠肝臟細胞凋亡 與Sham組相比,Sham+TP組TUNEL陽性細胞比例比較,差異無統計學意義(P>0.05);與Sham組相比,CLP組TUNEL陽性細胞比例增加(P<0.001);與CLP組相比,CLP+TP 組TUNEL 陽性細胞比例降低(P<0.01),見圖2、表2。
表2 TP處理對膿毒癥大鼠肝臟細胞中TUNEL染色陽性細胞比例的影響%, ±s

表2 TP處理對膿毒癥大鼠肝臟細胞中TUNEL染色陽性細胞比例的影響%, ±s
與Sham組相比,###P<0.001;與CLP組相比,**P<0.01。
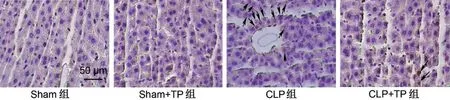
圖2 TP對膿毒癥大鼠肝臟細胞凋亡的影響(×400)
2.3 TP對膿毒癥大鼠肝臟組織中炎癥反應的影響
IL-6陽性反應呈棕色。Sham+TP組及Sham組大鼠肝臟組織中均無明顯的IL-6陽性表達;在CLP組中,可見大量IL-6陽性表達,而CLP+TP組IL-6陽性表達減少,見圖3。與Sham 組相比,Sham+TP 組IL-6及TNF-α水平比較,差異均無統計學意義(P>0.05);與Sham組相比,CLP組IL-6及TNF-α水平增高(P<0.001);與CLP 組相比,CLP+TP 組IL-6 及TNF-α水平降低(P<0.01),見表3。
表3 TP處理對膿毒癥大鼠肝臟中IL-6、TNF-α含量的影響pg/mL, ±s

表3 TP處理對膿毒癥大鼠肝臟中IL-6、TNF-α含量的影響pg/mL, ±s
與Sham組相比,##P<0.01,###P<0.001;與CLP組相比,**P<0.01,***P<0.001。
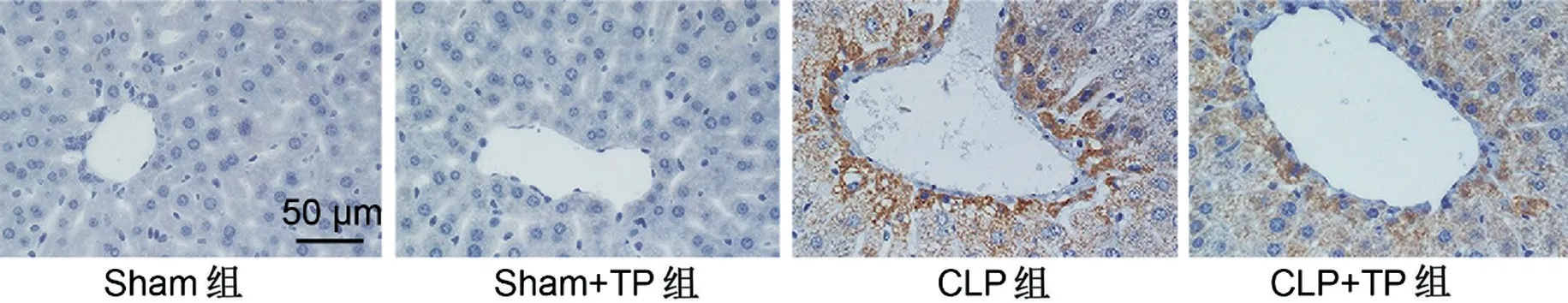
圖3 免疫組化染色觀察TP對輕膿毒癥大鼠肝臟組織中IL-6水平的影響(×400)
2.4 TP對膿毒癥大鼠肝臟組織中氧化應激反應的影響 與Sham 組相比,Sham+TP 組CAT 及SOD 水平比較,差異均無統計學意義(P>0.05);與Sham組相比,CLP 組CAT 及SOD 水平降低(P<0.01);與CLP組相比,CLP+TP組CAT及SOD水平增高(P<0.05),見表4。
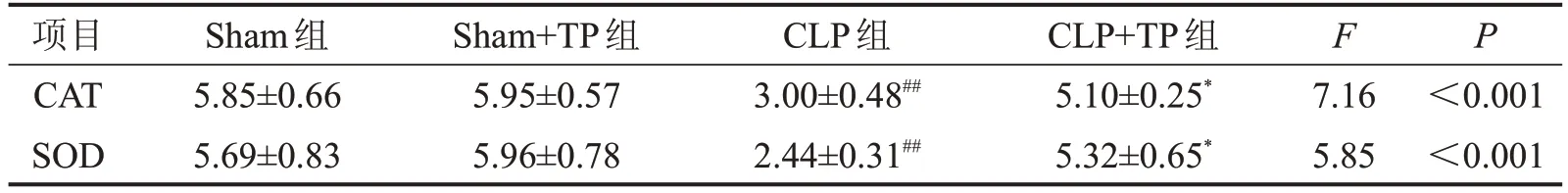
表4 TP處理對膿毒癥大鼠肝臟組織中的CAT、SOD含量的影響U/mg,n=10
3 討論
近年來,膿毒癥發病率在全世界范圍內仍呈現明顯增高的趨勢,且死亡率居高不下[8]。肝臟是膿毒癥最常受累的靶器官之一,與預后密切相關。膿毒癥后的肝功能障礙是多器官功能障礙和膿毒癥誘發的死亡的獨立危險因素,給臨床診療帶來了較大的困擾[9-10]。膿毒癥發生時肝臟微循環血流量減少,肝竇灌注降低,肝功能降低,本研究應用CLP誘導的膿毒癥大鼠肝損傷模型,發現CLP組大鼠肝臟出現大空泡,且CLP組與Sham組相比,AST及ALT的水平增高,說明膿毒癥時大鼠的肝臟受損,并且在這一病理過程中,大鼠肝臟組織中炎癥及氧化應激存在過度激活。
TP是茶葉中非常重要的成分,作為一種天然的酚類化合物參與過氧化過程中螯合脂質過氧化自由基,降低多酚自由基含量,阻斷自由基氧化鏈反應,從而有效清除自由基,現已被國內外學者廣泛應用于過氧化引起的多種疾病治療中,如梗阻性黃疸肝損傷、急性肝損傷、酒精性肝損傷和肝癌,發揮肝保護作用[11-12]。為驗證TP對膿毒癥大鼠肝損傷是否具有保護作用,本研究通過給予CLP大鼠模型TP治療,發現CLP+TP 組大鼠肝臟大空泡較CLP 組減少,CLP+TP 組AST 及ALT 的水平低于CLP 組,說明TP 對膿毒癥大鼠肝損傷具有保護治療作用。肝細胞凋亡或者壞死是造成肝臟損傷和肝臟疾病最基本的中心環節,在膿毒癥肝損傷的發生發展中具有重要的作用[13]。本研究采用TUNEL 染色對各組大鼠肝臟細胞凋亡進行研究,結果顯示,Sham 組的大鼠采用TP 或者生理鹽水灌胃后CLP 組TUNEL陽性細胞比例高于Sham 組,而膿毒癥模型大鼠經TP 治療后,TUNEL 陽性細胞比例降低,提示TP 可減少膿毒癥大鼠肝臟細胞凋亡。
炎癥細胞過度激活并釋放大量炎癥因子是膿毒癥發生發展的重要機制之一。有研究顯示,膿毒癥能引起的肝損傷涉及炎癥反應及氧化應激的過度激活,此時體內可產生大量的氧自由基,而自由基的形成及其引發的脂質過氧化反應是肝損傷的主要機制之一,并且已有文獻報道炎癥因子如TNFα 直接參與肝壞死的發生,在膿毒癥肝損傷中發揮重要的作用[14-15]。而TP已被證實在多種生理及病理過程中可發揮抗炎及抗氧化的作用,不僅可減少細胞內因氧化和自由基引起的DNA 損傷,保護組織,還可與過氧化氫自由基反應,終止脂質過氧化反應[16-17]。本研究大鼠肝臟組織切片IHC 染色發現,Sham 組的大鼠肝臟組織中均無明顯IL-6 表達。Sham+TP 組、Sham 組的大鼠肝臟IL-6 及TNF-α 水平比較,差異均無統計學意義,且CAT 及SOD 水平比較,差異均無統計學意義,說明手術過程及灌胃處理對大鼠的炎癥因子、氧化應激因子的表達無顯著影響,而膿毒癥模型大鼠的IL-6及TNF-α水平均增高,CAT及SOD水平降低,且經TP治療的大鼠模型的肝臟組織IL-6及TNF-α水平降低,CAT及SOD水平增高,提示TP在膿毒癥引起的肝損傷這一病理過程中可發揮其抗炎及抗氧化的作用。
綜上所述,TP可通過抑制膿毒癥引起的肝臟炎癥及氧化應激反應進而發揮其對肝臟的保護作用,并且具有一定的安全性,可為膿毒癥的臨床治療及輔助用藥提供新的思路,但對于TP改善膿毒癥引起肝損傷的具體作用機制仍然需要進一步研究。

