‘麥緣錦楸’葉色表型qRT-PCR 內參基因篩選及驗證
楊英英,趙林姣,楊桂娟,張 玉,付鵬躍,4,胡繼文,劉 瑩,王 楠*
(1.三峽大學生物技術研究中心,湖北 宜昌 443002;2.林木遺傳育種國家重點實驗室,中國林業科學研究院林業研究所,國家林業和草原局林木培育重點實驗室,楸樹國家創新聯盟,北京 100091;3.西南林業大學林學院,云南 昆明 650224;4.東北林業大學林木遺傳育種國家重點實驗室,黑龍江 哈爾濱 150040)
實時熒光定量PCR(qRT-PCR)是一種常見的檢測基因表達水平的技術手段,它可以將常規PCR 和熒光檢測技術相結合,實時監控PCR 擴增的過程[1],具有成本低、靈敏度高、特異性強等特點[2],被廣泛應用于新基因挖掘及功能研究[3]。由于qRT-PCR 技術的檢測結果受到樣本、實驗條件、RNA 質量及純度、反轉錄效率等因素的影響[4],因此,想要獲取準確度高的試驗結果,就必須使用合適的內參基因進行校準[5]。
在大多數基因表達分析研究中,常選用能夠維持細胞骨架或參與細胞基本生命過程的管家基因作為內參基因,如肌動蛋白基因(Actin)、α/β 微管蛋白基因(TUA/TUB)、3-磷酸甘油醛脫氫酶基因(GAPDH),多聚泛素酶基因(UBQ)以及18S核糖體RNA(18S)等[6]。然而,近年來有研究發現,這類管家基因的表達穩定性也會受到物種和組織差異的影響[7]。如在連翹葉片中UKN1的表達最穩定,但在花和花蕾中最穩定的基因是ACT和SDH[8];在茉莉不同器官(根、莖、葉及花)中篩選出的理想內參也存在差異[9]。此外,同一物種內參基因的選擇也受不同脅迫條件的影響,如EXP1和PP2A在高鹽脅迫后的北沙參中是最穩定的內參基因,而在MeJA 處理后CYP2和α-TUB是最穩定的內參基因[10]。楊樹不同發育時期中篩選到的理想內參基因是U6-1、EIF4A和PP2A-2[11],而蘇曉娟等發現,鋅脅迫下楊樹的actin、ubiquitin、EF1α和18S r RNA基因表達最為穩定[12],儲文淵等發現,楊樹在鹽和干旱脅迫下,其新內參基因PtRG1,PtRG3和PtRG5比傳統內參基因的表達更加穩定[13]。因此,內參基因并不具有通用性,在開展特定研究材料或實驗條件的實時熒光定量分析前,首先應進行該物種特異性內參基因的篩選[14]。
灰楸(Catalpa fargesiiBur.)是紫葳科、梓屬落葉喬木,是我國珍貴的用材樹種和著名的園林觀賞樹種,素有“木王”之稱。‘麥緣錦楸’是從灰楸實生苗選育出的新品種,其葉片呈現中間綠邊緣黃的特征,目前已通過高干嫁接技術廣泛應用于園林綠化等方面。課題組前期對‘麥緣錦楸’和灰楸的生理生化指標進行測定,發現不同顏色部位葉片的色素含量及葉綠素熒光參數存在顯著差異[15]。想要進一步揭示該生理現象的分子機理,就需要分析‘麥緣錦楸’葉色形成途徑中差異基因的表達模式[16],然而,目前尚未見梓樹屬對不同葉色表型篩選內參基因的相關報道,因此,開展‘麥緣錦楸’葉片內參基因的選擇研究,以提高基因表達量的可靠性是十分必要的。本研究借助課題組前期的轉錄組數據,通過比較‘麥緣錦楸’和灰楸不同組織部位的基因表達量,初步篩選出表達相對穩定的6 個基因CfUBC、CfActin11、>CfPP2A、CfMADH、CfGADPH、CfEF-1以及本課題組常用的內參基因CbuActin[17],共7 個候選內參基因進行qRT-PCR 分析,利用GeNorm、NormFinder 和BestKeeper 等軟件綜合分析并篩選出‘麥緣錦楸’不同葉色中表達相對穩定的內參基因;接著以萜類合成相關基因(CfGES)進一步驗證上述分析結果的可靠性。本研究將使‘麥緣錦楸’與灰楸葉片基因表達的標準化和定量化更加準確,并為后期開展‘麥緣錦楸’黃綠葉色分區形成的分子研究奠定基礎。
1 材料與方法
1.1 試驗材料
試驗材料取自河南省洛陽市扁擔趙基地。樣品采集后,立即用刀片將‘麥緣錦楸’葉片黃綠部分切分,分別命名為Y1(黃色)、Y2(綠色),灰楸葉片對應部位分別命名為G1、G2(圖1)。切好的葉片用錫箔紙包裹后立即置于液氮中速凍,并轉至-80℃保存。所有的樣品均設置3 次生物學重復。
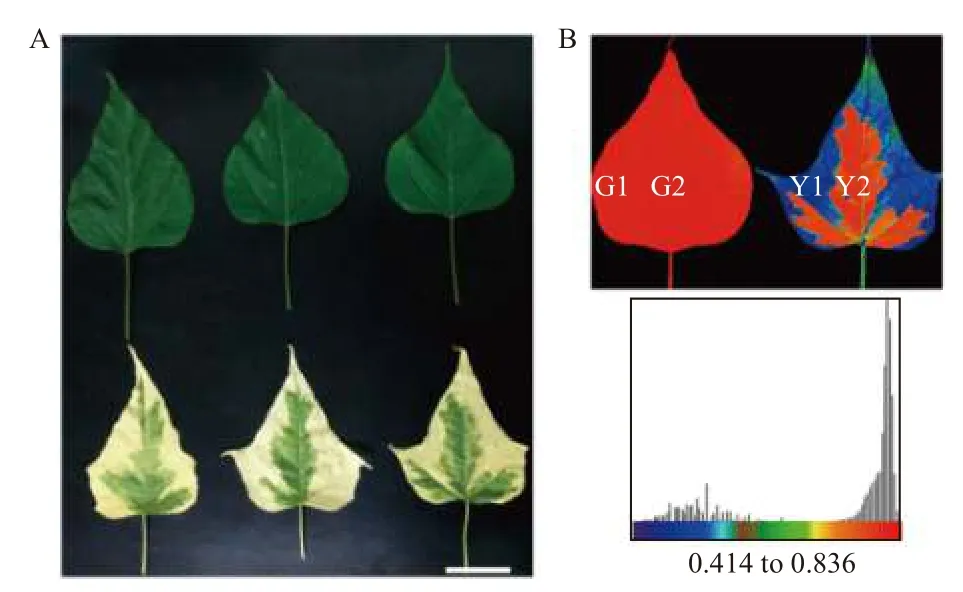
圖1 灰楸及‘麥緣錦楸’葉片取樣圖[15]Fig.1 Samples of leaves of 'Maiyuanjinqiu' and C.fargesii.[15]
1.2 方法
1.2.1 RNA 提取與cDNA 合成 RNA 提取按照EASY spin 植物RNA 快速提取試劑盒(北京艾德萊生物科技有限公司)的操作說明進行。通過1%瓊脂糖凝膠電泳檢測RNA 樣品的完整性,并利用超微量紫外分光光度計探頭(Nanodrop 2000)檢測所提取RNA 的濃度與純度。利用PrimeScript?RT reagent Kit with gDNA Eraser 試劑盒(Takara,RR047A),將RNA 樣品反轉錄為cDNA,獲得的cDNA 樣品置于-20℃保存備用。
1.2.2 候選內參基因的篩選 以課題組前期未發表的‘麥緣錦楸’和灰楸轉錄組數據為依據,選取FPKM 值大于100 且在樣品間無顯著差異表達的6 個基因(CfUBC、CfActin、CfPP2A、CfMADH、CfGADPH、CfEF-1)為候選基因,加上課題組前期常用的CbuActin[17]共7 個內參基因。
1.2.3 引物設計及特異性檢測 根據引物設計原則,利用在線工具Primer 3 Plus 設計內參基因及CfGES基因引物,引物大小為18~27 bp,Tm 值在58~61℃,擴增長度為150~250 bp,GC 含量為40%~60%,并在NCBI 上對引物進行特異性檢測。引物由北京擎科生物科技有限公司合成,引物序列見表1。以各候選基因引物做普通PCR 擴增,并用1%瓊脂糖凝膠電泳檢測。
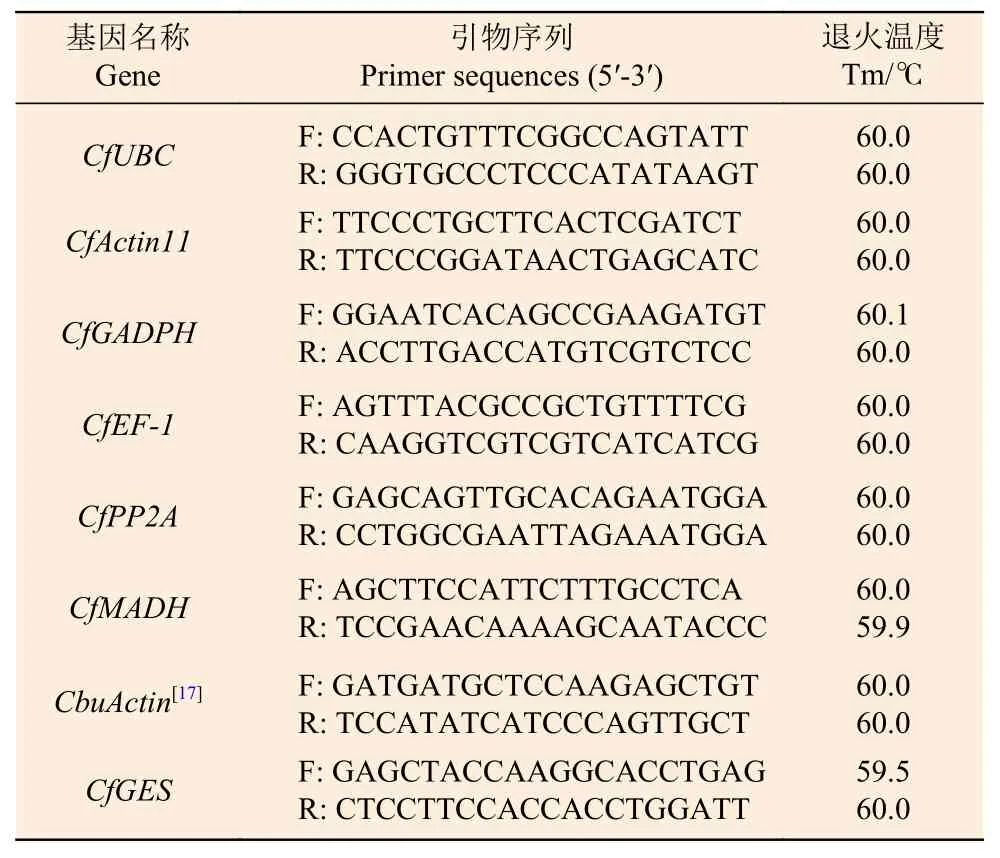
表1 內參基因及CfGES 基因的引物設計Table 1 Primer design for internal reference genes and CfGES gene
1.2.4 實時熒光定量PCR 將cDNA 模板混合稀釋8 倍后,按照Takara 公司的TB Green Premix Ex Taq (Tli RNaseH Plus) 試劑盒(Takara,RR420A)說明書進行實時熒光定量PCR 實驗。反應體系為20 μL:TB Green Premix Ex Taq 10 μL,上游引物(10 μmol·L-1)0.8 μL,下游引物(10 μmol·L-1)0.8 μL,DNA 模板1 μL,dd H2O 7.4 μL。每個樣品設置3 個重復,所有操作均在冰上進行。利用LightCycler480 實時熒光定量PCR 儀對各樣品進行擴增,PCR 擴增程序為:95℃預變性30 s;定量分析40 個循環:95℃ 變性5 s,60℃退火30 s;融解曲線:95℃ 5 s,60℃ 1 min 后緩慢上升至95℃;降溫:50℃ 30 s。
1.2.5 數據處理和分析 將各樣品得到的Ct值按公式Q=E(minCt-sampleCt)(E為擴增效率,默認值為2;minCt為基因在樣品中的最小Ct值;sampleCt為基因在樣品中的Ct值)進行計算,將得到的Q值導入GeNorm 和NormFinder 軟件中進行穩定性分析。將各樣品得到的Ct值輸入到BestKeeper軟件中,得到候選內參基因的表達穩定性(M值)、穩定值(SV 值)、變異系數(CV 值)和標準差(SD 值),進行表達穩定性分析。使用3 款軟件分析后,將各樣品得到的Ct值輸入到在線網站RefFinder(https://www.heartcure.com.au/forresearchers/)中進行綜合分析,得出最適合‘麥緣錦楸’不同葉色部位穩定表達的內參基因。
1.2.6 內參基因穩定性驗證 分別以綜合分析排名最靠前的2 個基因為內參,對萜類合成基因CfGES的表達情況進行分析,qRT-PCR 方法參照1.2.4,結合CfGES基因的轉錄組數據,對2 個內參基因進行表達穩定性驗證。
2 結果與分析
2.1 RNA 提取與質量檢測
Nanodrop 檢測到所有樣品總RNA 的OD260/280及OD260/230值均在1.8~2.2 之間,說明所提RNA純度較好,1% 瓊脂糖凝膠電泳檢測RNA 樣品完整性(圖2),各樣品的28S 和18S 條帶明顯,說明總RNA 完整性較好,均可用于后續試驗。
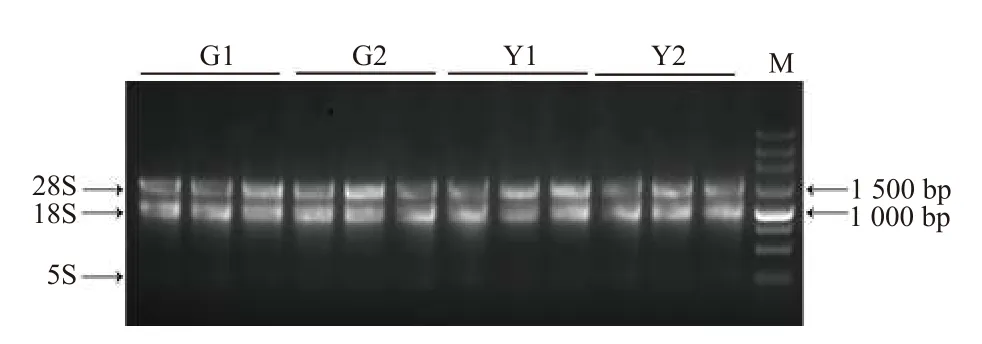
圖2 ‘麥緣錦楸’和灰楸不同葉色部位總RNA 電泳圖Fig.2 Total RNA electrophoresis of different leaf color parts of 'Maiyuanjinqiu' and C.fargesii.
2.2 內參基因引物的特異性篩選
圖3 顯示:所有引物均能擴增出單一且亮的條帶,無引物二聚體,條帶大小與預期相符,引物特異性完好,可用于后續檢測分析。對7 個候選內參基因在各個樣品的qRT-PCR 分析表明:各基因Ct值均在23~35,且溶解曲線都呈現顯著單一的峰(圖4),表明qRT-PCR 所用引物可與模板cDNA特異性結合并擴增靶基因。
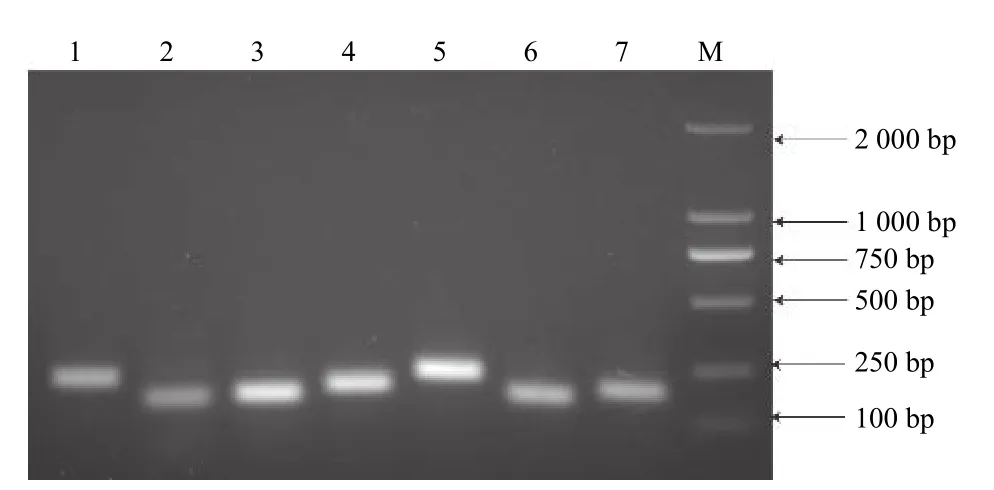
圖3 7 種內參基因的PCR 擴增產物Fig.3 PCR products of seven reference genes.
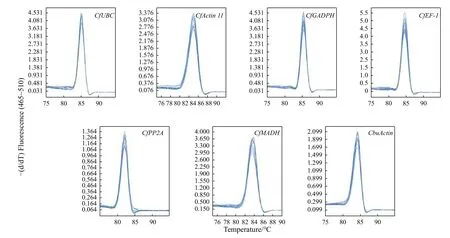
圖4 7 個內參基因溶解曲線Fig.4 Real-time PCR melting curves of seven reference genes
2.3 內參基因穩定性分析
2.3.1 候選內參基因的表達豐度分析 7 個候選內參基因中,CfActin的平均Ct值最大,為26.459,說明該基因的表達豐度最低;CfGADPH的平均Ct值最小,為20.91,說明該基因的表達豐度最高。7 個內參基因的表達豐度大小排序依次是:CfGADPH > CbuActin > CfEF-1 > CfMADH> CfPP2A >CfUBC > CfActin(圖5)。
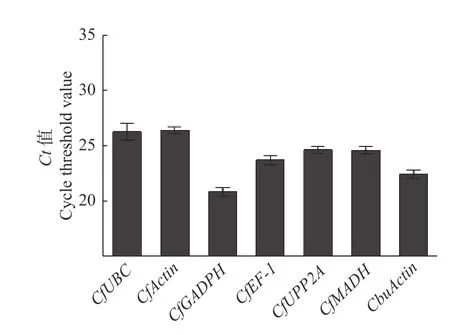
圖5 7 個內參基因平均Ct 值Fig.5 Average Ct values of seven reference genes
2.3.2 GeNorm 分析 GeNorm 是通過比較計算內參基因穩定性的M 值,以確定表達最穩定的內參基因。該軟件以M=1.5 作為臨界點,低于該值表明基因的表達相對穩定,且M 值越小表示內參基因的表達越穩定[18]。GeNorm 分析結果表明:7 個候選內參基因的M 值均小于1.5(表2),即各候選內參的表達都相對穩定,穩定性排名從高到低依次是:CfMADH>CfEF-1>CfGADPH>CfPP2A>CfActin11>CfUBC >CbuActin。為確定內參基因的最佳數量,進一步通過配對變異系數Vn/ (n+1),得出以4 個候選基因同時做為內參基因的效果最佳,2 個組合使用次之(圖6)。
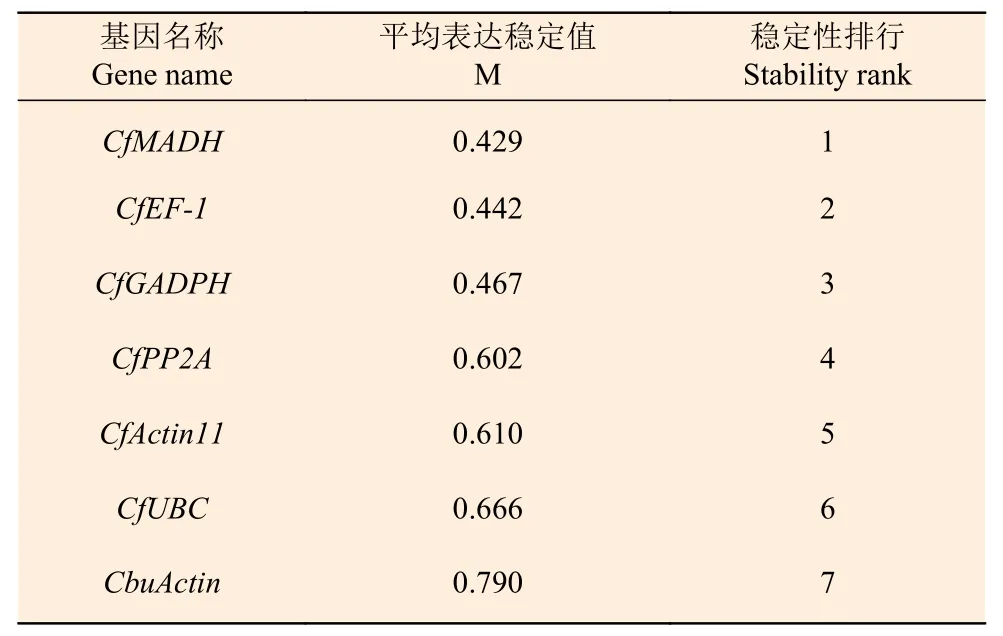
表2 GeNorm 軟件分析下內參基因的表達穩定性Table 2 Analysis of the expression stability of reference genes in leaves by GeNorm
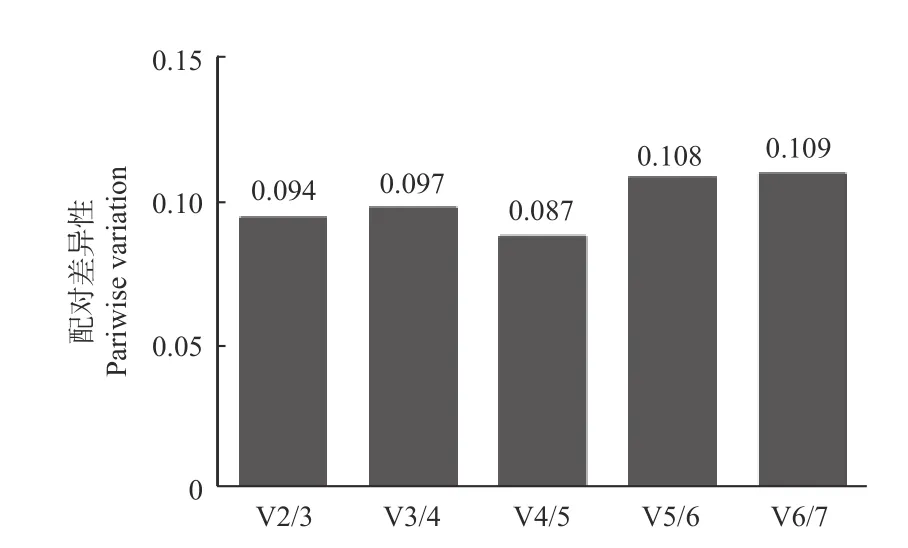
圖6 GeNorm 軟件分析最適合內參基因數目Fig.6 The number of the most suitable reference genes analyzed by GeNorm software
2.3.3 NormFinder 分析 NormFinder 的計算原理與GeNorm 相似,該軟件是基于Excel 結合組間方差與組內方差計算SV 值,來確定內參基因的穩定性。SV 值的大小與基因的穩定性呈負相關。Norm-Finder 分析結果(表3)顯示:CfUBC、CbuActin、CfActin11、CfPP2A、CfGADPH、CfEF-1、CfMADH基因在葉片不同顏色部位的表達穩定值分別為0.406、0.520、0.329、0.340、0.068、0.095、0.062,其中,CfMADH、CfEF-1和CfGADPH的SV 值最小,說明這3 個基因的穩定性較強。
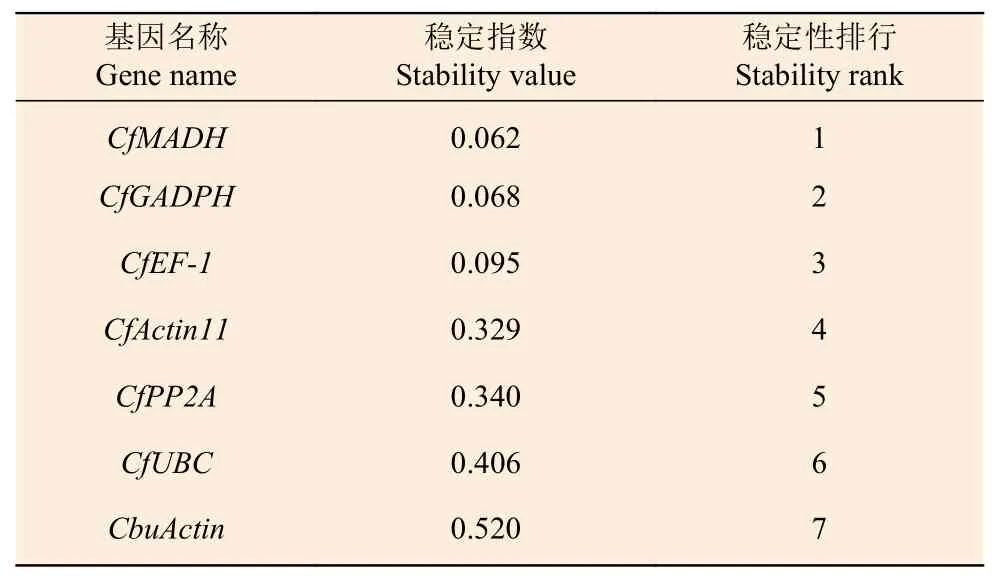
表3 NormFinder 軟件分析‘麥緣錦楸’及灰楸不同葉色部位內參基因的表達穩定性Table 3 Analysis of the expression stability of reference genes by NormFinder software
2.3.4 BestKeeper 分析 BestKeeper 通過計算變異系數(CV)和標準偏差(SD)來反映內參基因的穩定性,CV 和SD 的值與基因的穩定性負相關,其中,SD 值的默認閾值為1.0,低于該值即認為表達穩定[19]。BestKeeper 分析結果(表4)顯示:在灰楸及‘麥緣錦楸’葉片中,7 個基因的SD 值均小于1.0,說明各基因的表達均較為穩定,并且穩定性從高到低排序依次是:CfActin11、CfMADH、CfGADPH、CfEF-1、CbuActin、CfPP2A、CfUBC,其中CfActin11的CV 和SD 值最小(CV=0.80;SD=0.21),表達最為穩定;CfUBC的CV 和SD 值最大(CV=2.35;SD=0.62),其表達最不穩定。
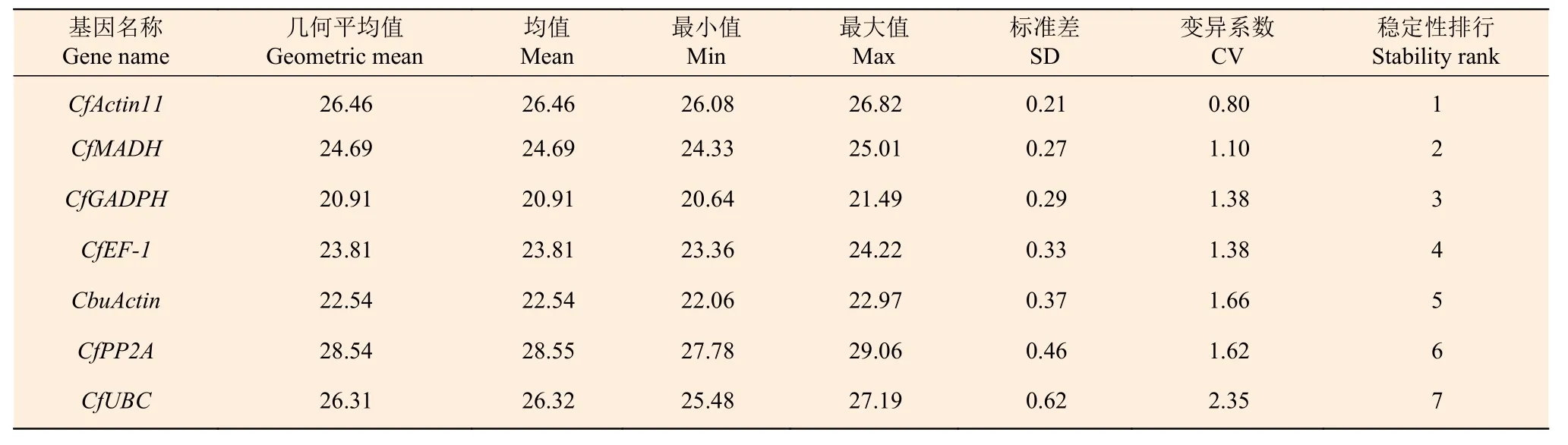
表4 BestKeeper 軟件分析灰楸及‘麥緣錦楸’不同葉色部位內參基因的表達穩定性Table 4 BestKeeper software was used to analyze the expression stability of internal reference genes in different leaf color sectors of Maiyuanjinqiu and C.fargesii.
2.3.5 綜合性分析 對GeNorm、NormFinder 以及BestKeeper 3 種軟件的數據進行整合分析,綜合評估基因的表達穩定性。將各基因在不同樣品中的Ct值導入在線網站RefFinder(https://www.heartcure.com.au/for-researchers/)中。結果顯示,各基因穩定性綜合排名由高到低依次為CfMADH>CfEF-1>CfGADPH>CfActin11>CfPP2A>CfUBC>CbuActin(圖7),其中,CfMADH和CfEF-1的表達穩定性最好,符合qRT-PCR 實驗內參基因的選擇標準。
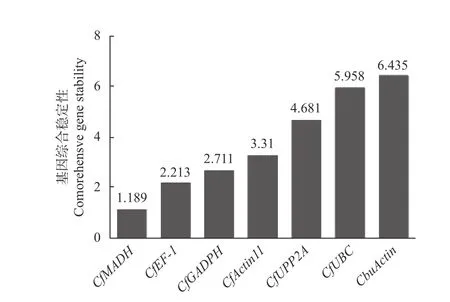
圖7 RefFinder 分析7 個候選內參基因的穩定性綜合排名Fig.7 Stability ranking of seven genes by RefFinder analysis
2.4 內參基因穩定性驗證
分別以CfMADH和CfEF-1為內參,分析萜類合成酶基因CfGES在‘麥緣錦楸’和灰楸不同葉色部位(Y1、Y2、G1、G2)的表達量差異,以驗證軟件預測結果的可靠性。結果表明:單獨或組合使用CfMADH及CfEF-1基因為內參時,CfGES基因的表達差異與轉錄組測序結果趨勢一致(圖8)。因此,本研究結果表明:單獨使用CfMADH、CfEF-1基因或組合使用這2 個基因,能夠準確校準‘麥緣錦楸’不同葉色部位的熒光定量結果。
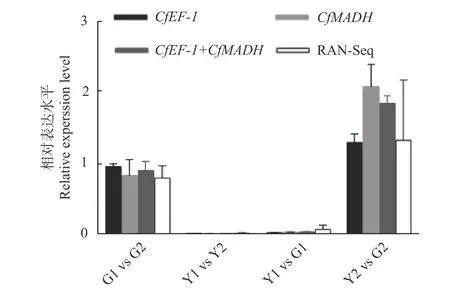
圖8 CfGES 在‘麥緣錦楸’和灰楸不同葉色部位的基因表達量差異Fig.8 The expression differences of CfGES among different leaf color sectors of 'Maiyuanjinqiu'and C.fargesii .
3 討論
基因表達分析是分子生物學科中最為重要的研究內容之一,qRT-PCR 是當前最常用的檢測基因表達情況的技術手段,常用來檢測基因在不同樣品、組織、生長發育時期及特定實驗條件下的表達模式[20]。對基因進行表達情況分析時,必須選擇準確的內參基因做標準化分析[21-22]。眾多研究中發現,管家基因可作為內參基因來進行表達量分析。然而近年來有研究發現,內參基因并不具有通用性,需要根據特定的物種或實驗條件來確定最適宜的內參基因[23-24]。如GADPH在黃山欒樹、銀杏、肉桂和大葉清化桂中穩定表達[25-27],但在絲瓜和苧麻中卻被認為是最不理想的內參基因[28-29]。18SrRNA基因在紅豆杉多種處理下都表現出較好的穩定性[30],但在稻瘟病菌侵染的水稻、靈芝及紅木不同處理下該基因的表達最不穩定[31-32]。目前尚未發現能在各類實驗條件下都穩定表達的內參基因,所以研究者需要根據自己的實驗條件找到可以作為標準化的基因進行定量分析。
GeNorm、NormFinder 和BestKeeper 是基因組研究中篩選穩定內參基因最常見的計算軟件,本研究應用3 款軟件及1 個分析網站對7 個候選內參基因的穩定性分析發現,這7 個內參基因在‘麥緣錦楸’和灰楸葉片中均穩定表達,但穩定性排名略有差異:在GeNorm 和NormFinder 中均得出CfMADH和CfEF-I是最穩定的內參基因,而在BestKeeper中CfMADH和CfEF-I的排名卻分別居于第2 和第4名,排名的差異可能是由于3 款軟件所設定的統計學算法不同所導致的。GeNorm 和NormFinder 的原理基本相似,都是將qRT-PCR 所得到的Ct值轉化為基因相對表達量,再進行最適內參的分析,每個候選基因的穩定性取決于單個樣品的最小Ct值;而BestKeeper 則直接在內置公式中輸入各基因表達的Ct值來進行分析,候選基因的穩定性與每個樣品Ct值的離散程度相關,因此,該算法易受極端值影響,無法規避系統誤差[33-34]。考慮到每款軟件的局限性,筆者利用RefFinder 對這3 款軟件得出的結果進行綜合分析,確定了7 個候選內參基因在‘麥緣錦楸’葉片中的穩定性排名依次是:CfMADH>CfEF-1>CfGADPH>CfActin11>CfPP2A>CfUBC>CbuActin。在GeNorm 分析的內參基因變異系數配對值來看,n=4 時,Vn/ (n+1)的比值最小,是最佳的內參基因組合數量,n=2 次之,但綜合考慮實驗成本及樣品用量問題本文認為組合使用2 個候選基因作為內參更為合適,此前也有研究認為以2 個或2 個以上基因為內參更能校準定量分析實驗上的系統偏差[35]。
萜類物質(葉綠素、胡蘿卜素)在葉色形成過程中有重要的作用。在本課題組轉錄組數據中發現,萜類合成酶基因CfGES在‘麥緣錦楸’和灰楸不同葉色部位中差異表達,可以驗證候選內參基因的穩定性。CbuActin是課題組前期利用同源克隆法獲得的內參基因[17],在‘麥緣錦楸’和灰楸葉片中其M<1.5(M=0.790),符合作為內參基因的標準,但本研究通過軟件分析排名最好的內參基因是CfMADH和CfEF-1。筆者分別以這2 個最適合的內參基因及其組合來校準CfGES的表達量,結果表明單獨或組合使用CfMADH和CfEF-1時,CfGES的表達差異與轉錄組數據一致,進一步表明了本實驗結果的可靠性。本研究所篩選到的最適內參基因CfMADH和CfEF-1均為真核生物中常見的管家基因,在其他觀賞性樹種(紫薇、花葉唐竹等)的不同葉色葉片中也被報道可作為理想內參基因[36-38]。此外,本研究材料中CfUBC和CfActin11在‘麥緣錦楸’葉片中穩定性不佳,但在其他物種(如景寧木蘭、板栗)中卻表現出很好的穩定性[39-40],這些結論也體現了內參基因不具有通用性的特點。
4 結論
本研究根據課題組前期研究及轉錄組數據篩選出7 個候選基因(CfUBC、CfActin11、CfPP2A、CfMADH、CfGADPH、CfEF-1及CbuActin),結合qRT-PCR 技術及GeNorm、NormFinder和BestKeeper等內參分析軟件對各候選基因進行穩定性分析,結果表明CfMADH和CfEF-1是最適合‘麥緣錦楸’和灰楸不同葉色部位的內參基因,萜類合成基因CfGES驗證了軟件分析結果的可靠性。本研究優化了紫葳科植物‘麥緣錦楸’內參基因的選擇,將為‘麥緣錦楸’葉色形成的分子生物學機制提供理論基礎,也將為課題組及其它植物研究選擇合適內參基因提供參考依據。

