一株南方紅壤區杉木根際高效解鉀菌的篩選、鑒定及其培養條件優化
趙 君,饒惠玲,馮清玉,黃 偉,吳承禎,李 鍵*
(1.福建農林大學林學院,福建 福州 350002;2.武夷學院生態與資源工程學院,福建 南平 354300;3.福建省高校森林生態系統過程與經營重點實驗室 福建 福州 350002)
氮、磷、鉀三大營養元素在植物的生長發育過程中起著不可或缺的作用,而鉀元素在提高關鍵光合酶活性、提高葉綠素含量、維持細胞電荷平衡[1]等方面的作用尤為突出。我國南方紅壤區92%~98%的鉀元素以礦物質的形式存在[2],不易被植物吸收利用,進而影響植物的生長、產量、品質等。目前,優化提升土壤鉀素含量多以施用鉀肥為主,但我國鉀肥儲量并不富余,需以進口手段滿足需求[3],且隨著鉀肥頻繁使用,土壤污染加重。因此,如何高效轉化土壤中的緩效鉀元素,從而低成本高效的促進植物的吸收利用和生長發育,是近來土壤和植物營養學界關注的熱點之一。
土壤微生物組通過自身代謝參與植物養分元素循環[4]、通過競爭或合作關系等促進根際微環境穩定[5],對植物的生長和健康有明顯增益作用。解鉀菌作為土壤微生物的重要組成部分,對含鉀硅酸鹽礦物具有分解作用,是將土壤中的緩效鉀轉化為速效鉀的有效綠色微生物肥料[6]。在探索利用解鉀菌改善農作物低鉀脅迫方面,前人已有諸多嘗試[7-9],但微生物肥料種類繁多并具專一性,不同作物根際篩選出的解鉀菌能力各不相同,只有以土壤環境、植物種類等為選擇依據,施用最適解鉀菌才能產生最大效益[10]。
我國南方紅壤區主要造林樹種杉木(Cunninghamia lanceolata(Lamb.) Hook.)具有經濟、速生、豐產的特點,在提供生產用材、建筑用材、水土保持等方面具有較高的經濟、生態價值。杉木多采用實生苗進行造林[11],在育苗和造林初期往往存在立地困難,諸如幼苗需水量大、固碳能力不完善等[12],而鉀素在調節其細胞吸水[13]、加速植物木質化速率[14]、促進根系生長發育[15]等方面發揮著不可或缺的作用,能夠顯著提升杉木幼苗抗性和存活率。近年來,微生物組技術在解決農田養分匱乏、提高植物抗性、緩解農業廢棄物污染等方面已有了大量探索和初步成效[16],這為利用林木生物工程菌種解決鉀素匱乏問題提供了全新的思路,因此,本研究以南方紅壤區杉木人工林下根際土壤為研究對象,分離篩選高效解鉀菌并分析其解鉀能力,經16S rDNA 鑒定確定其屬,通過單因素實驗與正交試驗來優化高效解鉀菌的生長條件,以期獲得高效解鉀菌的最佳培養量,為解鉀工程菌的開發奠定研究基礎,亦為改善南方紅壤區杉木人工林下根際土壤營養元素環境提供新的路徑。
1 材料與方法
1.1 實驗材料
本實驗土壤樣品采集于福建省南平市建陽區小湖鎮溪東國有林場,26°40′~27°20′ N,118°08′~120°31′ E,位于武夷山脈南側。為中亞熱帶季風氣候,季風氣候顯著,春暖秋涼,夏季高溫多雨,冬季溫和少雨。實驗地土壤為花崗巖發育的暗紅壤,土層厚度在90 cm 以上,海拔高度350 m 左右,坡度范圍20°~35°。相關研究表明,杉木人工林幼齡到中齡的全鉀含量增加[17],即幼齡階段杉木低鉀脅迫更為嚴峻,因此本研究選取南方紅壤區不同林齡(2,4,10,15 a)杉木人工林下根際土壤作為實驗樣品,以便更為全面的篩選高效解鉀菌株。
1.1.1 土壤樣品采集及理化性質測定 采用五點取樣法選取取樣點,采用分層取樣法[18]以及抖落法[19]采集根際土壤,采用四分法去除多余土樣,新鮮根際土樣置于冰箱(4℃)保存以備菌株的篩選,非根際土樣待風干后測定土壤理化性質。其中,分別采用鉬銻抗比色法、鹽酸-硫酸浸提法測定全磷、有效磷,采用重鉻酸鉀-外加熱法測定有機質,分別采用半微量凱氏法、堿解-擴散法測定全氮、水解氮,分別采用堿熔-火焰光度法、乙酸銨浸提-火焰光度法測定全鉀、速效鉀,采用電位法測定pH[20]。
1.1.2 培養基 解鉀菌的初篩采用亞歷山大硅酸鹽初篩培養基[21]:蔗糖5.0 g,硫酸鎂0.5 g,磷酸氫二鈉2.0 g,碳酸鈣0.1 g,三氯化鐵0.005 g,鉀長石粉1.0 g,瓊脂18.0 g,去離子水1 000 mL,pH 7.0~7.5。
培養初篩得到的解鉀菌采用種子液培養基[22]:蔗糖10.0 g,硫酸鎂0.5 g,碳酸鈣1.0 g,硫酸銨1.0 g,氯化鈉0.l g,酵母膏0.5 g,磷酸氫二鉀2.0 g,pH 7.2~7.4,去離子水1 000 mL。
解鉀菌的復篩采用搖瓶復篩培養基[23]:蔗糖10.0 g,硫酸鎂0.5 g,碳酸鈣1.0 g,硫酸銨1.0 g,氯化鈉 0.l g,酵母膏0.5 g,磷酸氫二鈉2.0 g,鉀長石粉10.0 g,pH 7.2~7.4,去離子水1 000 mL。
發酵基礎培養基采用LB 培養基[24]:胰蛋白胨10.0 g,酵母浸出粉5.0 g,葡萄糖0.5 g,氯化鈉 0.5 g,pH 7.0~7.2。
1.2 解鉀菌的篩選、鑒定及培養條件優化
1.2.1 解鉀菌分離與純化 菌株分離:配置一定濃度(10-3、10-4、10-5)的土壤懸液,將其涂于亞歷山大硅酸鹽培養基平板中央,將涂布后的平板倒置并轉移至恒溫培養箱(30℃,4 d)培養。每個梯度設3 個重復并編號,培養過程中觀察菌落形態,以菌落形態呈圓形、透明、凸起較高、表面濕潤粘稠且富有彈性為篩選指標挑取菌落。
菌株純化:采用劃線法純化分離篩選后的解鉀菌并于30℃培養箱培養3~7 d,反復純化2~3 次,于電子顯微鏡下觀察菌落形態。將純化后的解鉀菌轉移至LB 培養基,保存于冰箱(4℃)備用[25]。
1.2.2 解鉀菌篩選 將上述挑選好的解鉀菌進行搖瓶液體培養釋鉀實驗以測定其解鉀能力。各取10 mL 解鉀菌培養液經離心處理(4℃,6 000 r·min-1,10 min)后取上清液,加入5 mL 濃硫酸與2 mL 30%過氧化氫溶液消煮,并反復加30%過氧化氫溶液數次至粘性物質完全消化后,定容至50 mL后用火焰原子吸收分光光度法測定菌株培養液中可溶性鉀的含量[26]。
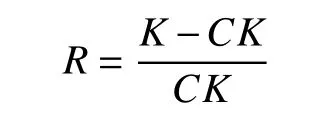
R為解鉀率(%),K為接種發酵液中的鉀含量(μg·mL-1),CK為未接種解鉀菌培養液的鉀含量(μg·mL-1)。
1.2.3 菌株16S rDNA 鑒定 利用天根細菌基因組提取試劑盒(DP302-02)提取菌株的總DNA 并進行PCR 擴增,將產物經2% 瓊脂糖凝膠電泳,割取目的條帶,按照天根回收試劑盒(DP214-03)純化回收,送往上海邁浦生物科技有限公司進行測序。將測序結果提交至RDP 及NCBI 數據庫中進行序列比對分析,選取與Genbank 中同源性最高的序列,確定菌株類型。
1.2.4 培養條件優化 培養基組分優化:將基礎培養基中的碳源分別用葡萄糖、蔗糖、乳糖、可溶性淀粉、麥芽糖、甘露醇代替,依據菌液OD600確定最佳碳源。選用最佳碳源設置濃度梯度(0.5%、1.0%、1.5%)并根據菌液OD600值確定最適濃度。利用硫酸銨、氯化銨、硝酸鉀、蛋白胨、酵母粉、尿素替換基礎培養基中的氮源以確定最佳氮源,改變最佳氮源濃度(0.5%、0.8%、1.0%、1.3%、1.5%)確定其最適濃度。
培養條件優化:基礎培養基組分保持不變,分別對菌株發酵液培養條件進行梯度設置(pH 為5.0、6.0、6.5、7.0、7.2、7.5、8.0、9.0;裝液量為10、20、30、40、60 mL;接種量為1%、3%、5%、7%、9%;培養溫度為20℃、25℃、28℃、30℃、35℃、40℃),記錄各組處理菌液OD600值,確定最適培養條件。
正交試驗:根據單因素實驗結果,設計L9(34)四因素(A:初始pH;B:裝液量;C:接種量;D:培養溫度)三水平正交試驗,每組處理設置3 個重復。
1.3 數據處理與方法
采用Exce1 2010 進行原始數據的整理與分析,運用SPSS 19.0 進行單因素方差分析(One-Way ANOVA)比較不同菌株解鉀量的差異進行方差分析,正交試驗數據處理采用正交設計助手ⅡV3.1。采用Pearson 相關系數法確定pH 與溶磷量之間相關關系,采用最小顯著差異法(LSD 法)進行顯著性檢驗和多重比較,顯著性水平0.05。
2 結果與分析
根據1.1.1,得出研究區土壤基本理化性質(表1)。

表1 杉木人工林土壤基本理化性質Table 1 Basic physiochemical properties of Chinese fir plantation soil
2.1 解鉀菌的分離與形態學特征
從不同林齡杉木人工林下根際土壤中共分離出79 株解鉀菌,根據分離純化過程中菌株的形狀、顏色、大小、生長速度快慢等特征[11],挑選出20 株優勢菌株(編號JK1-JK20)用于搖瓶液體培養,測定其解可溶性鉀含量并計算解鉀率以篩選高效解鉀菌。本次實驗篩選出的解鉀菌都為細菌,絕大多數菌株的菌落形態呈現圓形、透明、凸起、邊緣整齊、表面濕潤粘稠且富有彈性,亦存在顏色為淡紅色、乳白色半透明的情況;菌體形態多為長桿狀,兩端鈍圓,常成對狀、鏈狀排列;絕大多數菌株具備芽孢,芽孢呈橢圓或卵圓狀,并有肥厚莢膜存在。
2.2 解鉀菌的解鉀能力測定與篩選
測定不同菌株發酵液的可溶性鉀含量(圖1),不同菌株解鉀量存在差異。各菌株發酵液的可溶性鉀含量范圍為38.29~81.06 μg·mL-1。整體來看,20 株菌株中共有13 株解鉀量顯著高于CK,占比65%,可溶性鉀含量較CK 增加量的范圍為1.66~30.55 μg·mL-1,分解鉀長石礦能力明顯。JK13 解鉀量 為81.06 μg·mL-1,為CK 的1.6 倍,顯著高于其他菌株(P< 0.05),其次為JK2、JK16。以上13 株菌株中,解鉀率高于20%的菌株共計7 株,占比53.85%,解鉀率低于10%的菌株共計3 株,占比23.08%(圖2)。

圖1 不同解鉀菌解鉀量Fig.1 The amount of potassium in different solutions
不同菌株解鉀率(圖2)存在顯著差異(P<0.05),大部分菌株解鉀率為正。綜合解鉀率與解鉀量二者來看,JK13 解鉀率最高,為60.49%,其次JK2 和JK16 的解鉀率為46.37%、39.33%。此外,菌株JK1、JK3、JK6、JK8、JK10、JK18、JK19 這7 株菌的培養液可溶性鉀含量低于CK,說明這7 株菌株不具備解鉀能力,原因可能是這些菌株本身在成長繁殖過程中需要吸收一定量的鉀素[27]。另外,前期處理過程中的H2O2灰化處理并不能使菌株體內的鉀完全釋放,也可能在轉移過程中有部分速效鉀被破壞導致流失。

圖2 不同解鉀菌解鉀率Fig.2 The potassium solvability of different potassium-solubilizing bacteria
對上述20 株菌株發酵液進行pH 測定,發現各菌株pH 值顯著低于CK(P< 0.05),解鉀菌在代謝過程中會產生酸性物質,進而提高對鉀長石礦中不可溶鉀向可溶性鉀轉化的效率,提高溶液鉀離子含量[28]。其中,JK15 的pH 值最低,為4.12,其解鉀率為22.93%,具有較好的解鉀能力,其次JK20 的pH 值為4.20,但其解鉀率為12.54%。對13 株有效解鉀菌的解鉀量與發酵液pH 值進行相關性分析(圖3),得出二者之間不存在相關關系(R2=0.852,P> 0.05)。由此可見,雖然解鉀菌株在解鉀過程中都能分泌酸性物質,但是菌株解鉀能力的強弱與發酵液pH 值大小并無直接相關關系。

圖3 溶解量與培養液pH 的關系Fig.3 Relationship between pH and potassium-solubilizing ability
2.3 菌株鑒定結果
經鑒定,菌株JK13 屬芽孢桿菌屬(Bacillus altitudinis),且進行比對的序列片段與高地芽孢桿菌(Bacillus altitudinis)、枯草芽孢桿菌(Bacillus subtilis)相似性達到100%,與嗜氣芽孢桿菌(Bacillus aerophilus)、同溫層芽孢桿菌(Bacillus stratosphericus)、地衣芽孢桿菌(Bacillus licheniformis)及空氣芽孢桿菌(Bacillus aerius)4 個種的相似性達到99%(圖4)。

圖4 菌株JK13 系統發育樹Fig.4 Phylogenetic tree of strain JK13
2.4 解鉀菌培養條件優化
2.4.1 單因素篩選 不同培養條件下菌株JK13 生長量差異顯著(P< 0.05)(圖5)。碳源是微生物生長發育、新陳代謝的主要能量來源[29-30],JK13 對葡萄糖、蔗糖、麥芽糖、乳糖、甘露醇均能吸收利用,但以0.5% 濃度的甘露醇為碳源時OD600值顯著高于其他碳源,菌株生長量最大(圖5a、b),生長情況最好;經單因素方差分析和LSD 多重比較表明,0.5% 濃度的甘露醇與1.5%濃度之間存在顯著差異。氮源在微生物生長過程中也發揮著重要的作用[31],經單因素方差分析和LSD 多重比較表明,以酵母粉為氮源時JK13 菌液濃度顯著高于其余5 種氮源(P< 0.05)。對菌株JK13 而言,氯化銨、硝酸鉀、尿素3 個處理之間無顯著差異(P> 0.05);而氯化銨處理同硫酸銨、硝酸鉀、尿素3 個處理間呈顯著差異,后三者之間則無顯著差異(圖5c)。菌株JK13 對1.0%濃度的酵母粉吸收利用效率更高,生長情況最好,而0.75%、1.0%、1.25%這3 種濃度處理之間差異不顯著(圖5d)。
初始pH 對菌株生長量影響差異性顯著(P<0.05)(圖5e),菌株JK13 的最適pH 值為9.0,菌液OD600值隨pH 的增加呈上升趨勢;經單因素方差分析和LSD 多重比較,pH 為9.0 的處理同其余處理呈顯著差異。不同菌株對氧氣的需求量存在差異,搖瓶環境中氧氣含量的多少是影響菌株生長速率的重要因素之一[32]。菌株JK13 生長量在30~40 mL 間無顯著差異;30 mL 裝液量與10 mL、60 mL 處理間的差異達到顯著水平(P< 0.05)(圖5f)。經單因素方差分析和LSD 多重比較表明,JK13 的不同接種處理間差異并不顯著(圖5g)。JK13 的最適溫度范圍為28~35 ℃,但在35 ℃處理下的菌液OD600值顯著高于其他溫度處理(P< 0.05)(圖5h)。
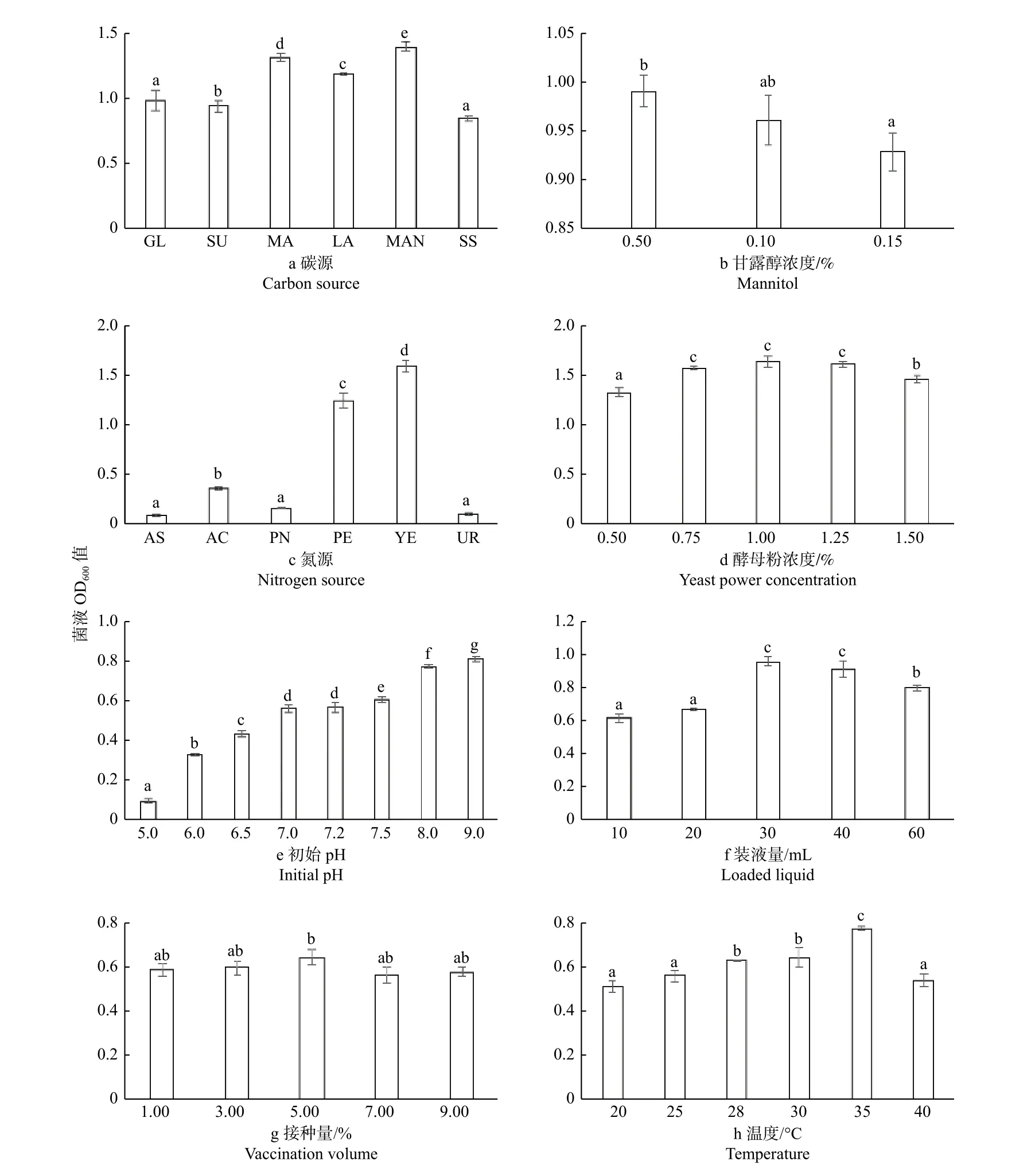
圖5 不同培養條件對菌株生長量的影響Fig.5 The influence of different culture conditions on the growth of strains
2.4.2 正交試驗 基于上述單因素實驗,設計4 因素(初始pH、裝液量、接種量、培養溫度)3 水平正交試驗(表2)。其中因素A 為初始pH 值(7.5、8.0、9.0),因素B 為裝液量(20 mL、30 mL、40 mL),因素C 為接種量(1%、3%、5%),因素D 為培養溫度(25℃、30℃、35℃)。極差分析結果為RA>RD>RB>RC,表明對菌株JK13 的菌體生長程度影響最大的因素為初始pH 值,其次為培養溫度、裝液量、接種量。菌株JK13 的最佳培養條件優化方案為A3B2C1D3,即初始pH 值為9.0,裝液量為30 mL·100 mL-1,接種量為1%,培養溫度為35℃。菌株JK13 在最佳優化方案下的菌液OD600值為1.059,其在未優化的普通培養條件下為0.672,增長幅度為57.56%。

表2 菌株JK13 培養條件的正交試驗結果Table 2 The results of orthogonal test on culture condition for strain JK13
3 討論
現有研究表明,植物自身一般通過產生大量的ABA、水分再分配[33]、動態改變根系內部基因[34]等應對不同的逆境脅迫,植物共生微生物則基于以上自我修復起到輔助和協同作用[35],而微生物肥料的開發利用可以大大加速植物的逆境修復速度,為植物保持正常生理化學過程提供動力,發揮外在推動器的作用。
一般認為,生物的豐富的遺傳多樣性會為種間及種內個體間帶來遺傳分化與遺傳差異,進而表現為生物培養特征的多樣性。本實驗從南方紅壤區不同林齡杉木人工林下根際土壤篩選出的解鉀菌菌落顏色具有多樣性,呈現乳白色半透明、淡黃色,這與吳凡等[36]在桑樹根際篩選出具有乳白色、淡黃色等顏色特征的解鉀菌以及燕紅等[37]在農田中篩選出呈乳白色的K-6-4 和呈淡黃色的K-1-1 的實驗結果一致。但僅將菌落顏色作為解鉀菌篩選的判斷標準并不嚴謹,據此并不能十分準確分離得到具備解鉀能力的菌株,如狄義寧[38]在甘蔗根部篩選出菌落顏色為黃白色的解鉀菌,姜霽航等[39]在蘋果根際篩選出的解鉀菌呈灰色、不透明。換而言之,種類各異的高效解鉀菌菌落顏色也各不相同,因此,利用菌落顏色特征篩選解鉀菌還需借助測定速效鉀含量來做進一步判斷。
土壤空間異質性為微生物多樣性提供了生境基礎,二者存在顯著正相關關系[40]。在不同類型土壤中生存的解鉀菌無論是在數量還在種類上均存在差異[41],不同菌株的溶鉀效果也存在差異。本實驗在20 株解鉀菌中篩選出13 株具解鉀能力的菌株,最高效解鉀菌JK13 發酵液可溶性鉀含量為81.06 μg·mL-1。呂睿等[8]在獼猴桃園農田中篩選出高效解鉀菌株JK3 的解鉀量3.7 μg·mL-1,較空白對照組增加94.74%,解鉀量顯著低于本實驗篩選出的JK13。閆雅楠等[9]在入侵植物加拿大一枝黃花(Solidago canadensisL.) 根際分離出的15 株菌株中,9 株具有解鉀能力,最優解鉀菌株H2-20 的解鉀量為10.657 μg·mL-1,顯著低于JK13。陳易等[10]在紫色土樣中篩選出的XD-K-2 菌株發酵液可溶性鉀含量為23.2 μg·mL-1。對比上述研究,本實驗篩選出的解鉀菌(81.06 μg·mL-1)具有顯著解鉀優勢。此外,本實驗所篩選出的不具備解鉀能力的菌株占35%,而李海龍等[42]實驗中不具解鉀能力的菌株占70%,相關研究表明,微生物的解鉀能力受土壤類型、鉀礦類型及含量、土壤pH、土壤溫度、環境中鉀離子濃度、鉀礦粉粒徑大小等諸多因素的影響[43],因此,進一步分析以不同植物為研究對象篩選出的解鉀菌的解鉀能力差異的原因,對于今后工程菌的普適性具有重要的參考價值。
經16S rDNA 鑒定(見附圖),JK13 為芽孢桿菌屬(Bacillus altitudinis),而李海龍等[42]在秦嶺山區篩選出的QL21、胡洲等[44]在不同作物根際篩選出的K1 和K3、任建國等[45]在太子參根際篩選出的ATS-2-5和KTS-2-4均亦屬芽孢桿菌屬,陳易等[10]在紫色土中篩選出的XD-K-2 為環狀芽孢桿菌屬(Bacillus circulanssp.),李新新等[46]篩選出的G4 為類芽孢桿菌屬(Paenibacillussp.),上述實驗結果證明芽孢桿菌屬微生物在硅酸鹽細菌中占據較大比例,同時其促生、增產作用效果具有顯著優勢[44]。但隨著研究的深入與展開,解鉀菌大多局限于芽孢桿菌屬這一結論[47]被逐漸推翻,如張妙宜等[48]在蓖麻根際篩選出的MY-1 為嗜線蟲賽雷氏菌(Serratia nematodiphila),陳豐宇等[49]在香蕉根際篩選出的1 株具解鉀作用的放線菌為陜西鏈霉菌(Streptomyces shaanxiensis)。
現有研究認為解鉀機制與產生有機酸、產胞外多糖、生物膜形成[50]以及低分子能量酸性物質產生[51]有關,但本實驗中各菌株培養液pH 值同可溶性鉀含量無顯著性相關關系,這與黨雯[52]得出的解鉀能力強弱與pH 相關性不顯著的結論一致,據此推測產酸并不是硅酸鹽細菌發揮解鉀效用的主要因素,菌株可能是以破壞鉀礦石晶體構造、表面接觸發生交換作用等方式溶解無效鉀。谷付旗等[53]對菌株WS-FJ9 的研究則表明解鉀能力由多因素決定,解鉀菌通過分泌有機酸、氨基酸來溶解緩效鉀或利用氨基酸、有機酸、胞外的莢膜多糖三者絡合作用促使鉀源分解。基于以上分析,本實驗篩選出的高效解鉀菌JK13 的具體解鉀機制還有待結合苗期實驗和分子手段進一步研究與驗證。
4 結論
本實驗基于亞歷山大培養基篩選得到的高效解鉀菌JK13 具有較強的的解鉀能力,經16S rDNA鑒定為芽孢桿菌屬。采用單因素實驗與正交設計實驗優化其培養基組分及培養條件,即0.5% 甘露醇、1.5% 酵母粉,初始pH 值為9,裝液量為30 mL·100 mL-1,接種量為1%,培養溫度為35℃。菌株的篩選和培養條件優化豐富了解鉀微生物資源庫,亦為林木附生功能菌的開發和利用提供了研究基礎和數據支持。
附錄

圖 附圖 JK13 菌株16S rDNA

