基于公眾視角的我國藥品生產企業不良反應上報渠道暢通性現狀調查及建議
林梟 伍紅艷 王龍 黃艷 郝興敏 李星辰 余江霞 田柳丹 榮藝

中圖分類號 R95 文獻標志碼 A 文章編號 1001-0408(2022)06-0653-08
DOI 10.6039/j.issn.1001-0408.2022.06.02
摘 要 目的 為提高公眾上報不良反應(ADR)的積極性、促進藥品生產企業提高公眾ADR上報渠道的暢通性及承擔藥品安全主體責任的主動性提供建議,并為我國監管部門開展藥品安全監管工作提供參考。方法 編寫調查問卷,以我國進入全球前1 000位的180家藥品生產企業為對象,選取企業聯系電話、郵箱、官網和新媒體(包括微信和微博)4個渠道進行ADR上報渠道暢通性調查,內容包括公眾上報渠道的建立情況、企業記錄和反饋情況等,對調查發現的問題進行分析并提出建議。結果與結論 我國超過70%的藥品生產企業已建立公眾ADR上報渠道,以聯系電話和郵箱常規渠道為主,且每個渠道都存在ADR信息無法上報的現象;超過60%的企業建立的公眾渠道缺少對上報信息遺漏部分的詢問補充;僅收到24家企業對ADR信息的反饋,且反饋內容單一。建議藥品生產企業加強對公眾ADR監測的重視,在保障渠道暢通性的同時考慮增加多種上報渠道,加強對員工信息收集能力的培訓以提高信息的質量,對公眾上報的ADR信息及時進行反饋,增加公眾較為關注的反饋內容。
關鍵詞 公眾報告;藥物不良反應上報;藥品生產企業;上報渠道;暢通性
Investigation and suggestions on the smoothness of reporting channels for adverse drug reaction of pharmaceutical manufacturers in China based on the public perspective
LIN Xiao1,WU Hongyan1,2,3,WANG Long4,HUANG Yan5,HAO Xingmin1,LI Xingchen1,YU Jiangxia1,? ? ?TIAN Liudan5,RONG Yi5(1. School of Medical and Health Management, Guizhou Medical University, Guiyang 550025, China; 2. Guizhou Institute of Health Development, Guizhou Medical University, Guiyang 550025, China; 3. Key Laboratory of Environmental Pollution and Disease Control of Ministry of Education, Guizhou Medical University, Guiyang 550025, China; 4. Dept. of Pathology, Guiqian International General Hospital, Guiyang 550024, China; 5. School of Public Health, Guizhou Medical University, Guiyang 550025, China)
ABSTRACT? ?OBJECTIVE To provide the suggestions for improving the enthusiasm of the public to report adverse drug reactions (ADRs), promoting pharmaceutical manufacturers to improve the smoothness of ADR reporting channels by the public and the enthusiasm of assuming the main responsibility for drug safety, and to provide reference for the performance of drug safety supervision by regulatory departments in China. METHODS Taking 180 pharmaceutical manufacturers that had entered the top? 1 000 in the world as the objects, the questionnaire was prepared to investigate the smoothness of ADR reporting channels through 4 channels: contact number, e-mail, official website and new media (including Wechat and microblog) of enterprise. The questionnaire involved the establishment of public reporting channels, the records and the feedback of enterprises. The existing problems were analyzed and suggestions were put forward. RESULTS & CONCLUSIONS More than 70% of pharmaceutical manufacturers in China had established the channels for reporting ADR by the public, which were mainly regular channels such as contact numbers and e-mail, and each channel had the phenomenon that ADR information couldnt be reported. More than 60% of the public channels established by manufactures lacked inquiry and supplement for the missing part of the reported information; only 24 pharmaceutical manufacturers provided feedback on ADR information, and the feedback contents were monotonous. It is suggested that pharmaceutical manufacturers should pay more attention to ADR monitoring among the public, consider increasing multiple reporting channels while ensuring the smoothness of channels,strengthen the training of employees information collection ability to improve the quality of information, timely feed back the ADR information reported by the public, and increase the feedback content concerned by the public.
KEYWORDS? ?public reports; reports of adverse drug reaction; pharmaceutical manufacturer; reporting channal; smoothness
我國2019年新修訂的《藥品管理法》規定,藥品生產企業應及時上報藥品不良反應(adverse drug reactions,ADR)信息[1]。2021年,國家藥品監督管理局頒布的《藥物警戒質量管理規范》對藥品上市許可持有人主動開展藥品上市后監測、完善信息收集途徑作了進一步規范[2]。藥品生產企業作為藥品安全的責任主體,對ADR信息進行收集與報告,是保證藥品上市后安全性風險被及時發現與控制的重要手段,也是其開展藥物警戒活動的核心內容[3]。但根據《國家藥品不良反應監測年度報告(2020年)》發布的數據,來自藥品上市許可持有人和個人的ADR報告占ADR報告總數的比例均不超過6%[4]。因此,為提高我國藥品生產企業和個人的ADR上報數量及報告質量,幫助藥品監管部門完善藥物警戒相關監管內容,有必要對我國藥品生產企業收集ADR的現狀進行實際調研。
目前,國內藥物警戒的相關研究主要是基于藥品生產企業角度進行的藥物警戒現狀調查[5-7],也有部分研究通過問卷調查的方式分析了公眾對ADR的認知及上報現狀[8-9],但少有學者調研公眾向藥品生產企業上報ADR渠道的暢通性,而該渠道的暢通性將直接影響公眾上報ADR的積極性和用藥安全。為推動我國藥品生產企業深入開展藥物警戒活動,進一步保障公眾健康,本課題組開展了針對藥品生產企業ADR公眾上報渠道暢通性的調查,并基于公眾視角對相關渠道的建立、公眾上報內容的記錄和企業收到ADR信息后的反饋3個方面進行研究,以期為提高公眾上報ADR的積極性以及企業提高公眾ADR上報渠道的暢通性、承擔藥品安全主體責任的主動性提供建議,并為我國藥品監管部門開展藥品安全監管工作提供參考。
1 資料與方法
1.1 調查對象
本研究參考2021年Torreya發布的《全球1 000強醫藥企業報告(2020年)》(The Pharma 1 000:the Worlds Most Valuable Pharmaceutical Companies:A Torreya Report)[10],選擇我國入圍全球前1 000位的208家醫藥企業為研究對象,剔除其中主營業務是獸藥、原料藥、醫療器械、保健品的28家企業后,最終納入180家企業作為本次調研對象。
1.2 研究方案設計及內容
我國《藥物警戒質量管理規范》第三十五條規定:“持有人應當通過藥品說明書、包裝標簽、門戶網站公布的聯系電話或郵箱等途徑收集患者和其他個人報告的疑似藥品不良反應信息,保證收集途徑暢通”[2]。本研究根據上述法規條例對藥品上市許可持有人進行ADR監測和上報的要求,選取企業聯系電話、郵箱、官網和新媒體(包括微信和微博)4個渠道進行暢通性調查。
調查問卷由企業基本信息和ADR公眾上報渠道暢通性調查兩部分組成。企業基本信息包括企業排名、企業類型、注冊地、成立時間、主營藥品類型、主要治療領域、2020年年收入和是否被納入全國藥品集中帶量采購名單等。為保證數據的準確性,受訪企業的企業類型、注冊地和成立時間由本課題組在國家藥品監督管理局官網查詢獲得;企業主營藥品類型和主要治療領域在企業官網和國家信用信息公示系統查詢獲得;企業是否被納入集中帶量采購名單根據國家組織的藥品集中招標采購中選結果判斷(截止日期為2021年6月28日;企業有任意1種藥品中選即判斷為納入企業);企業排名和企業2020年年收入數據則來自Torreya發布的《全球1 000強醫藥企業報告(2020年)》。調研時間為2021年7-9月。
根據文獻檢索結果和相關法規的要求,經本課題組成員討論確定,渠道暢通性部分由企業建立公眾上報ADR的渠道情況、企業對公眾上報ADR信息的記錄情況和企業對公眾上報ADR信息的反饋情況3個部分組成,同時咨詢相關專家意見并結合各渠道特點設計相應調查內容。
(1)企業建立公眾上報ADR的渠道情況:查詢企業官網、所生產藥品的外包裝和說明書、企業官方微信公眾號、企業官方微博和搜索引擎等,對受訪企業是否建立公眾上報ADR的相關渠道、渠道上報方式的標識是否醒目、是否明確有“不良反應上報”“藥物警戒”等相關文字標識等情況進行記錄。其中,企業官方微信公眾號和微博以是否經企業或微信/微博平臺認證判斷;官方聯系電話以是否為400或800(即公眾撥打電話產生的通訊費部分或全部由企業承擔)開頭判斷;渠道上報方式的標識是否醒目以相關信息是否處于公示頁面的中心區域并與同位置的其他信息相比字號大小如何等進行判斷。
(2)企業對公眾上報ADR信息的記錄情況:由調研員根據企業在上述渠道中提供的方式進行ADR上報,內容為本課題組統一制訂的示例信息;記錄上報過程中與企業溝通的內容信息,包括該渠道是否接受ADR上報,是否為專業人員處理、企業是否詢問了其他相關信息、處理情況及是否承諾反饋等,若不接受上報則詢問原因、是否有其他上報方式。為保證上報信息的一致性,本次調查上報的ADR示例信息僅包含患者基本信息、原患疾病、藥品信息、ADR描述4個部分;其中,藥品信息和ADR描述根據受訪企業生產的藥品品種而相應變動。對于企業詢問了上報者其他相關信息的,應予以記錄,并將其內容與原國家食品藥品監督管理局統一印制的《藥品不良反應/事件報告表》(以下簡稱“《報告表》”)進行比較。調研過程中,若企業聯系電話無法接通,調研員需做好記錄并在接下來的7個工作日的工作時間內連續撥打,超過時限的則記錄為“無法接通”;郵箱調研需設置郵件回執,對已讀未回復或發送失敗的郵件進行記錄。對于企業官網、官方微信公眾號和官方微博的查詢,除藥品說明書和官網公布的以外,還需利用搜索引擎進行補充,并以帶有平臺認證標志的為準。本研究只納入了與藥品質量、藥物警戒等內容相關的聯系電話和郵箱地址,未納入企業招聘信息等專用電話和郵箱地址。
(3)企業對公眾上報ADR信息的反饋情況:反饋以企業收到上報ADR信息后30個工作日為限,詳細記錄企業的反饋時間、反饋方式和反饋內容等,超過上述時限則視為無反饋。
以聯系電話為例,具體調查流程詳見圖1。
1.3 質量控制方法
向調研員統一發放調研手冊并進行培訓,以規范調研行為。在小范圍內進行預試后進一步對調研方案進行修改完善。采取兩人一組合作調查的方式對同一家企業展開正式調研。由數據審核員對調研當日的調研結果進行審核并錄入。
1.4 統計學方法
采用EpiData 3.0軟件進行數據錄入,使用SPSS 19.0軟件進行統計分析。計量資料以x±s表示,計數資料采用頻數和率表示。
2 調研結果
受訪的180家企業共覆蓋我國29個省、自治區、直轄市和特別行政區,其中164家企業(91.1%)為上市企業。《全球1 000強制藥企業報告(2020年)》中我國排名最前的企業是江蘇恒瑞醫藥(全球第21位),排名最末的是浙江莎普愛思藥業(全球第1 000位);截至2021年7月1日,企業平均成立時間為(22.92±6.93)年,成立時間最早的是沈陽興齊眼藥(1977年),最晚的是歐康維視生物醫藥(上海)(2018年);調研企業的2020年平均年收入為(65.12±105.61)億元,年收入最高的是揚子江藥業(768億元),最低的是諾誠健華(64萬元)。從主營藥品類型和治療領域來看,180家企業中,包含中藥企業33家、生物藥企業53家、化學藥企業24家和混合型(主營藥品類型2種及以上)企業70家,覆蓋腫瘤、眼科、心血管系統、呼吸系統、中樞神經系統等11個治療領域。此外,納入我國前五批集中帶量采購的企業共有54家。
統計結果顯示,超過70%的企業已建立公眾ADR信息上報渠道,但可供公眾上報的渠道以聯系電話和郵箱常規渠道為主,且每個渠道都存在ADR信息無法上報的現象;超過60%的企業建立的公眾上報渠道缺少對上報信息遺漏部分的詢問補充;僅收到24家企業對上報的ADR信息的反饋,且反饋內容較為單一。4個渠道的具體調研結果如下。
2.1 聯系電話上報渠道
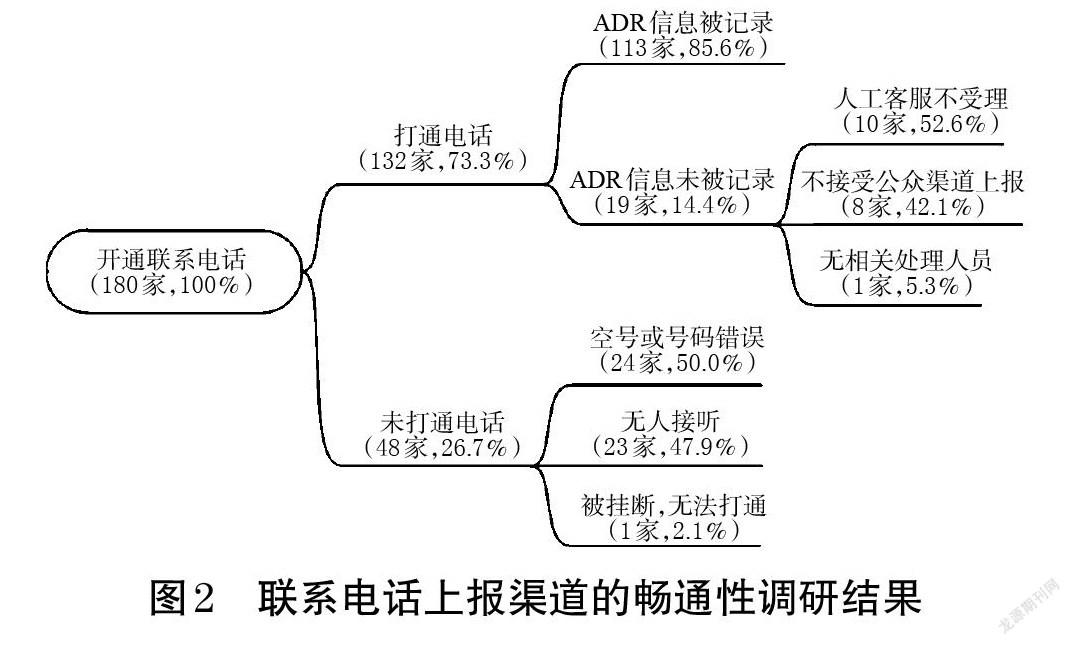
2.1.1 渠道建立情況 所有企業在其藥品外包裝、說明書或官網上均公開了聯系電話,且聯系電話都放在醒目位置,字體大小適中。180家企業中,有52家企業(28.9%)的聯系電話以400或800開頭;有35家企業(19.4%)明確標注了ADR上報或藥物警戒的專用熱線,其中1家企業還明確將ADR上報電話與銷售電話進行區分,并標明了熱線開通時間。盡管所有企業都公布了聯系電話,但有48家企業(26.7%)的電話為空號或號碼錯誤、在連續7個工作日內撥打均無人接聽或直接被掛斷。聯系電話上報渠道的暢通性調研結果見圖2。
調查結果顯示,在19家未記錄ADR上報信息的企業中,有企業人工客服不受理的理由為“企業主要關注醫療機構的反饋,公眾可向醫療機構反饋,企業將向醫生跟進實際情況”;有企業無相關部門負責公眾上報,建議調研員與企業其他部門聯系,而調研員與其提供的其他部門聯系卻被告知也不屬于其工作職責范圍;還有企業客服在記錄ADR信息時告知調研員暫無相關處理人員,后續將請示上級分配處理部門。
2.1.2 企業記錄情況 在打通聯系電話的132家企業中,有121家企業(91.7%)為人工客服,有11家(8.3%)為智能語音客服;除2家(1.5%)需要轉接2次才可聯系到相關客服以外,其余130家企業均可直接撥通。在121家以人工客服接待的企業中,有93家企業(76.8%)設置有專門負責ADR信息上報、處理的人員,其余28家僅設置有問題記錄人員。
在記錄了上報信息的113家企業中,有96家企業(85.0%)對遺漏信息進行了詢問。在這96家企業中,38家企業(39.6%)詢問和記錄的內容符合《報告表》的要求;56家企業(58.3%)雖對部分遺漏信息進行了詢問,但并未涵蓋《報告表》的全部內容;另有2家企業(2.1%)除記錄《報告表》的相關內容外,還詢問了調研員的其他信息,如是否為首次服藥、是否就診及就診采取的治療措施等。上述96家企業詢問的遺漏信息中,既往ADR史/家族ADR史的記錄率最低(41家,42.7%),其次是相關重要信息(吸煙史、飲酒史、妊娠期、肝病史、腎病史、過敏史等)和ADR后續情況(停藥或減量后癥狀是否消失或減輕、再次使用可疑藥品后是否出現同樣反應/事件等),分別為58家(60.4%)、62家(64.6%)。值得注意的是,仍有17家企業(15.0%)未對調研員上報的ADR信息進行任何補充詢問,甚至有企業客服明確表示對上報內容的完整性沒有要求,其只負責記錄上報信息。
根據《報告表》的填報要求,除需填寫發生ADR的藥品信息并描述ADR癥狀外,還需記錄上報者的聯系方式,以便于后續信息的追蹤。打通聯系電話的132家企業中,有68家企業(51.5%)會詳細記錄上報者聯系方式,如某企業的客服還對上報者與用藥患者的身份加以區分,詳細記錄上報者和用藥患者的關系及各自的聯系方式,并回訪了用藥患者;但仍有64家(48.5%)企業未記錄上報者的聯系方式。
2.1.3 企業反饋情況 在受訪企業記錄上報信息的過程中,有14家企業(10.6%)承諾會有反饋。在上報后的30個工作日內,調研員最終共收到15家企業的反饋信息,其中曾承諾會有反饋的企業有11家(73.3%),另有4家企業(26.7%)未曾承諾但也向調研員進行了信息反饋。
在反饋時間方面,13家企業(86.7%)在收到ADR上報信息的1周內進行了反饋,另有2家分別在信息上報的15、23 d后向調研員進行了反饋。其中,最快的1家企業在收到上報信息后4 h內即給予了反饋,有2家企業在24 h內給予了反饋。
反饋內容主要包括企業對調研員上報事件的處理進度及后續安排、調查結果、用藥建議和解決方案4類。15家企業中,有6家企業(40.0%)在反饋中表明其收到ADR上報信息后就已經開始啟動調查并告知調研員當前進度及后續安排;有4家企業(26.7%)反饋了此次ADR的調查結果,并對出現ADR的原因進行了說明;有4家企業(26.7%)的反饋中包含了安全用藥的建議,對藥品的配伍禁忌、服藥時間和注意事項進行了說明;有2家企業(13.3%)反饋了此次ADR的賠償方案,建議調研員/用藥患者先去醫療機構進行全面檢查,若后續調查確定ADR與服用本企業藥品有關,愿意承擔全部費用。13家企業(86.7%)通過電話向上報者反饋信息,其余2家(13.3%)則通過專業客服添加上報者微信的方式進行反饋。
2.2 郵箱上報渠道
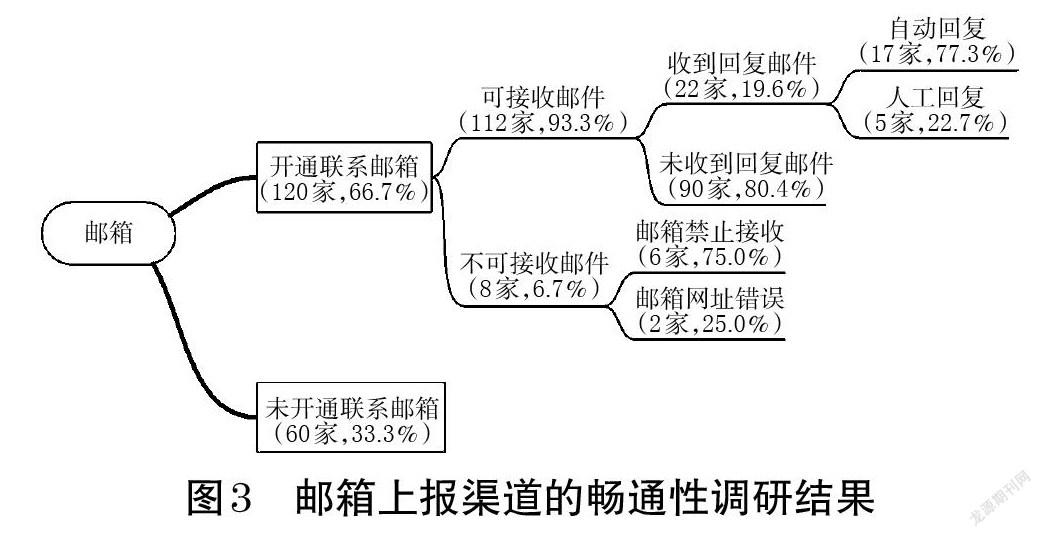
2.2.1 渠道建立情況 有120家企業(66.7%)已在官網、藥品外包裝和說明書中標明了聯系郵箱地址,且大部分公示位置都易于公眾查詢,但仍有2家企業官網公布的聯系郵箱位于網頁最底部,字體偏小且不夠醒目。120家公布了聯系郵箱的企業中,有8家企業(6.7%)的郵箱地址錯誤或設置了禁止接收,其余112家企業(93.3%)均可成功收到郵件(調研員收到了郵件已讀回執)。郵箱上報渠道的暢通性調研結果見圖3。
2.2.2 企業記錄情況 收到已讀回執的112家企業中,僅22家(19.4%)針對ADR上報信息回復了郵件,包括17家自動回復和5家人工回復。回復信息的22家企業中,有13家(59.1%)對郵件中上報的遺漏信息進行了詢問,但未有企業能完整詢問《報告表》中的所有內容。詢問并記錄的信息中,除既往ADR史/家族ADR史的信息未有任何企業進行詢問外,記錄率較低的3項分別是藥品信息(2家,15.4%)、原患疾病(4家,30.8%)和ADR后續情況(5家,38.5%)。在對遺漏信息進行郵件詢問記錄的企業中,要求填報上報者聯系方式的僅5家(38.5%),其中有1家企業不僅詢問了上報者的聯系電話,還派專業客服添加了上報者微信以便開展后續追蹤。
2.2.3 企業反饋情況 在通過郵箱發送ADR上報信息后的30個工作日內,調研員最終共收到5家企業的反饋信息,反饋時間均在24 h內。從反饋內容來看,有4家企業以郵件形式反饋了ADR的處理進度及后續安排,內容較為統一:首先向上報者表示該企業高度重視此次ADR,其次反饋了此次ADR的調查方案以及當前進度。還有1家企業通過電話反饋,向上報者再次確認上報信息,并告知該事件當前正由研發部門處理,處理結果將再次反饋給上報者。
2.3 官網上報渠道
2.3.1 渠道建立情況 有173家企業(96.1%)建立了官方網站,其中標明公眾ADR上報或藥物警戒專用上報渠道的企業僅36家(20.8%)。值得一提的是,有1家企業的官網專門建立了ADR上報平臺,并有在線客服服務,該平臺不僅向公眾科普了ADR相關知識,鼓勵其積極上報ADR信息,而且公布了旗下所有企業藥物警戒部門的聯系方式。在建立了官網上報渠道的企業中,有17家企業(37.8%)可在網頁留言處選擇問題類型進行ADR上報,20家企業(44.4%)要求上報者填寫相關電子表格進行上報,調研員的ADR信息均提示上報成功;另有9家企業(20.0%)開通了在線客服入口,可聯系人工客服(8家,88.9%)或電子客服(1家,11.1%)進行上報,其中有1家企業未記錄上報信息,理由是該人工客服不受理此類問題。特別值得一提的是,有1家企業為公眾提供了多種上報方式,包括官網填寫表格、在線提交報告表、專用的熱線電話(標明了熱線開通時間)及郵箱、手機掃碼填寫報告表等,便于上報者選擇。官網上報渠道的暢通性調研結果見圖4。
2.3.2 企業記錄情況 17家采取網頁在線留言進行上報的企業中,由于留言方式的局限性,15家企業(88.2%)對留言的填報內容無要求,僅2家企業的留言模塊是根據《報告表》的內容來設計的。20家采取電子表格收集上報信息的企業中,有19家企業(95.0%)使用了自行設計的表格,僅1家采用了《報告表》原表。相較于《報告表》的內容,有18家企業(94.7%)自行設計的表格存在部分內容缺失。而9家通過在線客服上報的企業均未對上報信息有所要求。
記錄了ADR信息的44家企業中,有8家企業(18.2%)要求上報者提供聯系方式,包括網頁在線留言上報的7家(87.5%)和電子表格上報的1家(12.5%),而在線客服均未要求上報者提供聯系方式。
2.3.3 企業反饋情況 在通過官網上報ADR信息后,調研員最終共收到3份反饋信息,反饋時間均在24 h內,皆以電話回訪的方式進行反饋。3家企業的反饋內容側重點有所不同:1家企業主要向上報者說明了此次ADR的解決方案,包括患者在醫院檢查費用的報銷、企業會上門對藥品進行回收檢查等;1家企業則反饋了當前ADR的處理進度及后續安排,表示目前已有藥物警戒部門跟進此次ADR,將在7個工作日內再次向上報者反饋調查結果;還有1家企業表示將對藥品開展追蹤,希望上報者提供藥品生產批次信息。
2.4 新媒體上報渠道
2.4.1 渠道建立情況 分別有161家企業(89.4%)和80家企業(44.4%)開通了官方微信公眾號和官方微博。有11家企業(31.4%)在其官方微信公眾號中設立了藥品質量反饋入口,并標注了ADR或“藥物警戒上報”等字樣。有7家企業(8.8%)在其官方微博中設立了藥品質量反饋入口,但僅有1家(14.3%)有ADR或藥物警戒上報的相關標注。還有4家企業(2.2%)同時開通了官方微信公眾號和微博,但也僅有1家企業在其官方微信公眾號和微博的醒目處設置了ADR或藥物警戒上報的專用標識。公眾通過新媒體上報ADR暢通性的調研結果見圖5。
由圖5可見,在開通了官方微信公眾號或微博的企業中,分別僅有1家企業對上報的ADR信息進行了記錄。有1家企業在官方微信公眾號上開通了微官網入口,公眾可以通過人工客服進行ADR信息上報;而另一家記錄了上報信息的企業將其標注了ADR在線上報的微博設置為置頂微博。官方微信公眾號未記錄上報信息的主要原因是上報渠道無響應、需要機構賬號登錄(33家,97.1%),或該渠道僅供內部銷售人員及醫護人員上報使用而不對公眾開放(1家,2.9%)。官方微博上報失敗的原因則與該上報渠道反應遲緩、無法識別上報信息屬于何種問題等因素有關。
2.4.2 企業記錄及反饋情況 唯一一家官方微信公眾號記錄ADR信息的企業除記錄了調研員上報的信息外,還詢問了ADR的后續癥狀和減藥、停藥后的癥狀變化等遺漏信息,但未記錄上報者或用藥患者的聯系方式,接待的人工客服并非ADR專業服務人員,未承諾是否反饋處理結果,調研員也未收到反饋。唯一一家記錄了上報信息的企業官方微博是由專業處理ADR上報的人工客服接待的,但上報過程未向調研員詢問其他遺漏信息和聯系方式,未承諾反饋處理結果,調研員也未收到反饋。
3 討論與建議
3.1 公眾通過企業上報ADR信息存在的問題
截至2020年底,我國共有4 460家藥品生產企業,我國藥品監督管理工作取得較大成效,藥品監管部門總共收到167.58萬份ADR報告[11]。本研究調查的180家藥品生產企業屬于我國綜合實力及創新性較強的企業,盡管如此,調查結果顯示,我國藥品生產企業在公眾ADR上報渠道的暢通性方面仍存在以下問題:
第一,部分企業缺乏對上報渠道的定期維護。根據調查結果顯示,我國藥品生產企業已不同程度地建立起公眾上報ADR信息的相關渠道,主要以聯系電話、郵箱和官網等渠道為主,但有超過1/3的企業所建上報渠道并不能記錄ADR信息。公眾較常用的上報渠道中,常出現電話無人接聽或郵箱禁止接收郵件等情況,主要原因可能與工作人員未及時更新公眾上報渠道的聯系電話和郵箱設置了禁止接收陌生郵件有關。
第二,企業建立的ADR上報渠道仍然以傳統的電話聯系為主,較為單一,對于公眾接觸日漸密切的新型社交媒體使用較少。本次調研結果顯示,在180家受訪企業中,官方微信公眾號和微博的開通率分別為89.4%、44.4%,而這些開通官方微信公眾號或微博的企業中僅有少部分開通了公眾上報ADR信息的渠道,且大部分渠道無法完成ADR上報。從2021年騰訊與新浪微博官方發布的數據來看,微信和微博的月活躍人數已經分別達到了12.02億和5.3億,這樣龐大的用戶群背后隱藏著巨大的數據挖掘潛力[12-13],相關企業若能將其合理利用,可有助于填補藥品臨床試驗數據的不足,盡早發現真實世界用藥中存在的潛在風險。
第三,人員的專業性普遍不足。首先,企業內部尚未建立完善的信息收集制度是影響公眾上報ADR的原因之一。在本次調查中,部分企業的客服僅負責記錄上報信息,需等待相關專業人員進行處理。其次,雖有部分企業內部已建立了信息收集制度,但客服或處理人員對上報信息的處理流程不夠熟悉,甚至出現客服記錄了上報信息卻不知交由哪個部門處理的情況。最后,客服人員的專業性有待加強。本次調查結果顯示,超過60%的企業未對調研員上報的信息進行詢問補充或詢問內容不夠完整,與原國家食品藥品監督管理局統一印制的《報告表》的要求還有一定差距。此外,調查中還發現,各渠道中都存在部分企業僅記錄ADR信息但未記錄上報者聯系方式的現象,有超過60%的企業客服未記錄上報者的聯系方式,這不利于企業對新的或嚴重的ADR信息進行后續追蹤。
第四,企業對公眾上報的ADR信息未形成閉環處理,反饋內容與公眾需求存在差異。有研究表明,大多數上報者對反饋的信息都存在一定的需求,“對患者ADR癥狀的處理建議”“報告的信息是否屬于ADR”等信息是公眾最希望得到反饋的內容,若反饋內容不能滿足公眾上報需求,會在一定程度上影響公眾上報ADR的參與度[14-15]。本次調查結果顯示,超過80%的企業在收到ADR信息后未向上報者進行反饋,僅記錄了ADR信息或告知上報者隨后會上報給藥物警戒小組或ADR監測部門處理,而并未公開調查結果或處理方案。從企業反饋的內容來看,多數反饋的內容較為單一,主要是反饋ADR的調查方案或調查結果,而公眾需求的其他信息(如出現的ADR如何進行處理、是否屬于正常現象等)則較少得到滿足。
3.2 建議
3.2.1 定期對ADR上報渠道進行維護 ADR上報渠道的暢通與否是接收公眾上報信息的基礎,藥品上市許可持有人應提高對ADR信息收集的重視,對于企業已經建立的公眾上報專用渠道應加強維護。第一,建議將維護上報渠道的暢通性劃入藥物警戒或ADR監測部門的職責,由專業人員定期檢查渠道的上報方式是否正常運行或及時更新,確保公眾上報的信息能通過相關渠道被及時記錄。第二,為確保信息收集工作的高效開展,建議將公眾上報渠道與銷售人員或醫療機構人員的上報渠道進行區分,以便公眾選擇更為自由的上報方式,同時也有利于企業對不同來源的數據進行挖掘分析。第三,相關聯系方式應放置渠道醒目處,且明確標注“藥物警戒上報”“ADR”等字樣,引導并鼓勵公眾積極上報ADR信息。
3.2.2 拓展多種公眾上報渠道及方式 除常見的聯系電話、郵箱和官網上報渠道外,藥品生產企業應滿足公眾上報的易操作性、便利性等特點,建立多種渠道以供公眾自由選擇。社交媒體是深入人們日常生活并影響其生活行為和習慣的重要平臺,數據顯示,社交媒體用戶平均每天在社交媒體上花費的時間超過2 h[16]。有數以億計的用戶曾討論過ADR經歷或有相關咨詢的需求[17],企業可考慮在微信、微博或視頻應用軟件等新型社交媒體上建立上報渠道,為藥品上市后安全性監測提供大量的真實世界數據,彌補現有安全性監測臨床數據的不足,甚至可能發現新的非預期ADR信息。上報方式可根據渠道的不同進行具體的開發設計,形式不局限于文字或表格,如可考慮以短視頻的方式展示在企業官方網站上。面向公眾建立專門的ADR上報平臺也是一種值得借鑒的具體措施,所有上報者可在任何時間通過平臺上報ADR,而企業可通過對平臺所獲ADR信息進行數據挖掘,進而對存在安全風險的藥品加強監管,并可在平臺發布警示,讓公眾或醫務人員及時知曉用藥風險,甚至還可借助平臺對賠償方案的細則進行公示。此外,企業還應考慮特殊群體(如農村老齡人口、留守兒童或不會使用智能設備的群體等)上報的便捷性,可定期委派專人前往鄉鎮或社區,設置用藥安全咨詢點,加強對ADR上報的宣傳,協助困難人群ADR信息上報。
3.2.3 加強員工培訓 ADR監測是一項涉及藥學、臨床醫學、流行病學、統計學等學科的綜合性工作,不僅需要組建多學科團隊,而且需加強對員工的培訓。首先,建議藥品生產企業對ADR監測和收集的人員開展定期培訓,加強其對ADR信息收集的重視,尤其對通過電話或網絡等直接與上報者進行溝通的客服,可重點培訓其如何引導上報者詳細描述ADR信息,以及如何針對遺漏信息進行詢問補充。其次,對于日常檢查中梳理出的問題,應進行針對性的優化培訓。最后,企業可考慮建立專項工作考核機制,對員工ADR監測與上報工作進行日常考核,提高ADR監測工作質量。
3.2.4 合理設計公眾上報渠道的填報內容 ADR上報信息越全面、完整,越有利于安全信息分析評價和病例跟蹤。藥品生產企業在建立公眾上報渠道時,應根據各渠道的特點設計填報內容,如在線留言上報方式可根據《報告表》設計信息填報模塊,信息填報完整方可允許其進行上報。設計渠道填報內容時,建議將國家藥品ADR監測上報內容設置為必填項。每例ADR上報完成后,應及時發送給企業相關藥師對該信息進行評價,包括ADR類型鑒別、上報信息完整性評價等,必要時應進行臨床跟蹤。考慮到公眾可能不熟悉專業術語信息、不注意保存產品包裝、不知如何描述ADR具體癥狀等實際問題,不同上報者上報信息的準確性和可利用性存在差異,故渠道設計應在滿足監測需要的同時,考慮如何引導公眾進行完整描述。如郵箱渠道,應在收到公眾上報郵件時,自動回復電子表格及上報示例以供公眾完善遺漏信息。此外,在設計公眾信息上報渠道時,還需考慮公眾填寫的便利性,選擇簡單易懂的提示詞引導其完成信息填報,在保護上報者隱私的基礎上加強對上報者聯系方式的記錄。
3.2.5 建立處理ADR信息的閉環流程 國家藥品監督管理局在2018年發布的《個例藥品不良反應收集和報告指導原則》中明確提出,有必要對個例ADR開展隨訪和反饋,以形成完整的ADR信息收集閉環[18]。企業應根據上述要求,按照藥品的不同風險等級建立相應的ADR反饋機制,對上報信息進行及時反饋,完善工作流程。企業的反饋應根據公眾上報信息的需求,合理設計反饋內容以提高公眾ADR上報的積極性。當企業接收到嚴重或致死ADR上報時,應及時將ADR調查結果在其官網或官方微信公眾號進行公示。此外,企業可考慮建立藥品ADR損害救濟制度,設立應對嚴重ADR的救濟基金,此舉不僅可激勵公眾主動進行ADR上報,而且有利于樹立企業形象[19]。當發現嚴重ADR時,在確定該事件與企業生產藥品有因果關系后,企業應及時向患者反饋賠償方案,調取相關基金對患者檢查和治療費用予以報銷和補償。
4 結語
本研究調查了我國180家藥品生產企業面對公眾開放的ADR信息上報渠道的暢通性,結果顯示,我國藥品生產企業面對公眾開放的ADR上報渠道存在ADR信息不能被記錄、拒收等情況;上報渠道以聯系電話渠道為主,渠道的多樣性和人員的專業性不足;對公眾上報ADR信息的工作流程存在一定的欠缺,未形成完整的閉環。總體來說,我國藥品生產企業在收集公眾上報ADR信息和維護上報渠道暢通性方面存在一定的不足。建議藥品生產企業加強對公眾ADR監測的重視,在保障渠道暢通性的同時考慮增加多種上報渠道,加強對員工信息收集能力的培訓以提高信息的質量,并對公眾上報的ADR信息及時進行反饋,增加公眾較為關注的反饋內容。
參考文獻
[ 1 ] 全國人民代表大會.中華人民共和國藥品管理法[EB/OL].(2019-08-27)[2021-10-26]. https://www.nmpa.gov.cn/xxgk/fgwj/flxzhfg/20190827083801685.html.
[ 2 ] 國家藥品監督管理局.國家藥監局關于發布《藥物警戒質量管理規范》的公告:2021年第65號[EB/OL].(2021- 05-13)[2021-10-26]. https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20210513151827179.html.
[ 3 ] 孫京林,余伯陽.藥品上市許可持有人制度下的質量管理體系[J].中國藥學雜志,2020,55(23):1919-1922.
[ 4 ] 國家不良反應監測中心.國家藥品不良反應監測年度報告:2020年[EB/OL].(2021-05-14)[2021-10-26]. https://www.nmpa.gov.cn/directory/web/nmpa/xxgk/fgwj/gzwj/gzwjyp/20210325170127199.html.
[ 5 ] 王佳域,柳鵬程,陳巧云,等.江蘇省不同規模藥品生產企業藥物警戒工作現狀對比研究[J].中國藥房,2020,31(17):2070-2075.
[ 6 ] 王丹,李馨齡,董鐸,等. 藥品生產企業直接報告不良反應能力調查研究[J].中國藥物警戒,2019,16(11):654- 661.
[ 7 ] 司瑋,吳晶,李堯,等.南京市藥品生產企業不良反應報告和監測檢查情況分析[J].中國衛生產業,2018,15(35):162-163.
[ 8 ] 蔡藍,高亞,李嘉偉,等.廣東省公眾對藥品不良反應的認知現狀調查分析[J].中國藥房,2015,26(21):2887-2889.
[ 9 ] 胡永建,梁世民,申夢迪,等.河南省居民藥品不良反應認知調查[J].中國公共衛生,2018,34(2):234-237.
[10] Torreya. The pharma 1 000:the worlds most valuable pharmaceutical companieshttps:a Torreya report[EB/OL].(2020-09-23)[2021-8-26]. https://torreya.com/publications/pharma-1000-worlds-most-valuable-pharmaceutical-
companies-in-2020_executive-summary.php.
[11] 國家藥品監督管理局綜合和規劃財務司,國家藥品監督管理局信息中心.藥品監督管理統計年度報告:2020年[EB/OL].(2021-03-26)[2021-10-26]. http://www.gov.cn/xinwen/2021-05/14/content_5606276.htm.
[12] 楊羽,王勝鋒,詹思延.社交媒體數據在藥品上市后安全性監測的應用[J].北京大學學報(醫學版),2021,53(3):623-627.
[13] ZHOU Z Y,HULTGREN K E. Complementing the US Food and Drug Administration adverse event reporting system with adverse drug reaction reporting from social media:comparative analysis[J]. JMIR Public Health Surveill,2020,6(3):e19266.
[14] 王曉駿,路長飛,趙玉娟,等.我國藥品不良反應公眾報告途徑和報告內容調研和思考[J].中國藥物警戒,2017,14(7):413-418.
[15] 嚴珺怡,王尚堯,于泳.國內外藥品不良反應公眾報告的比較研究[J].中國合理用藥探索,2020,17(9):15-20.
[16] Wearesocial. Digital use around the world in July 2020[EB/OL].(2020-09-06)[2021-10-26]. https://wearesocial.com/blog/2020/07/digital-use-around-the-world-in-july-2020#.
[17] TENBARGE A M,RIGGINS J L. Responding to unsoli- cited medical requests from health care professionals on pharmaceutical industry-owned social media sites:three pilot studies[J]. J Med Internet Res,2018,20(10):e285.
[18] 國家藥品監督管理局.國家藥監局關于發布個例藥品不良反應收集和報告指導原則的通告:2018年第131號
[EB/OL].(2018-12-21)[2021-10-26]. https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20181221172901438.html.
[19] 張楓,徐曉媛.日本與我國臺灣地區藥品不良反應損害救濟基金制度的比較及對我國的啟示[J].中國藥房,2017,28(22):3036-3039.
(收稿日期:2021-11-22 修回日期:2022-01-11)
(編輯:孫 冰)

