轉鐵蛋白受體1對結核分枝桿菌胞內生存影響的初步研究
李軍麗 姜愛國 付麗麗 占玲俊 趙愛華
結核分枝桿菌(Mycobacteriumtuberculosis,M.tb)是一種胞內寄生病原菌,其感染后主要在宿主巨噬細胞內生存和繁殖。鐵是M.tb生存繁殖的必要條件,M.tb本身胞內缺鐵,必須通過宿主獲得自身生長繁殖所需要的鐵元素。M.tb毒力和生長機制的研究表明,其在缺鐵情況下生長停滯,且逐漸獲得與低氧生長條件下相似的休眠表型。與野生型和鐵儲存蛋白bfrB回補菌株比較,M.tbbfrB基因缺失突變株表現出對小鼠肺部侵染毒力和持久性的降低[1]。此外,筆者團隊前期在探討M.tb感染與機體鐵代謝水平的研究中也同樣發現,鐵過載M.tb感染小鼠肺、脾臟和肝臟等組織器官荷菌量及結核病理性改變均明顯高于單純M.tb感染對照組[2]。這些結果均表明宿主鐵水平與M.tb的毒力及其在宿主體內復制之間存在關聯,提示宿主鐵代謝相關基因可能成為抗結核新靶點。
轉鐵蛋白受體(transferrin receptor,TfR),即CD71分子,是一種Ⅱ型跨膜糖蛋白,由兩個同源二聚體的亞基通過兩條二硫鍵交聯而成[3,4]。TfR主要功能是通過與轉鐵蛋白(transferrin,Tf)相互作用參與和介導鐵的吸收,是細胞鐵穩態的關鍵調節器[5,6]。目前已發現兩種TfR,即在結構和功能上都比較相似的轉鐵蛋白受體1(transferrin receptor 1,TfR1)和轉鐵蛋白受體2(transferrin receptor 2,TfR2)。TfR1被廣泛關注并大量報道與貧血、神經退行性疾病以及癌癥等的發生有關,在非小細胞肺癌、乳腺癌和腎癌中,腫瘤細胞過表達TfR1后對鐵元素的吸收速度加快,而相應的患者預后也表現較差[7~11]。同時,越來越多的報道顯示,TfR1的異常表達與傳染性疾病的發生、發展也同樣密切相關,且研究主要圍繞病原菌感染與宿主細胞鐵代謝穩態間的相互影響。
本研究則在前期的基礎上通過細胞水平探討鐵吸收代謝相關受體TfR1與M.tb胞內生存關系,進一步明確TfR1在M.tb感染期間的作用機制,為TfR1成為抗結核潛在新靶點奠定研究基礎。
材料與方法
1.細胞、菌株與動物:RAW 264.7小鼠單核-吞噬細胞白血病細胞由筆者所在實驗室保存。M.tb標準株H37Rv(菌株號:93009)和恥垢分枝桿菌(Mycobacteriumsmegmatis,M.smegmatis)由筆者所在實驗室保存。6~8周齡SPF級雌性C57BL/6N小鼠,體質量為18~20g,購自北京維通利華實驗動物技術有限公司[SCXK (京)-2016-0006]。
2.主要試劑:右旋糖酐鐵注射液購自江西創導動物保健品有限公司,山羊血清、DAB顯色試劑盒購自北京Solarbio公司,GAPDH一抗、TfR1一抗、HRP酶標二抗購自英國Abcam公司,PVDF膜、HRP ECL發光液購自德國Millipore公司,TransScript?One-Step gDNA Removal and cDNA Synthesis SuperMix試劑盒和2×TransTaq?High Fidelity (HiFi) PCR SuperMix Ⅱ (-dye)試劑盒購自北京TransGen Biotech公司,FITC熒光染料購自美國Thermo Fisher公司,Trypsin-EDTA (0.25%)、DMEM培養基購自美國Gibco公司,中性羅氏培養管購自珠海貝索生物技術有限公司。
3.鐵過載小鼠模型的建立:采用完全隨機法將20只C57BL/6N小鼠隨機分為陰性對照組、低劑量組、中劑量組和高劑量組,每組5只。低、中、高劑量組分別經腹腔注射右旋糖酐鐵3.75、7.50、15.00毫克/次,陰性對照組則經腹腔注射等體積0.9%NaCl注射液,3 次/周,共計4周。定期觀察小鼠生長及精神狀態,稱重并記錄。
4.鐵過載小鼠模型M.tb感染:采用完全隨機法將24只C57BL/6N小鼠隨機分成鐵過載M.tb感染組、M.tb感染組、鐵過載模型組和正常對照組,每組6只。其中,M.tb感染小鼠經尾靜脈注射100μl 1×106CFU/ml對數生長期H37Rv單細胞菌懸液,空白對照組注射等劑量0.9%NaCl注射液。ABSL-3實驗室正常飼喂,觀察并記錄小鼠臨床表現,感染后4周解剖小鼠。
5.肺部切片免疫組織化學分析:肺組織切片置于耐高溫玻片架,pH值6.0檸檬酸鹽緩沖液沒過玻片,微波加熱至沸騰進行抗原修復。滴加3% H2O2溶液覆蓋切片,室溫避光孵育10min后PBS洗滌3次。滴加500μl山羊血清,37℃封閉15min。每張切片滴加300μl按1∶1000稀釋的抗TfR1一抗,37℃孵育1h后PBS洗滌3次,隨后滴加300μl按1∶10000稀釋的HRP酶標二抗,37℃孵育30min后PBS洗滌3次。每張切片滴加500μl新鮮配制的DAB染色液,室溫避光孵育10min,流水漂洗終止顯色反應。蘇木精復染后經梯度乙醇脫水干燥,二甲苯透明,中性樹膠封固后觀察。
6.TfR1免疫印跡與qPCR分析:取10μl肺組織研磨液上清及蛋白相對分子質量標準至SDS-PAGE膠進行電泳分離,采用半干法將蛋白分子轉移至PVDF膜。TBST清洗PVDF膜3次,5% BSA溶液室溫封閉1h。PVDF膜經1∶1000稀釋的抗TfR1一抗4℃孵育12h,TBST清洗3次,1∶5000稀釋的HRP酶標二抗37℃孵育3h后進行顯影檢測。無RNase水調平反轉錄合成的cDNA模板濃度,按20μl反應體系中10μl SuperMix,6.5μl去離子水,3μl 10倍稀釋的cDNA模板和0.5μl引物進行擴增。以GAPDH為內參基因,按95℃預變性4min,94℃變性30s,60℃退火30s,72℃延伸45s,循環35次,72℃后延伸10min的反應條件進行TfR1基因擴增。
7.RAW 264.7巨噬細胞吞噬與殺傷實驗:FITC標記的M.smegmatis以MOI 5分別與巨噬細胞共孵育1、2和4h,棄培養上清,PBS洗去胞外未吞噬菌株。每孔加入200μl 0.25%胰酶37℃消化5min,加入500μl DMEM完全培養基中和胰酶,吹散至單個細胞懸液。轉移至流式檢測管,室溫300×g離心5min、PBS洗滌,甲醛固定后進行流式細胞術分析。M.smegmatis以MOI 5與巨噬細胞共孵育進行體外感染,感染24h、48h和72h后PBS洗去胞外未吞噬菌株。每孔加入500μl 0.05% SDS裂解液,吹打混勻,裂解細胞1min。10倍倍比稀釋裂解液,分別取10-2、10-3和10-4稀釋液50μl均勻涂布于中性羅氏培養管,37℃培養并計算菌落數。
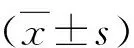
結 果
1.鐵過載小鼠肺組織TfR1未見明顯增加:如圖1A所示,不同劑量鐵過載小鼠肺部切片免疫組織化學分析發現,TfR1在低劑量、中劑量和高劑量鐵劑小鼠肺組織中表達水平未見顯著升高,與陰性對照小鼠肺組織比較無明顯變化。進一步通過蛋白質免疫印跡技術對不同劑量鐵過載小鼠肺組織研磨液上清中TfR1表達豐度進行分析,結果同樣發現低劑量、中劑量和高劑量鐵劑小鼠肺組織TfR1表達水平與陰性對照小鼠差異無統計學意義(P均>0.05,圖1C)。

圖1 鐵過載小鼠肺組織TfR1表達豐度檢測A.不同劑量鐵過載小鼠肺組織TfR1免疫組化分析(×20)。其中a為陰性對照組,b為低劑量組,c為中劑量組,d為高劑量組;B.不同劑量鐵過載小鼠肺組織研磨液上清TfR1免疫印跡檢測;C.不同劑量鐵過載小鼠肺組織研磨液上清TfR1免疫印跡檢測吸光度積分定量分析
2.M.tb感染增加小鼠肺組織TfR1表達:與正常對照小鼠和鐵過載模型小鼠比較,M.tb感染后小鼠肺組織TfR1表達水平均有所增加(圖2A),且在鐵過載M.tb感染小鼠中增加最為顯著(圖2A)。同時,不同組別小鼠肺組織研磨液上清中TfR1蛋白質免疫印跡顯示,表達豐度由高至低依次為鐵過載M.tb感染小鼠、M.tb感染小鼠、鐵過載模型小鼠及正常對照小鼠,且前兩者肺組織TfR1表達豐度顯著高于后兩者,且差異有統計學意義(P均 < 0.05,圖2B)。進一步提取各組小鼠肺組織總RNA并進行TfR1基因qPCR驗證,顯示鐵過載M.tb感染小鼠和M.tb感染小鼠肺組織TfR1在基因表達水平上也顯著高于鐵過載模型小鼠及正常對照小鼠(P均<0.05,圖2C)。

圖2 M.tb感染小鼠肺組織TfR1表達豐度檢測A.不同實驗組小鼠H37Rv感染后肺組織TfR1免疫組化分析(×20)。其中a為鐵過載M.tb感染組,b為M.tb感染組,c為鐵過載模型組,d為正常對照組;B.不同實驗組小鼠H37Rv感染后肺組織TfR1免疫印跡檢測及吸光度積分定量分析;C.不同實驗組小鼠H37Rv感染后肺組織TfR1基因qPCR檢測;與鐵過載模型組比較,*P<0.05,**P<0.001;與正常對照組比較,#P<0.05,##P<0.001;箭頭指示為TfR1免疫組化陽性反應
3.TfR1缺失對巨噬細胞吞噬功能無影響:siRNA技術構建TfR1-/-RAW 264.7巨噬細胞系,以FITC標記的M.smegmatis進行吞噬實驗。流式細胞術檢測結果顯示(圖3),TfR1基因缺失對RAW 264.7巨噬細胞吞噬功能無顯著性影響。FITC-M.smegmatis以MOI 5與RAW 264.7巨噬細胞共孵育1h、2h和4h后,TfR1-/-與TfR1+/+RAW 264.7巨噬細胞吞噬熒光菌株數量組間差異無統計學意義(圖3A)。共孵育2h時,TfR1-/-和TfR1+/+RAW 264.7巨噬細胞吞噬FITC-M.smegmatis的細胞占比分別為38.9%和37.8%,空白對照組為0.79%(圖3B)。

圖3 下調TfR1表達對RAW 264.7巨噬細胞吞噬功能的影響A.a至c依次為TfR1-/-與TfR1+/+RAW264.7巨噬細胞與FITC-M.smegmatis共孵育1、2和4h后,吞噬細胞流式計數結果;B.a至b依次為FITC-M.smegmatis與TfR1-/-及TfR1+/+ RAW264.7巨噬細胞共孵育2h后含熒光菌株的細胞占比,c為陰性對照
4.TfR1缺失增強巨噬細胞的殺傷功能:siRNA技術構建TfR1-/-RAW264.7巨噬細胞系,M.smegmatis分別感染TfR1-/-和TfR1+/+RAW 264.7巨噬細胞進行殺傷功能分析。感染后24h、48h和72h,TfR1-/-RAW 264.7巨噬細胞殺傷功能明顯優于TfR1+/+RAW 264.7巨噬細胞,不同殺傷時間點其殘余的M.smegmatis活菌數顯著低于后者,且差異有統計學意義(P均<0.05,圖4)。

圖4 下調TfR1表達對RAW264.7巨噬細胞殺傷功能的影響從左至右依次為TfR1+/+與TfR1-/-RAW264.7巨噬細胞分別感染M.smegmatis 24、48和72h后殘余活菌菌落計數結果
討 論
細菌致病期間需要鐵,尤其是胞內病原菌。體內外實驗表明,鐵元素缺失會嚴重降低熱柯克斯體、嗜肺軍團菌、鼠傷寒沙門菌及其他胞內菌的致病性[12]。事實上很多物種也采用在感染期間以扣留游離鐵作為主要的防御策略[13]。鐵與Tf和鐵蛋白(ferritin,Fn)這類轉運和儲存蛋白相結合不僅解決了可溶性問題,而且限制了入侵病原菌對鐵元素的利用。然而,M.tb在長期的進化過程中形成了一套特殊的鐵攝取系統來完成自身對鐵元素的需求。當機體感染了M.tb以后,一方面,M.tb為了自身的生存需要從被感染的宿主獲得一定量的鐵元素,以保證其在宿主巨噬細胞內的生存和繁殖。另一方面,其通過產生炎性細胞因子影響鐵反應元件(iron responsive element,IRE) 和鐵調節蛋白(iron regulatory protein,IRP) 的結合活性,進而在轉錄后水平調控TfR1的表達,促使細胞增加對鐵的攝取從而滿足其胞內活性和生存所需鐵元素(圖5)。

圖5 M.tb感染對巨噬細胞鐵代謝及TfR1表達的影響鐵元素經TfR1吸收進入巨噬細胞,多余鐵元素一方面以Fn形式儲存或經FPN1泵出細胞外,另一方面滿足胞內M.tb生長繁殖。同時,M.tb感染后產生炎性細胞因子影響IRE和IRP的結合活性,從而在轉錄后水平調控TfR1的表達。TfR1.轉鐵蛋白受體1;Tf.轉鐵蛋白,Fe3+.三價鐵離子;Fe2+.二價鐵離子;Steap3.金屬還原酶家族STEAP;Fn.鐵蛋白;TRPML1.瞬時受體電位通道;DMT1.二價金屬離子轉運蛋白;IRE.鐵反應元件;IRP.鐵調節蛋白;FPN1.膜鐵轉運蛋白1;Cp.銅藍蛋白;M.tb.結核分枝桿菌;mRNA.信使RNA
正常細胞鐵代謝過程中,位于細胞膜的TfR1可以識別Tf,將Tf-Fe3+復合物轉運入細胞內,Fe3+被Steap3還原成Fe2+,再由二價金屬離子轉運蛋白(divalent metal transporter 1,DMT1)和瞬時受體電位通道(transient receptor potential channels,TRPML1)運送到細胞內鐵池供細胞利用。鐵池中一部分鐵被氧化為Fe3+由Fn儲存于細胞內,剩余的鐵被膜鐵轉運蛋白(ferroportin 1,FPN1)泵出細胞外,維持細胞內鐵的穩態。細胞膜上TfR1的表達受細胞內鐵水平的影響和調節,當細胞內鐵缺乏時,TfR1 mRNA的穩定性增加,使TfR1表達增加,從而增加細胞對鐵的攝取[14,15]。因此,TfR1水平反映了機體和細胞對鐵的需求[16~18]。
筆者團隊前期在鐵過載小鼠模型的研究中發現,不同劑量鐵劑構建的鐵過載模型小鼠與正常對照小鼠中外周血可溶性TfR均未見明顯改變,而本研究也同樣發現該兩組小鼠肺組織TfR1表達也均未見明顯增強[2]。相反,M.tb感染后該兩組小鼠肺組織TfR1表達豐度均顯著上調,且鐵過載M.tb感染小鼠TfR1表達豐度顯著高于M.tb感染小鼠組,這表明,M.tb感染導致小鼠肺部細胞上調表達TfR1以促進宿主細胞對鐵的吸收,從而滿足M.tb胞內生長繁殖所需鐵元素,抑制TfR1表達則可能影響細菌在細胞內的生長與生存。而這些研究結果與有關文獻報道分枝桿菌和埃立克體這類胞內病原菌主動招募TfR1至含菌囊泡影響宿主細胞內鐵池的動態和存儲相一致[19,20]。
為了進一步明確TfR1在M.tb感染期間的作用,筆者團隊在細胞水平上進行了相關實驗。用小干擾RNA下調RAW264.7巨噬細胞TfR1的表達,進而用FITC-M.smegmatis分別感染TfR1表達下調細胞和未轉染正常細胞,并進行FITC熒光菌株吞噬計數。結果顯示,在分別感染1、2和4h后,TfR1表達下調的細胞內熒光細菌數與未轉染正常細胞差異無統計學意義。但殺傷實驗中,M.smegmatis分別感染24、48和72h后,TfR1下調樣本中殘留活菌數明顯低于未轉染正常細胞。這些結果說明在感染早期TfR1參與了M.tb的侵染,這可能與M.tb獲取鐵以利其在胞內生存有關,TfR1的下調不影響M.tb的入侵,但抑制細菌其在細胞內的生長與增殖。
依賴于TfR1的鐵攝取對于機體而言是必需的,TfR1基因敲除純合子小鼠在胚胎期即死亡[21]。因此,本研究針對TfR1僅進行了細胞水平的初步探討,而為了進一步驗證TfR1的下調表達是否降低M.tb感染宿主鐵水平,從而抑制體內M.tb生長這一假設,則應該構建TfR1基因敲除雜合子小鼠TfR1-/+,從動物水平上評價TfR1在M.tb感染期間的作用。通過體內實驗證實TfR1下調導致機體鐵攝取障礙,從而抑制體內M.tb增殖的分子機制,為TfR1作為抗結核感染新靶點提供實驗依據。

