潰瘍性結腸炎PCNA、EGFR、MUC2表達水平及臨床意義
賀 濤 王 偉 李 蕾 邱世琳 孫善明 宗 蕾
潰瘍性結腸炎(ulcerative colitis,UC)屬慢性非特異性腸道炎癥性疾病, 多從直腸開始向近端發展,臨床主要表現為腹瀉、腹痛及黏液膿便血等,病程較長,易反復發作,難以徹底治愈,嚴重影響其生活質量。近年來,UC的發生率呈逐漸上升趨勢[1]。目前關于該病的病因和發病機制仍不清楚,但有研究表明,遺傳、環境、腸道菌群失調和免疫介導的黏膜屏障損傷參與該病的發病過程[2,3]。因此,進一步探索其發病機制、監測其病情變化,以進一步為臨床提供更優的診療方案顯得極其重要。本研究通過檢測UC腸黏膜組織中黏液基因蛋白2(mucin2,MUC2)、表皮生長因子受體(epidermal growth factor receptor,EGFR)、增殖細胞核抗原(proliferating cell nuclear antigen, PCNA)的表達水平,分析其表達與病情嚴重程度及Mayo內鏡評分的相關性,為UC病情嚴重程度監測、臨床診療提供有力證據。
對象與方法
1.研究對象:收集濰坊市人民醫院2017年6月~2020年10月進行結腸鏡檢查的UC患者54例, 男性27例, 女性27例,患者平均年齡48.28±16.04歲。依照改良 Truelove 和Witts 疾病嚴重程度分型,輕度13例,中度32例,重度9例[4];內鏡下黏膜嚴重程度依照Mayo內鏡評分,0分6例,1分14例,2分23例,3分11例[5]。同時選取10例健康對照組作為對照組,其中男性10例,女性10例,平均年齡49.71±12.04歲,各組性別及年齡比較差異無統計學意義。
2.納入與排除標準:入組標準: (1) UC的診斷標準符合《炎癥性腸病診斷與治療的共識意見(2018年,北京)》[6]。(2)各項檢查資料完整。(3)患者及患者家屬均簽署知情同意書。(4)對照組無其他疾病。排除標準:(1)有嚴重并發癥,如腸梗阻;局部狹窄、腸穿孔、中毒性巨結腸。(2)有癌變可能者。(3)合并有神經、循環、呼吸、內分泌、血液系統等嚴重的原發性疾病者。(4)合并有系統性紅斑狼瘡、硬皮病、類風濕關節炎等自身免疫性疾病者。(5)哺乳或妊娠期女性。
3.主要的試劑及器材:EGFR(表皮生長因子受體)抗體試劑、MUC2(黏蛋白2)抗體試劑、PCNA(增殖細胞核抗原)抗體試劑、免疫顯色試劑均購自廣州安必平科技股份有限公司。切片機(LEICA:RM2235)、組織包埋冷凍機(BM450A型)購自常州派斯杰設備有限公司。病理組織漂烘儀(PH60)購自常州派斯杰設備有限公司
4.免疫組化檢測EGFR、PCNA、MUC2表達:UC組和正常對照組的結腸黏膜組織標本經10%的甲醛溶液固定后,脫水、透明、石蠟包埋,3μm厚連續切片,HE染色證實組織結構及病變程度。嚴格按操作說明進行免疫組化染色:常規脫蠟脫水,過氧化氫孵育10min清除內源性過氧化物酶,高溫、高壓枸櫞酸鹽行抗原修復,滴加一抗,37℃孵育70min,滴加二抗,37℃孵育60min,DAB顯色,蘇木精復染,二甲苯透明,中性樹膠封片。PBS代替一抗作為陰性對照。染色成功后所有切片均在同一條件下進行光學顯微鏡檢查。采用Image-pro plus 6.0圖像分析軟件,分析測定積分吸光度(A)值,以其平均值代表蛋白表達水平。
5.觀察指標:比較UC組和對照組EGFR、MUC2及PCNA表達水平。比較UC組中不同疾病嚴重程度及MSE患者的EGFR、MUC2及PCNA表達水平差異。分析不同疾病嚴重程度以及MSE與患者的EGFR、MUC2及PCNA表達水平的相關性。
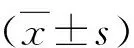
結 果
1.UC組與對照組各指標水平的比較:免疫組化結果顯示,EGFR、MUC2、PCNA在UC組和對照組結腸黏膜組織中均有表達(圖1),EGFR主要表達在胞質及胞膜,MUC2主要表達在胞質,PCNA主要表達在細胞核。UC組的EGFR、MUC2表達水平低于對照組,而PCNA表達水平高于對照組,差異有統計學意義(P<0.05,表1)。
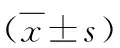
表1 正常對照組及UC組結腸黏膜組織中EGFR、MUC2、PCNA蛋白表達的比較

圖1 EGFR、MUC2、PCNA 在正常腸黏膜和病變黏膜中的表達(免疫組化,×200)A.EGFR在UC黏膜的陽性表達;B.EGFR在正常黏膜的陽性表達;C.MUC2在UC黏膜的陽性表達;D.MUC2在正常黏膜的陽性表達;E.PCNA在UC黏膜的陽性表達;F.PCNA在正常黏膜陽性表達。與對照組比較,*P<0.05
2.不同疾病嚴重程度UC患者各指標水平的比較:輕度、中度及重度患者的EGFR、MUC2表達水平比較,差異有統計學意義(P<0.05),隨著病情加重,患者的MUC2、PCNA水平下降,EGFR表達升高,差異有統計學意義(P<0.001,表2)。
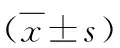
表2 不同疾病嚴重程度UC患者黏膜組織中EGFR、MUC2、PCNA表達水平的比較
3.不同Mayo內鏡評分UC患者各指標的比較:不同MSE患者的EGFR、MUC2、PCNA表達水平比較,差異有統計學意義(P<0.001)。隨著MSE分值升高,MUC2、PCNA水平下降,EGFR表達升高,差異有統計學意義(P<0.001,表3)。
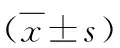
表3 不同MSE UC患者黏膜組織中EGFR、MUC2、PCNA表達水平的比較
4.EGFR、MUC2、PCNA表達水平與臨床病情嚴重程度的相關性:UC患者黏膜組織中的EGFR(r=-0.273,P=0.046)、MUC2(r=0.437,P=0.001)表達水平與臨床病情嚴重程度呈負相關;PCNA表達水平與臨床病情嚴重程度呈正相關(r=0.641,P<0.001)。
5.UC患者黏膜組織中EGFR、MUC2表達水平與PCNA表達水平的相關性:UC患者黏膜組織中EGFR(r=-0.365,P=0.007)、MUC2(r=-0.315,P=0.020)表達水平與PCNA呈負相關。
討 論
潰瘍性結腸炎屬于炎癥性腸病,目前病因仍不清楚,其中,免疫因素是導致UC產生的關鍵,因此對該病發病機制的研究顯得尤為重要[7,8]。本研究通過對筆者醫院55例UC患者結腸黏膜組織中的PCNA、EGFR、MUC2的表達情況進行檢測,分析其與臨床及內鏡疾病病情嚴重程度的相關性,探索PCNA、EGFR、MUC2表達對UC進展的影響,以期為臨床上更好地治療UC提供參考。
正常生理狀況下,MUC2有維持腸道黏膜上皮完整性、潤滑和保護腸道黏膜的作用[9]。腸組織MUC2蛋白產物的下降提示腸黏膜防御能力降低[10]。Ozaki等[11]研究發現UC患者腸道上皮MUC2表達下降是疾病復發的獨立危險因素。此外,MUC2黏蛋白缺陷小鼠會出現腸上皮細胞形態的異常和潰瘍產生,出現結腸炎的表現,而MUC2表達水平的恢復和黏液層的形成可以改善結腸炎癥狀[12~14]。EGFR信號通路作為人體中的關鍵信號通路,介導細胞的凋亡和增殖,與結腸黏膜損傷的發生有關,因此,干預EGFR信號通路為治療UC提供了可能[15,16]。有研究顯示潰瘍性結腸炎腸黏膜受損會影響EGFR表達,進而減少對結腸黏膜的保護及修復作用,并發現EGFR水平與UC復發密切相關[17,18]。
PCNA與細胞的生長增殖密切相關,可加快恢復結腸上皮屏障功能,減輕炎性細胞浸潤。研究表明PCNA在結腸炎癥組織中表達增加,提示其在結腸炎癥黏膜修復機制中起重要作用[19,20]。一旦腸杯狀細胞破壞導致MUC2的表達發生變化,腸黏膜將失去保護,致使黏膜屏障受損,通透性增高,進而使腸腔內的細菌、抗原、內毒素等有害物質進入黏膜固有層,誘發免疫反應,導致UC的加重[21]。UC異常的免疫反應將干擾EGFR蛋白/EGFR信號通路途徑,影響細胞的凋亡和增殖,進而導致結腸黏膜的損傷;而EGFR可阻止由氧化劑所導致的腸黏膜屏障結構損傷與功能障礙,從而促進組織的恢復,是腸黏膜的營養因子。PCNA在G1后期和S期表達明顯,是判斷結腸黏膜上皮增殖活性的一個可靠指標[22]。
臨床研究發現,PCNA在UC活動期比緩解期結腸組織表達更高,揭示UC炎性反應將促使黏膜上皮細胞增殖,從而促進結腸黏膜損傷的修復[23]。在UC發病過程中,MUC2、EGFR的表達水平顯著降低,直接提示黏膜屏障受損,腸腔自身保護能力下降,從而導致或加重UC的發生;PCNA的表達水平升高,提示腸道黏膜細胞處于增殖活躍狀態,有利于黏膜修復。本研究結果發現,UC組黏膜組織MUC2、EGFR表達較對照組下降,PCNA表達較對照組上升,提示UC通過造成EGFR、MUC2、PCNA異常表達進而影響腸黏膜屏障功能,最終導致疾病的產生或加重。
本研究發現EGFR、MUC2表達水平與PCNA表達呈負相關,表明EGFR、MUC2有助于結腸上皮增殖及黏膜修復。隨著疾病活動度的增加,MUC2、EGFR表達下降,PCNA表達升高,相關性分析表明EGFR、MUC2、PCNA與MSE均具有相關性。MSE越高,EGFR、MUC2表達水平越低,而PCNA表達越高,提示在UC患者病程嚴重程度增加,腸黏膜杯狀細胞減少,黏蛋白的表達降低,黏膜通透性增高,不能有效清除腸黏膜表面細菌,對腸黏膜產生損傷,容易誘發和加劇腸道炎性反應,也可作為評價病情嚴重程度及黏膜愈合的指標。
綜上所述,EGFR、MUC2、PCNA在UC發病中可能具有重要作用,同時可作為評價疾病嚴重程度、判斷黏膜內鏡愈合程度的重要指標。但其在發病中具體的作用機制以及是否可作為黏膜愈合甚至組織學愈合的指標,仍需擴大樣本量及后續開展深入研究予以進一步證實。

