Se-Ca聯合膳食干預緩解Cd誘導小鼠肝腎毒性
吳楊洋,彭祥雯,史可欣,匡雯潔,孫 宏,黃 蕾*
Se-Ca聯合膳食干預緩解Cd誘導小鼠肝腎毒性
吳楊洋1,彭祥雯1,史可欣1,匡雯潔1,孫 宏2,黃 蕾1*
(1.南京大學環境學院,污染控制與資源化研究國家重點實驗室, 江蘇 南京 210023;2.江蘇省疾病預防控制中心,江蘇 南京 210023)
為探究Se-Ca聯合膳食干預對生物Cd中毒的緩解效果,選取88只BALB/c 小鼠,隨機劃分為19組,在相同飼料Cd暴露濃度下(2mg/kg)分別設置低、中、高濃度的Se和Ca單獨和聯合膳食干預處理,并觀察30d后小鼠的生長發育、肝腎功能、氧化應激狀態和組織病理變化.結果顯示,Se-Ca聯合干預可有效緩解Cd蓄積所致小鼠生長發育遲緩現象,且進一步促進小鼠生長;肝腎功能及氧化應激指標測定結果表明,Se-Ca聯合干預對Cd暴露下小鼠肝臟AST、GSH、SOD、GSH-Px和腎臟BUN、MDA、SOD的保護效果優于單一元素干預;聯合干預僅需較小劑量即可達到單獨Se或Ca干預對肝腎病理損傷的最佳緩解效果.Se-Ca聯合膳食干預可有效緩解Cd攝入導致的生長發育緩慢和肝腎毒性,且較之單一元素的干預效果更佳.
鎘;膳食硒鈣補充;膳食干預;肝腎損傷
鎘(Cd)是當下我國農業土壤的主要重金屬污染物[1-2],它可通過膳食攝入蓄積于人體肝臟、腎臟,導致肝毒性、腎毒性[3].環境中存在的低劑量Cd同樣會引發人和動物組織氧化損傷、誘發細胞凋亡,威脅臟器健康[4-6],并與人體心腦血管疾病[7]、腫瘤[8]等惡性疾病密切相關.
已有研究通過添加礦物質營養元素緩解Cd致生物毒性[9-10].在Cd暴露條件下,小鼠分別攝入Se(0.1mg/kg體重)、Ca(2540~4710mg/kg體重)可顯著緩解Cd誘導的氧化應激反應及肝腎損傷[10],減少胃腸道中約50%的Cd吸收[9].硒(Se)作為人體必須微量元素和常量元素鈣(Ca)在生物體內與Cd產生拮抗作用,抑制氧化應激、降低Cd吸收效率,可有效減輕Cd對生物體的健康損害.
但此前研究僅關注Se/Ca單獨干預的緩解效果,鮮有關注二者聯合干預降低Cd蓄積所致肝腎毒性的相關研究.本文通過小鼠動物實驗分別檢測多濃度梯度Se-Ca聯合膳食干預與單獨Se/Ca干預對相同Cd暴露環境下小鼠生長發育、肝腎功能和氧化應激的干預效果并進行組織病理學觀察,旨在評估Se-Ca聯合飲食干預的有效性及最佳干預方案,為多元素膳食干預緩解Cd的生理毒性研究提供新思路.
1 材料與方法
1.1 實驗動物
SPF級6周齡健康Balb/C小鼠購自青龍山實驗動物養殖場(中國南京).在標準動物房條件下(12:12h光照/黑暗循環,25℃和50%濕度)適應性飼養一周,隨后進行實驗.
1.2 實驗分組與處理方案
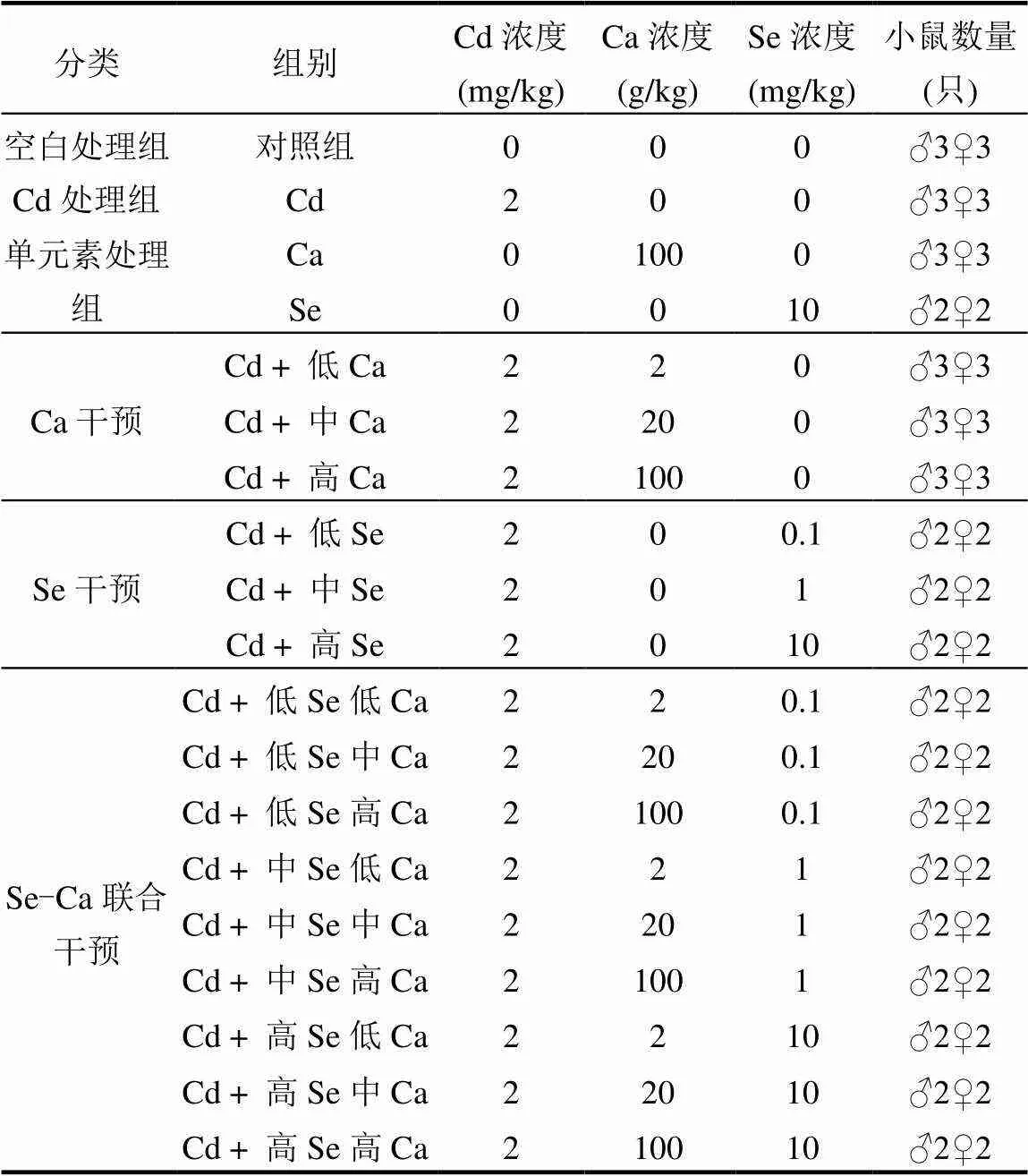
表1 實驗分組及處理方案
注: ♂代表雄性小鼠,♀代表雄性小鼠.
將88只雌雄各半小鼠隨機分為19組,平均體重 [SD] (17.2 ± 2.0)g.綜合考慮預實驗結果及《食品安全國家標準食品中污染物限量》[11][GB2762-2017],確定小鼠攝入Cd水平為2mg/kg飼料.預實驗結果表明,該劑量會導致小鼠30d內產生肝臟及腎臟毒性.考慮小鼠飼料的適口性及相關標準[12],Se、Ca分別設置低、中、高濃度梯度的膳食干預:Se(0.1,1, 10mg/kg飼料),Ca(2,20,100g/kg飼料).共計設置Ca單獨干預 (3組)、Se單獨干預(3組)和Se-Ca聯合干預(9組) 3種干預方案,以探究Ca、Se單獨及聯合干預最佳劑量組合,具體實驗分組及處理方案如表1所示.Cd、Ca和Se分別以CdCl2(分析純)、CaCO3(分析純)和硒代蛋氨酸(C5H11NO2Se)的形式添加到特制的鼠飼料中.以上試劑分別購于南京晚晴化玻儀器有限公司和博美生物科技有限責任公司.
30d干預期內,早上9:00喂食小鼠約4g特制飼料并記錄小鼠體重,實驗過程中沒有小鼠死亡.干預結束后,禁食12h,頸椎脫臼法處死小鼠.
1.3 樣品制備
頸椎脫臼法處死小鼠,眼眶取血,血液常溫靜置2h,3500r/min離心30min,收集血清保存于-80℃恒溫冰箱.迅速分離小鼠肝臟和腎臟,臟器左部固定于4%多聚甲醛(POM,南京森貝伽生物)溶液,制備常規病理組織石蠟切片用于組織病理學觀察;臟器右部分按1:9重量(g)/體積(mL)加入生理鹽水,并置于冰水浴中,漩渦混勻器混勻制得組織勻漿,2500r/min離心10min,取上清液,-20℃保存以檢測臟器功能和氧化應激指標.
1.4 測定指標與方法
1.4.1 臟器功能指標檢測 分別使用谷丙轉氨酶試劑盒(C009-2-1)、谷草轉氨酶試劑盒(C010-1-1)測定血清谷丙轉氨酶(ALT)、谷草轉氨酶(AST)活性以表征肝臟功能.分別使用尿素氮試劑盒(C013- 2-1)、肌酐試劑盒(C011-1-1)測定血清尿素氮(BUN)、肌酐(Cr)含量.
1.4.2 氧化應激相關指標檢測 分別使用MDA檢測試劑盒(A003-1-2)、GSH檢測試劑盒(A006-1-1)、SOD檢測試劑盒(A001-3-2)、GSH-Px檢測試劑盒(A005-1-1)和CAT檢測試劑盒(A007-1-1)測定肝臟、腎臟丙二醛(MDA)和谷胱甘肽(GSH)含量,及超氧化物歧化酶(SOD)、谷胱甘肽過氧化物酶(GSH-Px)和過氧化氫酶(CAT)活性.以上試劑均購于南京建成生物有限公司.
1.4.3 組織病理學觀察 肝臟、腎臟石蠟切片進行蘇木素-伊紅(HE)染色.在光學顯微鏡下(200×)觀察組織病理學結構變化并拍照,根據觀察結果,將小鼠臟器病變程度由輕到重分別記為0~4分(正常0分,輕微0.5分,輕度1分,中度2分,重度3分,非常嚴重4分).
1.5 統計學分析
實驗數據以平均值±標準差(Mean ± SD)表示,依據表1組別編號,進行One-Way ANOVA、LSD事后檢驗并進行組間比較.數據統計分析基于SPSS 22.0軟件,并利用Origin 2018軟件作圖.當<0.05時認為具有統計學上的顯著性差異.
2 結果與分析
2.1 膳食干預對小鼠體重影響
由圖1可見, Ca、Se單獨及聯合干預均促進小鼠體重增長,Cd暴露則起抑制作用.其中,Ca單獨干預對小鼠生長發育的促進作用呈劑量依賴關系,高Ca促進小鼠體重增長幅度最大(<0.001, (5.96±1.31)g). Se單獨干預、Se-Ca聯合干預未見劑量依賴關系.中Se干預下小鼠體重增量呈極顯著升高(<0.001),中Se低Ca組干預效果最佳(<0.001).對比單獨Ca、單獨Se和Se-Ca聯合干預中各組最佳劑量的干預效果表明,高Ca組對小鼠體重干預效果最佳,但3組之間未呈現統計學差異(>0.05).

圖1 各組小鼠體重變化比較
與對照組相比, *< 0.05, **< 0.01, ***< 0.001; 與Cd組相比,#< 0.05,##< 0.01,###< 0.001
2.2 小鼠肝腎功能檢測
肝(ALT、AST)、腎(BUN、Cr)功能指標顯示,Cd組暴露引起肝、腎功能障礙,小鼠血清ALT和AST活性,以及BUN和Cr含量均極顯著高于對照組(<0.001).由圖2可見,Se、Ca單獨及聯合干預均可有效降低小鼠血清ALT和AST活性、BUN和Cr含量 (BUN<0.05,其他<0.001),高Se高Ca膳食干預對抑制Cd誘導ALT、AST和BUN升高現象的緩解作用最好,高Se干預對Cd誘導Cr升高的緩解效果最佳.
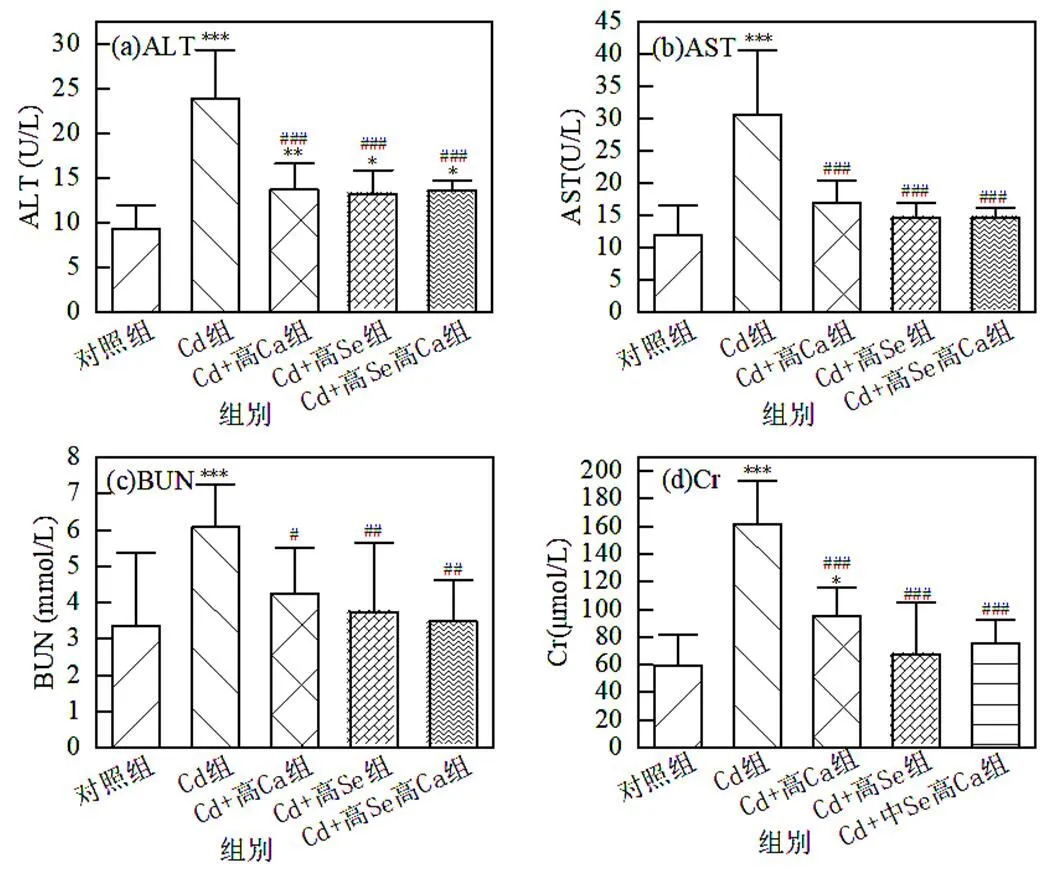
圖2 各組血清中ALT和AST活力及BUN和Cr含量結果
與對照組相比, *< 0.05, **< 0.01, ***< 0.001;與Cd組相比,#< 0.05,##< 0.01,###< 0.001
2.3 臟器氧化應激指標測定結果

圖3 各組小鼠肝臟SOD(a)、GSH-Px(b)和CAT(c)活性及MDA(d)和GSH(e)含量
與對照組相比, *< 0.05, **< 0.01, ***< 0.001; 與Cd組相比,#< 0.05,##< 0.01,###< 0.001

圖4 各組小鼠腎臟SOD(a)、GSH-Px(b)和CAT(c)的活性以及MDA(d)和GSH(e)的含量
與對照組相比, *< 0.05, **< 0.01, ***< 0.001; 與Cd組相比, #< 0.05,##< 0.01,###< 0.001
與對照組相比,Cd組小鼠肝臟及腎臟SOD、GSH-Px和CAT活性均顯著降低(SOD<0.01,其他<0.001),GSH含量顯著減少(<0.001),同時氧化應激產物MDA含量顯著升高(<0.001)(圖3,圖4).肝腎氧化應激指標測定結果表明,Se、Ca單獨及聯合干預可有效緩解Cd誘發的氧化應激反應,使之趨向于正常水平.肝臟氧化應激指標表明,高Se高Ca聯合干預對維持肝臟SOD、GSH-Px活性和GSH含量的保護作用最強,高Se干預對MDA的抑制效果最強,高Ca干預對Cd誘發的CAT活性降低現象緩解效果最好;對于腎臟,高Se高Ca組對提高SOD活性和抑制MDA含量的干預效果最強,高Se干預可增強腎臟GSH和CAT活性,高Ca干預對GSH-Px保護效果最佳.
2.4 臟器病理損傷評估
如圖5所示, Cd組肝臟切片可見明顯的肝竇淤血和炎細胞浸潤癥狀,而經高Ca、高Se及中Se中Ca干預后的小鼠肝臟切片肝竇淤血明顯減少,且無炎細胞浸潤癥狀,表明Se、Ca單獨及聯合干預均可部分緩解Cd引起的肝臟炎癥和病理損傷.如圖6所示, Cd組小鼠腎臟切片可見明顯的透明管型和炎細胞浸潤癥狀.經高Ca、高Se和中Se高Ca聯合干預后,小鼠腎臟切片透明管型和炎細胞浸潤均減少,可見Se、Ca單獨及聯合干預同樣均可部分緩解Cd引起的腎臟炎癥和病理損傷.其中,高Ca組和高Se組腎臟切片炎細胞浸潤癥狀完全消失.
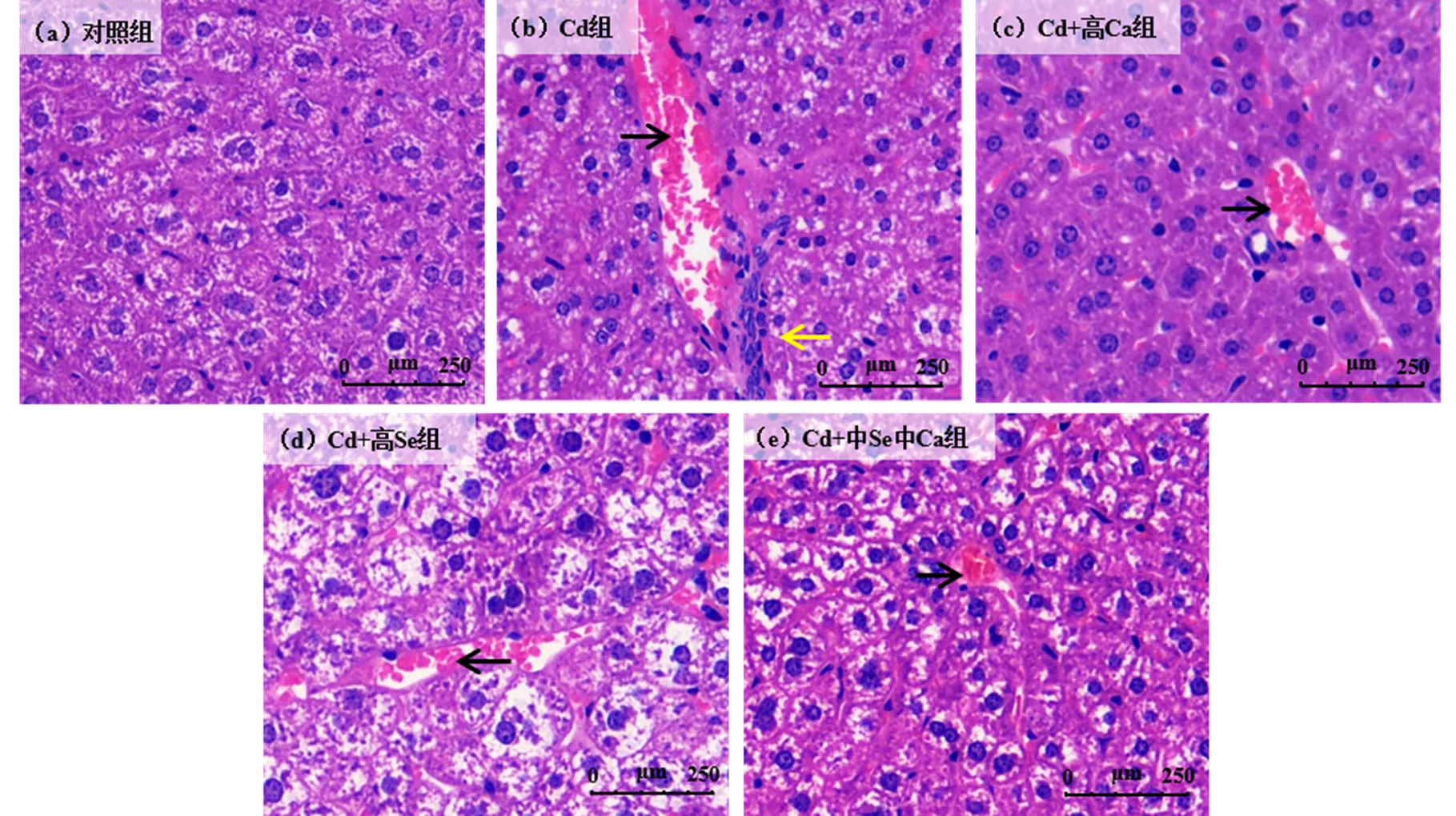
圖5 各組小鼠肝臟病理切片
光學顯微鏡觀察(200′),黃色箭頭表示炎細胞浸潤,黑色箭頭表示肝竇淤血

圖6 各組小鼠腎臟病理切片
光學顯微鏡觀察(200′),黃色箭頭表示炎細胞浸潤,黑色箭頭表示透明管型
病理評估結果顯示(圖7),Cd組肝臟、腎臟病理評分均顯著高于對照組(<0.001).中Se中Ca劑量干預顯著降低小鼠肝臟病理評分(<0.01),對Cd誘導小鼠肝臟病理性損傷的緩解作用最好;中Se高Ca劑量干預顯著降低小鼠腎臟病理評分(<0.001),對Cd暴露下小鼠腎臟組織結構的保護效果最佳.

圖7 各組小鼠肝臟和腎臟病理得分
與對照組相比, *< 0.05, **< 0.01, ***< 0.001; 與Cd組相比,#< 0.05,##< 0.01,###< 0.001
3 討論
Cd暴露顯著抑制小鼠體重增長,而不同濃度梯度Ca、Se單獨及聯合干預均促進小鼠體重增長,故適量攝入Se、Ca有助于降低Cd對生物生長發育的不利影響.其中,單獨干預效果與此前Su等[13]研究結果一致,食用富硒大米+Cd的小鼠60d后體重顯著高于Cd組,且高于對照組.不同干預下小鼠體重并未呈現顯著差異,Se-Ca聯合干預在促進小鼠生長方面并未優于單一元素干預.血液中ALT、AST與血清中BUN和Cr水平分別是臨床診斷中評價肝功能、腎小球濾過功能的重要指標,后者常用于急性腎損傷綜合征診斷.Cd組中上述指標均極顯著高于對照組,這與先前研究結果一致[14-15],表明Cd暴露導致肝、腎功能障礙.研究結果表明,經Se、Ca單獨及聯合膳食干預,Cd暴露所致小鼠肝腎功能障礙得到有效緩解,并發現在高Se干預基礎上,添加適量Ca對小鼠肝腎功能的保護作用更強.結合此前研究,Ca和Se對肝腎功能的保護作用與它們對氧化應激狀態的調節作用有關[10,16].Cd在生物體內破壞正常氧化還原平衡狀態,增加活性氧(ROS),消耗細胞內GSH含量和抗氧化酶,增強脂質過氧化,致使脂質過氧化物MDA含量升高[10,17].本研究佐證上述結論,發現Cd組小鼠肝臟和腎臟SOD、GSH-Px和CAT等抗氧化酶活性均顯著降低,GSH含量顯著減少,MDA含量顯著升高,而Se/Ca單獨和聯合干預可使上述指標趨近于正常水平.Cd抑制抗氧化酶活性,削弱機體自由基清除能力,導致肝臟及腎臟氧化應激反應和脂質過氧化,而自由基和過氧化中間產物破壞肝腎細胞結構完整性和正常功能并進一步促使小鼠的肝腎功能受損[18-19].Se可通過激活抗氧化酶、減少脂質過氧化和再生谷胱甘肽保護肝臟和腎臟[17],Ca可通過與Cd競爭轉運蛋白、抑制Cd吸收產生保護作用[20].本研究發現,相比于Se或Ca單獨干預,高Se高Ca聯合干預對Cd致肝臟SOD、GSH-Px和GSH與腎臟SOD和MDA變化的拮抗作用最強,推測Se-Ca聯合干預緩解Cd致肝腎氧化應激反應及功能障礙的效果優于單一Se或Ca干預.
組織病理學檢查表明,Cd暴露導致肝腎發生明顯的病理變化,Se、Ca單獨及聯合干預均可部分緩解Cd致肝臟和腎臟病理損傷,但不能完全消除負面影響.病理評估結果顯示,中Se中Ca、中Se高Ca劑量干預對Cd誘導小鼠肝臟和腎臟病理性損傷的緩解作用較單一元素的干預效果更佳, Se-Ca聯合干預僅需較低劑量即可達到Se或Ca單獨干預對肝腎組織損傷的最佳保護效果.
4 結論
4.1 Se、Ca單獨干預對Cd暴露所致肝腎功能障礙、氧化應激反應和病理損傷的緩解作用呈劑量依賴關系.
4.2 高Se高Ca聯合干預對Cd暴露所致小鼠肝腎功能障礙和氧化應激的緩解效果優于單一元素干預.
4.3 較低劑量聯合膳食干預即可達到或超過高水平Se或Ca單獨干預對Cd致肝腎組織病理損傷的最優保護效果.
[1] Zhao F J, Ma Y, Zhu Y G, et al. Soil Contamination in China: Current Status and Mitigation Strategies [J]. Environmental Science & Technology, 2015,49(2):750-759.
[2] 環境保護部.全國土壤污染狀況調查公報 [EB/OL]. http://www.gov. cn/foot/2014-04/17/content_2661768.htm, 2014-04-17.
Ministry of environmental protection of the people’s Republic of China. The Report on the national general survey of soil contamination [EB/OL]. http://www.gov.cn/foot/2014-04/17/content_2661768.htm, 2014-04-17.
[3] 蔣玉艷,馬 寧,蒙浩洋,等.廣西居民重金屬鎘膳食攝入水平及其健康風險評估 [J]. 中國食品衛生雜志, 2021,33(2):191-195.
Jiang Y Y, Ma N, Meng H Y, et al. Risk assessment on the dietary exposure of cadmium in Guangxi residents [J]. Chinese Journal of Food Hygiene, 2021,33(2):191-195.
[4] Anetor J I. Rising environmental cadmium levels in developing countries: Threat to genome stability and health [J]. Journal of Environmental Analytical Toxicology, 2012,27(2):103-115.
[5] Rani A, Kumar A, Lal A, et al. Cellular mechanisms of cadmium-induced toxicity: a review [J]. International Journal of Environmental Health Research, 2014,24(4):378-399.
[6] Ognjanovi B I, Markovi S D, Pavlovi S Z, et al. Effect of chronic cadmium exposure on antioxidant defense system in some tissues of rats: protective effect of selenium [J]. Physiological Research, 2008, 57(3):403-411.
[7] Messner B, Bernhard D. Cadmium and cardiovascular diseases: cell biology, pathophysiology, and epidemiological relevance [J]. Biometals, 2010,23(5):811–822.
[8] Huff J, Lunn R M, Waalkes M P, et al. Cadmium-induced cancers in animals and in humans [J]. International Journal of Occupational & Environmental Health, 2007,13(2):202-212.
[9] Reeves P G, Chaney R L. Marginal nutritional status of zinc, iron, and calcium increases cadmium retention in the duodenum and other organs of rats fed rice-based diets [J]. Environmental Research, 2004, 96(3):311-322.
[10] El-Boshy M E, Risha E F, Abdelhamid F M, et al. Protective effects of selenium against cadmium induced hematological disturbances, immunosuppressive, oxidative stress and hepatorenal damage in rats [J]. Journal of Trace Elements in Medicine & Biology, 2015,29:104-110.
[11] GB 2762-2017 食品安全國家標準食品中污染物限量 [S].
GB 2762-2017 China food safety national standard for maximum levels of contaminants in foods [S].
[12] Su Y, Li L, Farooq M U, et al. Rescue effects of Se-enriched rice on physiological and biochemical characteristics in cadmium poisoning mice [J]. Environmental Science and Pollution Research, 2021,28(16): 20023-20033.
[13] Fang J, Yin H, Yang Z Z, et al. Vitamin E protects against cadmium-induced sub-chronic liver injury associated with the inhibition of oxidative stress and activation of Nrf2 pathway [J]. Ecotoxicology and Environmental Safety, 2021,208:111610.
[14] Ge J, Liu L, Cui Z, et al. Comparative study on protective effect of different selenium sources against cadmium-induced nephrotoxicity via regulating the transcriptions of selenoproteome [J]. Ecotoxicology and Environmental Safety, 2021,215:112135.
[15] Chen Z F, Shi K X, Kuang W J, et al. Exploration of the optimal strategy for dietary calcium intervention against the toxicity of liver and kidney induced by cadmium in mice: An in vivo diet intervention study [J]. PLoS One, 2021,16(5):e0250885.
[16] Wang Y, Wu Y, Luo K, et al. The protective effects of selenium on cadmium-induced oxidative stress and apoptosis via mitochondria pathway in mice kidney [J]. Food and Chemical Toxicology, 2013,58:61-67.
[17] Olisekodiaka M J, Igbeneghu C A, Onuegbu A J, et al. Total antioxidant status and organ changes in rats administered high doses of cadmium chloride [J]. Medical Principles and Practice, 2012,21(2):156–159.
[18] Prabu S M, Shagirtha K, Renugadevi J. Quercetin in combination with vitamins (C and E) improve oxidative stress and hepatic injury in cadmium intoxicated rats [J]. Biomedicine & Preventive Nutrition, 2011,1(1):1-7.
[19] Berglund M, Kesson A, Nermell B, et al. Intestinal absorption of dietary cadmium in women depends on body iron stores and fiber intake [J]. Environmental Health Perspectives, 1994,102(12):1058-1066.
Alleviating cadmium toxicity to liver and kidney of mice with dietary supplementation of selenium and calcium in combination.
WU Yang-yang1, PENG Xiang-wen1, SHI Ke-xin1, KUANG Wen-jie1, SUN Hong2, HUANG Lei1*
(1.State Key Laboratory of Pollution Control and Resource Reuse, School of Environment, Nanjing University, Nanjing 210023, China;2.Jiangsu Provincial Center for Disease Control and Prevention, Nanjing 210023, China)., 2022,42(3):1379~1384
To explore the mitigation role of dietary selenium (Se) and calcium (Ca) supplementation in combination in alleviating the biological toxicity of Cd, an in vivo mouse bioassay was performed. Mice (BALB/c,= 88) that were exposed to Cd via diets at the same concentration of 2mg/kg were randomly divided to 19groups of dietary supplementation of low, medium, and high concentrations of Se and Ca in diets alone or in combination. The growth and development of mice, liver and kidney function, oxidative stress state and histopathological changes of the mice were measured after 30days of intervention. Results showed that the combined intervention of Se-Ca could effectively alleviate the growth retardation of mice caused by Cd exposure. In terms of liver and kidney function and oxidative stress, the combined intervention had a stronger protective effect on AST, GSH, SOD, GSH-Px in the liver and BUN, MDA and SOD in the kidney of mice than single Se or Ca intervention. Additionally, a lower dietary concentration of Se and Ca in combination alleviated pathological damage at a similar extent to that of a high concentration of Se or Ca alone. In general, Se-Ca dietary intervention in combination effectively alleviated the growth retardation and liver and kidney toxicity of mice caused by Cd exposure, and the effect was stronger than that of single element intervention.
cadmium;dietary selenium and calcium supplement;dietary intervention;liver and kidney damage
X174
A
1000-6923(2022)03-1379-06
吳楊洋(1998-),男,江蘇鹽城人,南京大學環境學院博士研究生,主要從事環境健康風險評估研究.發表論文4篇.
2021-08-06
國家重點研發計劃項目(2019YFC1805105);江蘇省自然科學基金資助項目(BK20201186);國家自然科學基金資助項目(41822709, 71921003)
*責任作者, 教授, huanglei@nju.edu.cn

