心臟外科圍術期營養篩查與營養治療策略研究進展
陳明劍、陳亮綜述,王立清審校
營養不良是心臟外科患者術后不良預后的獨立危險因素[1],它與重癥監護病房(ICU)時間延長、機械通氣時間延長、并發癥和死亡率升高密切相關[2]。研究發現,在術前,心臟外科患者營養不良的發生率在10%~25%之間[3],而在術后,心臟外科患者普遍存在營養治療不足或者延遲營養支持現象[4]。營養治療是心臟外科患者圍手術期治療的重要措施[5]。國內外研究表明,積極的營養治療可以改善外科手術患者的營養狀態,促進術后恢復,縮短住院時間,減少術后并發癥和死亡率。因此,早期識別存在營養不良或營養不良風險的患者,并給予充足、合適的營養治療可能改善心臟外科患者的臨床預后。
1 心臟外科患者圍術期營養篩查
營養篩查的目的在于識別存在營養不良或者營養不良風險的患者,因為這類患者被認為最有可能從營養治療中獲益。由于疾病進展、手術創傷和體外循環帶來的嚴重炎癥反應以及術后不充分的營養支持,心臟外科患者的營養狀況波動很大,因此營養篩查必須貫穿整個圍術期。
1.1 術前營養篩查
術前營養篩查不僅可以發現存在營養不良或者營養風險的患者,還可以預測患者的臨床預后,這對指導術前營養治療有重要意義。但目前針對心臟外科患者采用何種營養篩查方法尚未明確。
國際指南推薦使用營養狀況評分系統對外科手術患者進行營養篩查[6-7],如營養篩查2002 評分(NRS2002)、微型營養評定簡表(MNA)、營養不良通用篩查工具(MUST)、簡短營養評估問卷(SNAQ)和主觀全面評估(SGA)等。這些都是臨床常用的營養篩查工具,以體重下降量或體重指數(BMI)為核心參數,在腫瘤外科得到廣泛的應用。Lomivorotov 等[8]評估了上述營養篩查工具在心臟外科患者中的效用,在一項隊列研究中SNAQ 和MUST 檢測營養不良或營養不良風險的敏感度很高,分別為91.5%、97.9%,而NRS2002 的敏感度僅有38.3%。進一步研究表明SNAQ、MUST 檢測到的營養不良與術后并發癥相關(OR 分別為 1.8、1.9),MUST 檢測到的營養不良還與ICU 時間≥2 d相關(OR=1.5)[9]。可見SNAQ 和MUST 可敏感地識別術前存在營養不良或營養風險的心臟外科患者,對術后并發癥、ICU 住院時間也有一定預測價值。在MUST 的基礎上,Van Venrooij 等[10-11]提出了心臟手術特異性營養不良通用篩查工具(CSSM)和心臟外科特定營養不良篩查工具(CSSUST),后者的敏感度可達90%,但作者未研究其與臨床預后的關系。有研究發現,以血清白蛋白、血淋巴細胞為重要參數的控制營養狀態評分(CONUT)[12]、老年人營養風險指數(GNRI)[13]以及預后營養指數(PNI)[14](表1、表2)對術后死亡率和并發癥具有較高預測價值。Cho 等[15]回顧性分析比較了1 927 例接受心臟瓣膜手術的患者術前CONUT、PNI 和GNRI 與術后1 年死亡率之間的關系,結果顯示高CONUT(≥4)、低PNI(<44.91)及低GNRI(<98.32)確定的營養不良或營養不良風險與術后1 年死亡率顯著相關(HR 分別為1.43、0.89、0.93),且隨著營養不良程度或營養不良風險增加,死亡率增加;多因素Cox 分析結果顯示三者都是術后1 年死亡率的獨立預測因子,但CONUT 具有最高預測能力,被認為是術前營養篩查的重要方法。Lee 等[16]也發現,當心臟外科患者的PNI ≤46.13時,機械通氣支持的中位持續時間與ICU 住院時間延長,術后早期死亡率和并發癥均顯著升高。
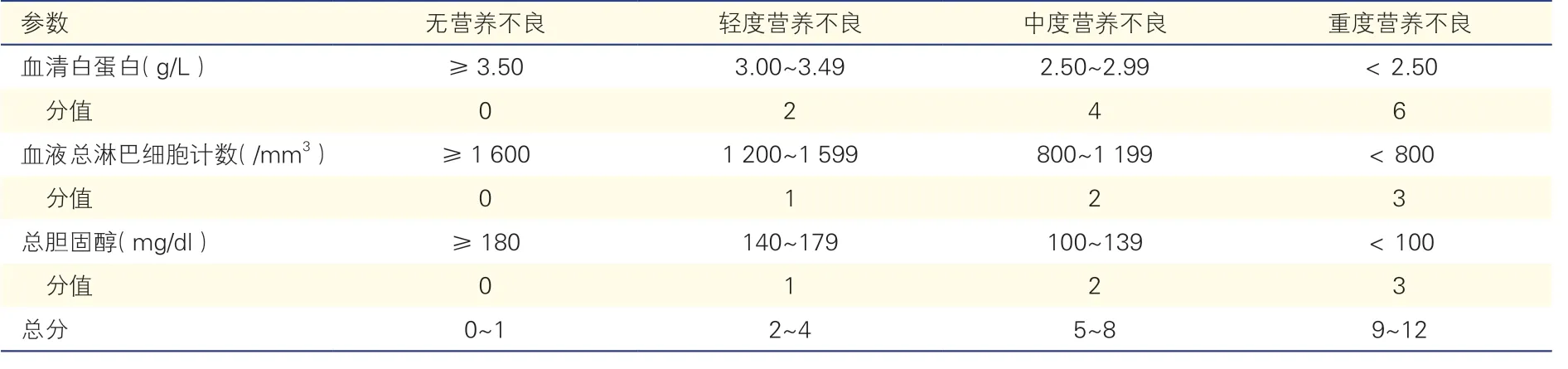
表1 控制營養狀態評分

表2 老年人營養風險指數和預后營養指數
1.2 術后營養篩查
由于心臟外科患者術后常規返ICU 進行監護治療,因此術后營養篩查常在ICU 進行。重癥患者營養風險(NUTRIC)評分是指南推薦專門用于評估ICU患者營養需求的評分系統[17]。Heyland 等[18]首先提出并驗證了NUTRIC 評分(表3),隨著NUTRIC 評分增加,機械通氣時間與死亡率相應地增加,最重要的是,在ICU 住院超過3 d 的患者亞組中,高NUTRIC 評分的患者可以從積極營養支持治療中獲益。Rahman 等[19]研究發現,NUTRIC 評分每增加1 分,患者術后28 d 的死亡率就增加1.4 倍,對于NUTRIC 評分為6~9 的患者,熱量增加25%,死亡風險降低18%,這提示營養支持治療可能改善患者預后。這些研究表明對ICU 患者,高NUTRIC 評分者營養風險高,并且容易從營養支持治療中獲益。盡管如此,NUTRIC 評分對心臟外科患者的適用性可能有限,因為它是由ICU 入院時評估的生理變量組成的,這些生理變量在心臟手術后最初24 h 內變化很大。
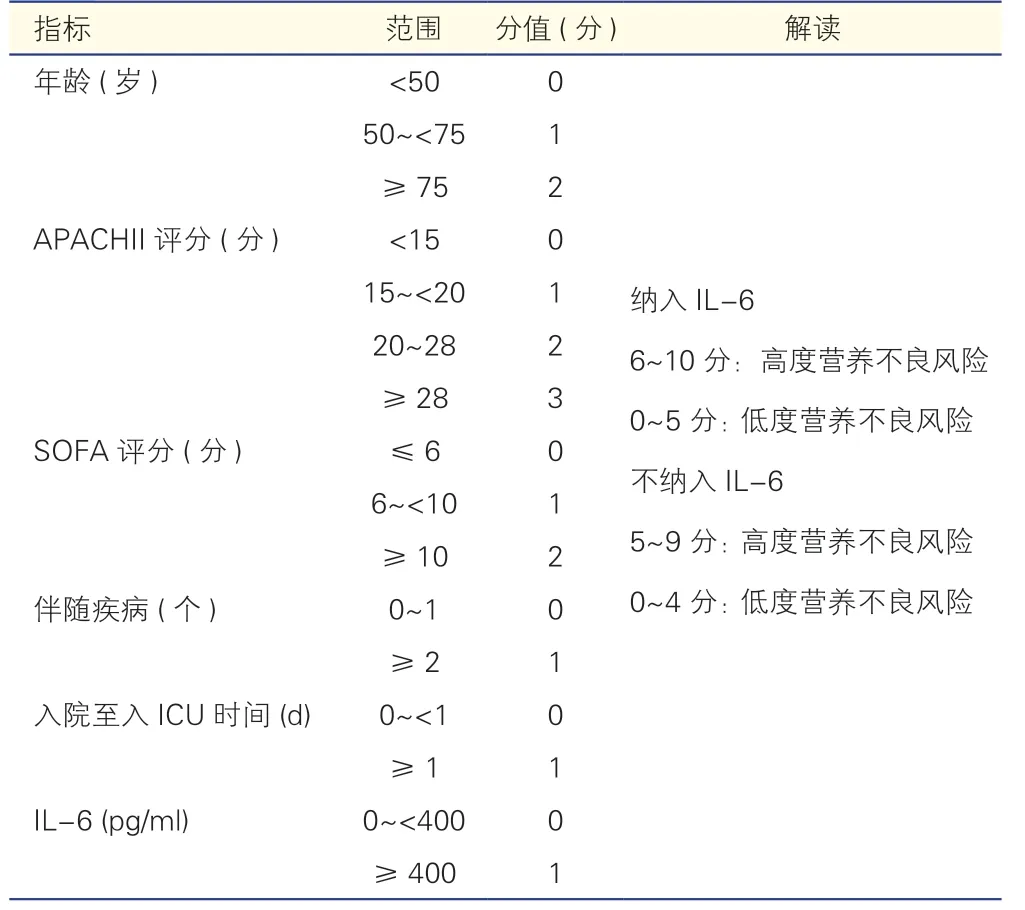
表3 重癥患者營養風險(NUTRIC)評分
鑒于此,Ohkuma 等[20]開發了一種專門用來預測心臟外科手術后營養治療需求的評分系統,即約翰·霍普金斯醫院營養支持評分(JHHNS)(表4)。JHHNS 根據術后營養需求對患者進行風險分層,0~9 分為低度營養需求風險,10~36 分為高度營養需求風險,高度營養需求風險組患者需要進行營養治療干預,且死亡率更高,ICU 住院時間、機械通氣時間和術后住院時間更長。JHHNS 評分可以識別出心臟外科術后需要營養支持治療的患者,但營養治療對其臨床結局的影響尚待研究。
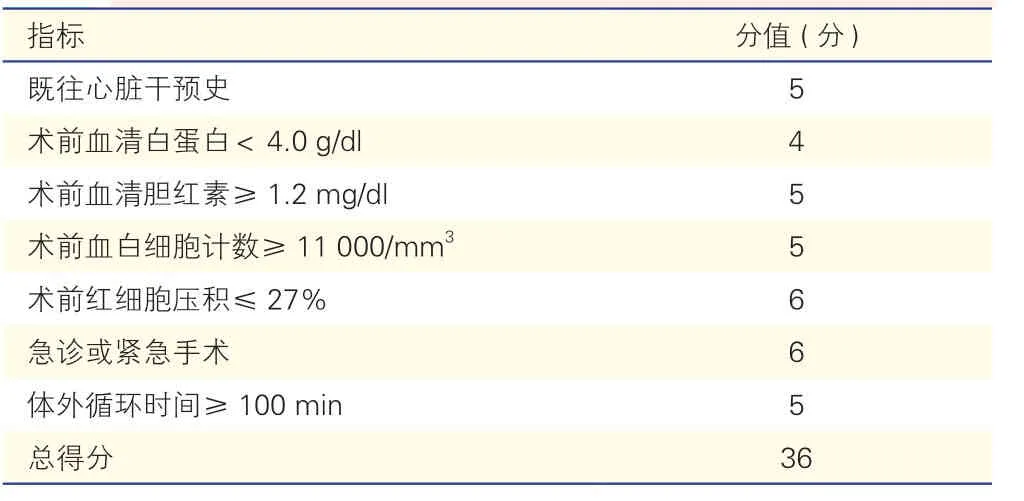
表4 JHHNS 評分
2 心臟外科圍術期常用營養支持策略
2.1 口服營養補充(ONS)
ONS 是指在日常膳食基礎上因特定醫療目的補充規定的食品,主要包括各種類型腸內營養制劑。多國營養學會指南均推薦在術前如果普通飲食無法滿足熱量和蛋白質需求,應當首選ONS 補充營養;術后早期恢復經口進食也是安全的,且對術后恢復至關重要。研究表明術前口服一定量腸內營養制劑可以改善外科手術患者營養狀況、提高患者機體免疫力、保護腸黏膜屏障功能、降低并發癥發生率及促進患者術后恢復[21-22]。一些小規模臨床試驗發現[23-24],對于具有高危感染風險的老年心臟外科患者,術前口服一定量的免疫增強型腸內營養制劑可顯著提高術前免疫防御力、減少術后感染(4/23 vs.12/22,P=0.01)和保護腎臟功能,還可減少正性肌力藥物使用,縮短住院時間。ONS 是一種簡單、有效的營養治療策略,但指南推薦免疫增強型腸內營養制劑需至少服用5~7 d 方可發揮效用[7],故應盡可能在門診指導患者開始使用ONS。
2.2 腸內營養
腸內營養是通過管飼方式向胃腸道輸注各種腸內營養制劑,適用于有一定消化道功能但無法經口飲食的患者。研究表明腸內營養是危重患者的重要營養治療方式,腸內營養可維持腸道的穩定性,減少感染并發癥,并縮短住院時間[25]。目前普遍認為使用腸內營養對于術后血流動力學不穩定的患者不利,因其可能影響心輸出量,引起嚴重胃腸道并發癥如腸道缺血。但近年來許多研究表明,心臟外科患者術后早期使用腸內營養是安全有效的[26]。如Revelly 等[27]的研究表明對需血管活性藥物維持的患者術后第1 天即給予腸內營養可觀察到心臟指數[(2.9±0.5)L/(min·m2)vs.(3.3±0.5)L/(min·m2)]和內臟血流增加,這可能與腸內營養增加收縮期心室容積有關。而Kesek 等[28]在73 例術后3 d 內使用腸內營養的患者中發現,最常見的胃腸道不良反應為腹瀉(15 例)和嘔吐(12 例),只有1 例嚴重嘔吐病例,經過對癥處理后好轉,未發現腸道缺血病例。對于心臟手術后的胃腸道吸收功能,Berger 等[29-30]通過乙酰氨基酚吸收實驗表明即使存在血流動力學障礙,腸道吸收的機制仍可維持,通過腸內營養也可以實現(70±35)%的推薦熱量攝入目標,并且腸內營養的使用可以減少血管活性藥物的使用。同樣的,Flordelís Lasierra 等[31]發現術后依賴兩種或多種血管活性藥物和(或)機械循環支持的心臟手術患者,在平均12.3 d 的時間內,通過腸內營養平均可輸送1 228.4 kcal/d 的熱量,15 例(40.4%)患者可達到熱量攝入目標。
心臟外科患者由于胃腸道不耐受和容量限制等因素,常規腸內營養通常只能提供約60%甚至更少的推薦攝入熱量。CoCoS 試驗表明在心臟外科手術患者通過各種營養支持手段可糾正熱量不足,并降低擇期心臟手術患者的死亡率和并發癥,如在冠狀動脈旁路移植術和主動脈瓣手術中,試驗組女性患者的生存率明顯高于對照組(100% vs.83%,P=0.0015;97% vs.78%,P=0.0337)[32]。現有研究表明,心臟外科患者術后早期使用高熱量腸內營養可以增加熱量攝入,糾正熱量不足,并改善術后早期臨床結果。如Efremov 等[33]比較了心臟外科患者術后接受高熱量腸內營養(1.3 kcal/ml)與標準腸內營養(1.0 kcal/ml)熱量攝取的差異,結果觀察到高熱量腸內營養組在術后第2 天、第5 天和第7 天熱量攝取較標準腸內營養組增加,其中在術后第5 天差別最大(1 950 kcal/d vs.1 000 kcal/d,P=0.0036)。Scheeffer等[34]研究了高熱量腸內營養(1.0 kcal/ml)對59 例先天性心臟病患兒術后早期臨床結局的影響,對照組為標準腸內營養(0.67 kcal/ml)。術后30 d 隨訪發現兩組總體死亡率、胃腸道不良反應、呼吸機使用時間無明顯差異,但高熱量腸內營養組抗生素使用率較低(P=0.047),平均住院時間為14 d,而對照組為20 d,但兩組差異無統計學意義(P=0.057)。因此對心臟外科患者而言,高熱量腸內營養策略可能是一種有前途的腸內營養應用策略,但仍需進一步大規模臨床研究,以明確其對短期及長期預后的臨床意義。
2.3 腸外營養
當腸內營養被視為禁忌或者不能滿足熱量和蛋白質營養需求時,必須考慮腸外營養,特別是在有營養不良或有營養不良風險的患者中尤為重要。腸外營養可分為全量腸內營養(TPN)和補充腸內營養(SPN),TPN 即完全由腸外營養提供營養,而SPN則是在ONS 或腸內營養基礎上加用腸外營養。在臨床上,出于對胃腸道并發癥尤其是腸缺血風險的擔憂[35-36],心臟手術后早期更傾向于使用腸外營養而不是腸內營養。腸外營養可提供甘油三酯、游離脂肪酸、乙酰乙酸酯、氨基酸和葡萄糖等代謝底物[37],從而有效改善營養代謝狀態,糾正熱量和蛋白質攝入不足。腸外營養優點在于可確保達到熱量和蛋白質目標,并避免腸內營養的潛在并發癥。研究表明,ICU 患者早期進行腸外營養與更少的機械通氣時間和更好的肌力恢復相關,且不良事件發生率未見升高[38-39],但缺點是可能引起高血糖癥、肝酶升高和血流感染。
近年來,隨著規范血糖管理,靜脈置管技術的進步以及新型腸外營養制劑的出現,腸外營養的安全性和有效性進一步提高。其中,含魚油的脂肪乳劑受到廣泛關注。魚油富含ω-3 多不飽和脂肪酸(ω-3 PUFA),可增加血小板和心房組織膜中的多不飽和脂肪酸濃度[40],具有抗炎和免疫調節作用。研究表明,ω-3 PUFA 對心血管系統產生有益的影響,可能降低心臟手術死亡率和圍手術期房顫的發生率[41-42]。但目前關于這一結論仍存在爭議,一篇Meta 分析認為術前短期補充魚油不會顯著降低圍術期心房顫動發生率[43]。Christou 等[44]認為這可能是因為大部分研究術前補充魚油時間不足,導致ω-3 PUFA不能充分插入心肌細胞膜,發揮其生物學效應。因此尚需要進一步精心設計的研究來明確具體的魚油補充策略和時間,以使患者獲益。
2.4 腸內營養+SPN
腸外營養和腸內營養聯用既可以達到推薦熱量和蛋白質攝入目標,又可以維持胃腸道功能,促進術后恢復,獲得最佳臨床治療效果。在一項包含心臟手術患者的隨機對照試驗中,Heidegger 等[45]發現對于使用腸內營養 3 d 尚未達到60%熱量目標的患者進行SPN,在連續使用5 d 腸內營養+SPN 后熱量目標可達到103%,而繼續只使用腸內營養者熱量目標僅達到77%;在ICU 9~28 d,腸內營養+SPN的院內感染率明顯低于腸內營養(27% vs.38%,P=0.0338)。可見腸內營養與PN 聯用臨床獲益優于單純腸內營養,腸內營養+SPN 可以更快達到營養目標,同時減少術后并發癥發生。
而國內也有類似的研究表明,早期腸內營養+SPN 治療可促進重型顱腦損傷患者免疫功能恢復,改善營養狀況,減少并發癥,改善臨床預后[46]。因此對于有營養風險患者,如果無法實施腸內營養或腸內營養無法滿足機體熱量及蛋白質需求時,應當盡快開始腸外營養,腸內營養+SPN 比單純腸內營養或腸外營養對這些患者更有益。一項納入了5項隨機對照研究的Meta 分析指出與單獨腸內營養相比,SPN +腸內營養降低了院內感染(RR=0.733,P=0.032)和ICU 死亡率(RR=0.569,P=0.030)。SPN+腸內營養與單純腸內營養在住院時間、病死率、ICU 住院時間、機械通氣時間等方面差異均無統計學意義[47]。總之,當腸內營養不能滿足危重成人患者的熱量需求時,SPN 可能是有益的,因為它有助于減少感染和ICU 死亡率,并增加熱量和蛋白質攝入量,而對其他臨床結果沒有負面影響。盡管腸內營養+SPN 是一種十分有前景的營養治療方式,但腸內營養+SPN 的獲益尚未在心臟外科患者中得到驗證。因此,需要大型的臨床研究來為腸內營養+SPN 在心臟外科患者圍手術期的應用提供證據。
3 總結與展望
營養治療是心臟外科圍術期重要的治療措施,規范的營養篩查及合理的營養治療可改善患者營養狀態,并促進術后恢復,改善臨床預后。目前尚缺乏高質量證據支持的專門用于評估心臟外科手術患者營養不良風險的方法,在未來應當積極研發新的營養篩查工具,并在心臟外科患者中進行驗證,以識別出那些需要進行營養支持治療并能從中獲益的人群。近年來,國內外研究者正開始為心臟外科患者制定具體的營養治療方案和策略。其中,高熱量腸內營養和腸內營養+SPN 可能是有一定前景的營養治療策略。特別是腸內營養+SPN,初步證據表明,腸內營養+SPN 為ICU 住院時間長的心臟手術患者提供充足的熱量和蛋白質,促進心臟手術后的恢復和改善結果,但仍需進一步大規模臨床研究驗證。最后在具體的臨床實踐中,需要充分認識到營養治療的重要性和必要性,對每一個擇期心臟手術患者進行營養狀態優化,以期改善患者的臨床預后。
利益沖突:所有作者均聲明不存在利益沖突

