甘薯蔓割病拮抗菌株KC2-8的篩選、鑒定及紫外誘變
張靜珍, 靳曉杰, 王連軍, 柴沙沙, 龍 同,楊園園, 程賢亮, 楊新筍*, 雷 劍*
(1.湖北省農(nóng)業(yè)科學(xué)院 糧食作物研究所/糧食作物種質(zhì)創(chuàng)新與遺傳改良湖北省重點實驗室/湖北省甘薯工程技術(shù)研究中心,湖北 武漢 430064; 2.長江大學(xué) 農(nóng)學(xué)院,湖北 荊州 434025;3.國家生物農(nóng)藥工程技術(shù)研究中心/湖北省生物農(nóng)藥工程研究中心/湖北省農(nóng)業(yè)科學(xué)院,湖北 武漢 430064)
甘薯蔓割病是我國南方甘薯種植區(qū)的主要病害,為導(dǎo)管系統(tǒng)病害,主要危害甘薯蔓莖基部,也可侵染薯塊,發(fā)生規(guī)律與溫度密切相關(guān).2011年,湖北省在調(diào)查主要甘薯病害中發(fā)現(xiàn),全省多地均發(fā)生了甘薯蔓割病的危害,部分產(chǎn)區(qū)發(fā)病率30%以上,對甘薯產(chǎn)業(yè)影響巨大[1].甘薯蔓割病的發(fā)生隨機性較強,可使甘薯減產(chǎn)10%~20%,嚴(yán)重時可減產(chǎn)50%以上.近年來,在長江中下游區(qū)域發(fā)現(xiàn)有甘薯蔓割病的發(fā)生.甘薯蔓割病的主要致病真菌為尖孢鐮刀菌甘薯專化型(Fusariumoxysporumf.sp.batatas,Fob),是一種具有較強腐生和寄生能力、分布較為廣泛的土傳性真菌病害,可侵染茄科、瓜類、棉花、香蕉、豆類及花卉等多種植物,引起枯萎病.
目前,尖孢鐮刀桿菌的主要防治方法有:培育抗病新品種,利用化感物質(zhì)及化學(xué)藥劑防治結(jié)合農(nóng)業(yè)措施.如,吳振新[2-3]研究表明,利用50%菌靈可濕性粉劑1 000倍液和20%噻森銅懸浮劑600倍液浸苗10 min,晾干后種植,結(jié)合有機肥的施用,可大大降低甘薯蔓割病的發(fā)病率.化學(xué)殺菌劑使用效果雖好,但是存在潛在風(fēng)險.張鴻等[4]通過農(nóng)桿菌轉(zhuǎn)化篩選非致病突變體試驗,獲得3株非致病突變體,可與蔓割病菌發(fā)生營養(yǎng)競爭作用抑制菌絲生長,從而為甘薯蔓割病生物防治提供了理論基礎(chǔ).因此,以生物防治為主,代替化學(xué)防治的研究對尖孢鐮刀菌的防治具有重要意義[5].
芽孢桿菌為革蘭氏陽性桿菌,存在于植物微生態(tài)和土壤中,是優(yōu)勢生物種群,能在逆境下形成內(nèi)生芽孢以抵抗不良環(huán)境[6],例如:耐酸堿、紫外、高溫等;制劑成本低,易加工,安全性和穩(wěn)定性較好;促進(jìn)植物生長,增加產(chǎn)量,誘導(dǎo)植物產(chǎn)生抗病性[7].目前,芽孢桿菌已成為生物農(nóng)藥研發(fā)熱點[8],如王波等[9]通過一株多粘類芽孢桿菌XZ-2對甘薯黑斑病的生防效果和作用機理進(jìn)行了研究,結(jié)果表明,利用稀釋10倍的XZ-2發(fā)酵液處理貯藏期薯塊可有效抑制黑斑病孢子萌發(fā).
本文以實驗室保存的菌株為研究對象,篩選對尖孢鐮刀菌甘薯專化型具有高效拮抗活性的菌株,對篩選出來的菌株KC2-8進(jìn)行分子鑒定,并通過紫外照射時間的變化對原始菌株進(jìn)行誘變,篩選到抗真菌生物活性較高的新突變株,從而更好地應(yīng)用于生產(chǎn)實踐.
1 材料與方法
1.1 供試菌株
尖孢鐮刀菌甘薯專化型由徐州市農(nóng)業(yè)科學(xué)研究院提供.供試菌株KC2-2、KC2-8、KC6-5由湖北省生物農(nóng)藥工程研究中心分離鑒定和保存.
1.2 供試培養(yǎng)基
PDA培養(yǎng)基:新鮮馬鈴薯(去皮)200 g,煮沸20 min,過濾加葡萄糖20 g,瓊脂粉20 g,加蒸餾水定容至1 000 mL,115 ℃滅菌20 min.
LB培養(yǎng)基:NaCl 10 g,酵母粉5 g,蛋白胨10 g,加蒸餾水定容至1 000 mL,115 ℃滅菌20 min.
1.3 拮抗細(xì)菌的篩選
將經(jīng)LB培養(yǎng)基活化的KC2-2、KC2-8、KC6-5分別接種于PDA培養(yǎng)基兩側(cè),再將5 mm的尖孢鐮刀桿菌菌餅接種于培養(yǎng)基中間,以只接種病原菌的PDA平板為對照,每個處理3個重復(fù).置于28 ℃暗培養(yǎng)箱內(nèi)96 h,待對照長滿整個平板時觀察菌株對病原菌的拮抗效果.抑菌率公式如下:
其中D表示直徑.
1.4 分子生物學(xué)鑒定
將待測菌株KC2-8接種到LB液體培養(yǎng)基上,于28 ℃、180 r/min振蕩培養(yǎng)24 h,將菌液直接作為DNA模板進(jìn)行16S rDNA序列的PCR擴(kuò)增.擴(kuò)增總體系為25 μL,包括菌液DNA 1 μL,正反向引物各1 μL,ddH2O 9.5 μL,Master mix 12.5 μL.擴(kuò)增程序:94 ℃預(yù)變性3 min;94 ℃變性30 s,55 ℃退火30 s,72 ℃延伸1 min 30 s,33個循環(huán);72 ℃延伸10 min.擴(kuò)增產(chǎn)物經(jīng)1%瓊脂糖凝膠檢測后,由天一輝遠(yuǎn)公司測序.測序結(jié)果在NCBI網(wǎng)站通過BLAST程序進(jìn)行同源性比對,并用MEGA 7.0軟件的鄰接法(Neighbor-Joining Tree)構(gòu)建系統(tǒng)發(fā)育樹.
1.5 紫外誘變實驗
1.5.1 液體菌種的制備將KC2-8菌株活化后,菌餅放至LB液體培養(yǎng)基中,200 r/min、28 ℃振蕩培養(yǎng)24 h.
1.5.2 紫外誘變菌液濃度的確定分別取6支盛有9 mL無菌水的試管,依次編號為10-1、10-2、10-3、10-4、10-5、10-6,另取盛有LB無菌培養(yǎng)皿9套,編號10-4,10-5,10-6各3皿.將枯草芽孢桿菌于LB液體培養(yǎng)基中培養(yǎng)20 h,吸取1 mL離心后的菌液上清加到10-1試管中,振蕩混勻,再將10-1的菌懸液取1 mL加入到10-2試管中,其余試管依次類推.分別精確吸取10-4、10-5、10-6的稀釋液0.1 mL,對應(yīng)加入已編號培養(yǎng)皿中,涂布均勻,待菌液稍干后,倒置,于28 ℃培養(yǎng)箱中培養(yǎng)12 h,對編號10-4、10-5、10-6培養(yǎng)皿的菌落進(jìn)行計數(shù).
1.5.3 KC2-8菌株的紫外誘變將KC2-8菌株活化后,取適量菌液10 000 r/min離心2 min,用生理鹽水稀釋成濃度為107~108個/mL,再取100 μL制備好的菌懸液均勻涂布于LB固體培養(yǎng)基中,分別進(jìn)行5、10、15、20、30 s的紫外誘變,通過平板計數(shù)法估算單菌落數(shù)量(n),以未經(jīng)輻照的涂布平板為對照組估計致死率,以決定最佳輻照時間.致死率為
1.5.4 誘變菌株的篩選將紫外誘變后的菌懸液稀釋至一定倍數(shù),取100 μL均勻涂布于LB固體培養(yǎng)基上,經(jīng)紫外誘變照射不同時間后,28 ℃ 12 h暗培養(yǎng),將平板上菌落直徑大、生長迅速的單菌落涂布接種至斜面PDA培養(yǎng)基,4 ℃保存.
2 結(jié)果與分析
2.1 拮抗菌株的篩選和16S rDNA分子鑒定
2.1.1 尖孢鐮刀菌的拮抗菌株篩選通過平板對峙法檢測3株細(xì)菌對尖孢鐮刀桿菌的拮抗作用.由圖1可知,菌株KC2-8對尖孢鐮刀桿菌抑制作用最強,抑菌圈最大,抑菌率為62.2%.菌株KC6-5的抑菌效果次之,抑菌率為52.4%,KC2-2的抑菌效果最差,抑菌率為50.0%.
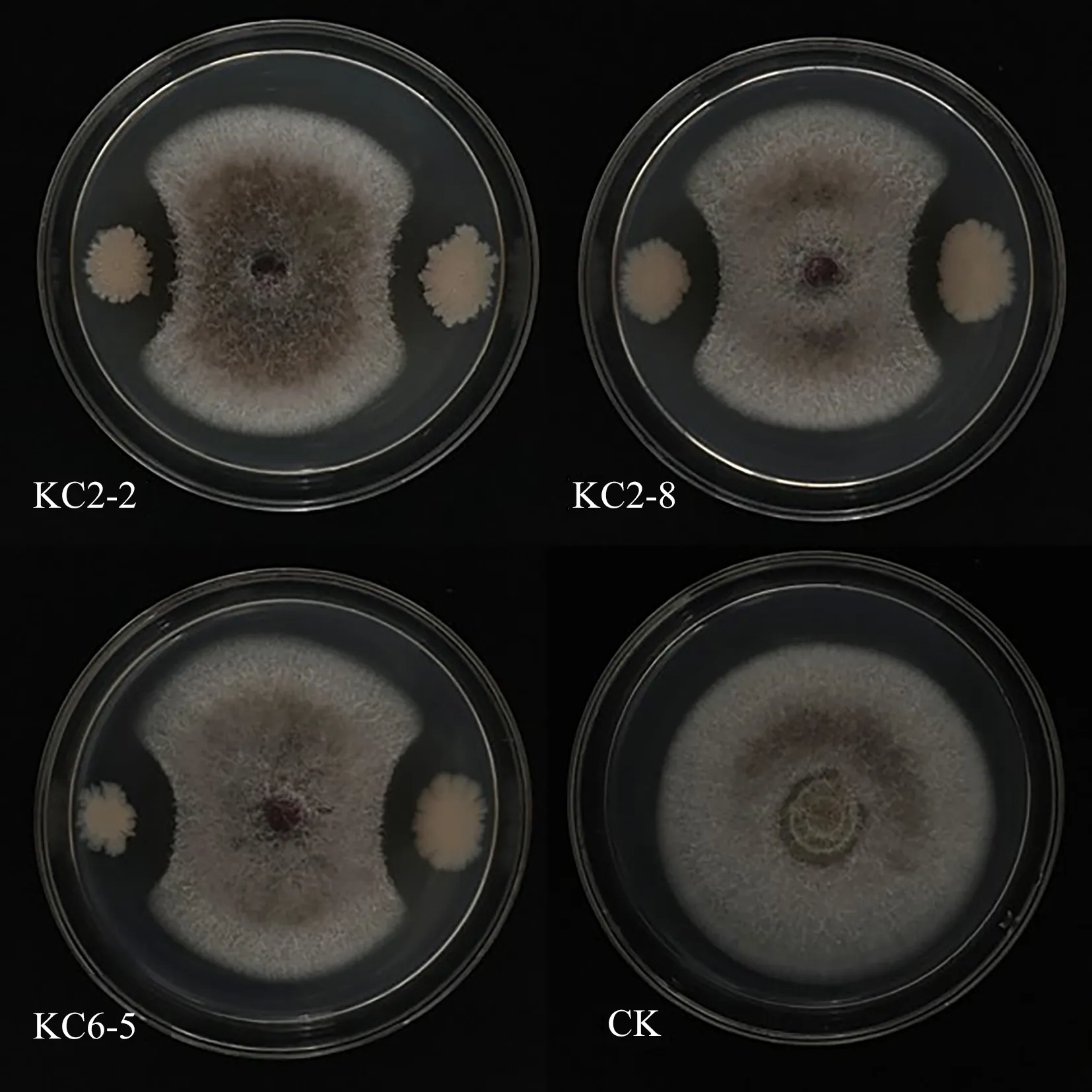
圖1 3株細(xì)菌對尖孢鐮刀桿菌的拮抗圖Fig.1 Antagonistic diagram of three bacterial strains against Fusarium oxysporum
2.1.2 拮抗菌株的分子生物學(xué)鑒定以菌株KC2-8菌液為DNA模板,采用細(xì)菌通用引物16S rDNA進(jìn)行菌液PCR擴(kuò)增、回收、測序.測得KC2-8菌株16S rDNA基因片段長度為1 402 bp.將測序結(jié)果與NCBI數(shù)據(jù)庫進(jìn)行BLAST比對,結(jié)果顯示:與菌株KC2-8相似性最高的為Bacillusmojavensis,相似度達(dá)到99%.從圖2可以看出,菌株KC2-8與BacillusmojavensisstrainHM753629.1和BacillustequilensisstrainKT982221.1同屬于一個遺傳分支,親緣關(guān)系十分接近,菌株KC2-8與BacillusmojavensisstrainHM753629.1在BLAST比對過程中的相似度為99.93%,與BacillustequilensisstrainKT982221.1的相似度為100%,最終將KC2-8確定為特基拉芽孢桿菌(Bacillustequilensis).

圖2 基于16S rDNA序列構(gòu)建的KC2-8菌株系統(tǒng)發(fā)育樹Fig.2 Phylogentic tree based on sequence of 16S rDNA of strain KC2-8
2.2 拮抗菌株KC2-8的紫外誘變
2.2.1 紫外(UV)照射時間對KC2-8菌株致死率的影響KC2-8經(jīng)不同誘變時間后,計算單菌落的個數(shù)、菌株的致死率并繪制UV誘變致死率曲線,結(jié)果顯示(圖3):KC2-8菌株對紫外誘變較為敏感,隨著誘變時間的增加,致死率呈上升趨勢,在10~20 s致死率上升速度最快,UV 照射20 s致死率為89.6%,30 s致死率高達(dá)99.2%,故選擇UV照射 20 s為最佳誘變時間.
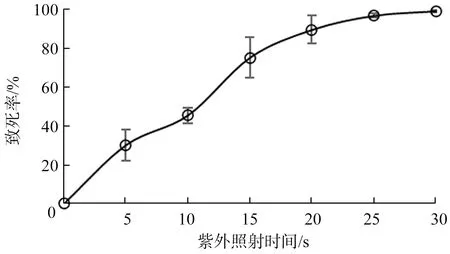
圖3 UV誘變時間與致死率的關(guān)系Fig.3 Relationship between time of UV mutagenesis and mortality
2.2.2 KC2-8誘變高產(chǎn)菌株的篩選通過平板對峙法篩選高產(chǎn)菌株,結(jié)果如圖4所示,共篩選出10株(UV1—UV10)高產(chǎn)優(yōu)質(zhì)誘變菌株,紫外誘變時間:CK,0 s;UV1,5 s;UV2,10 s;UV3、UV4,15 s;UV5、UV6,20 s;UV7、UV8,25 s;UV9、UV10,30 s.
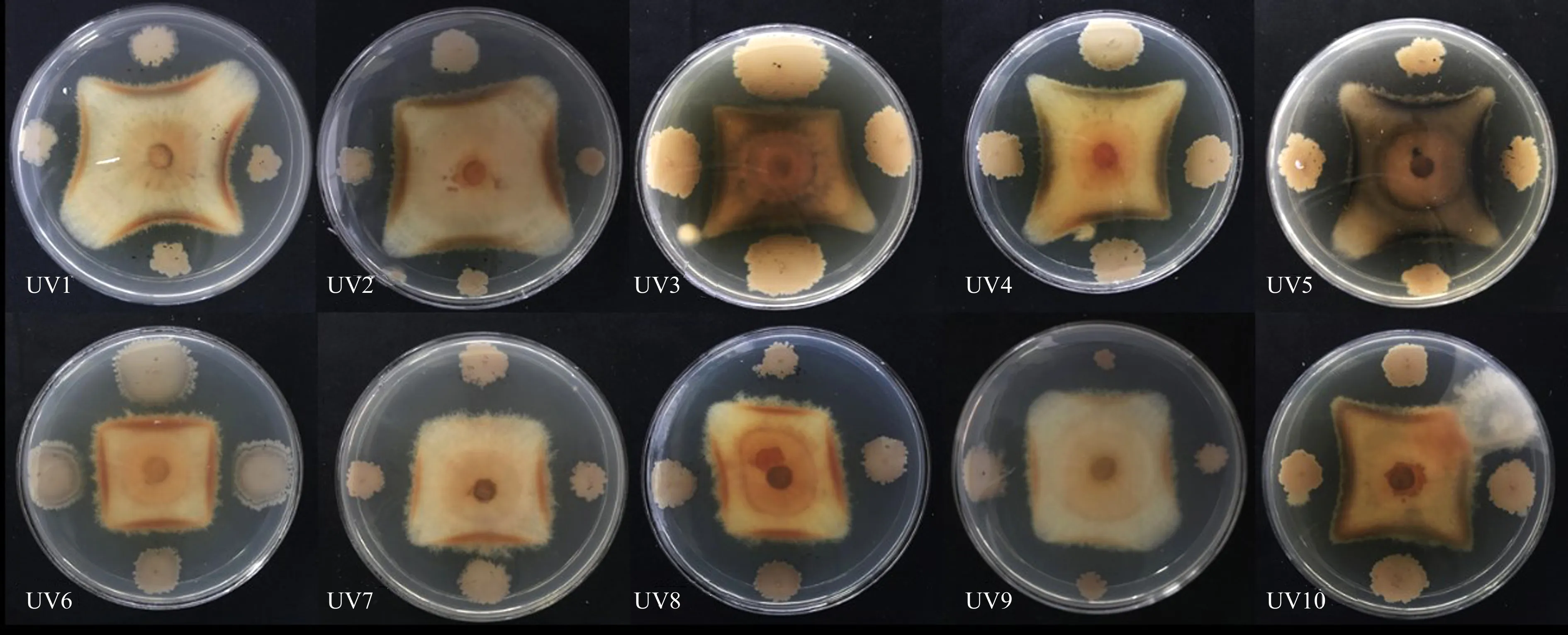
圖4 KC2-8紫外誘變后復(fù)篩菌株發(fā)酵液對峙尖孢鐮刀桿菌生長的抑制圖Fig.4 Inhibition of Fusarium oxysporum growth in fermentation broth of KC2-8 strain after ultraviolet mutagenesis
10株誘變株抑菌活性如圖5所示:菌株KC2-8的抑菌能力隨著紫外照射時間增加呈現(xiàn)先降低后升高的趨勢.在尖孢鐮刀桿菌對峙中,UV5—UV10菌株抑制率高于原始菌株,其中:UV7抑菌效果最好,抑菌率為48.9%,較原始菌株的抑菌率提高了4.0%,UV8和UV9表現(xiàn)次之,抑菌率為48.4%,較原始菌株KC2-8提高了3.5%,且UV5—UV9的抑菌率差異不顯著.UV1—UV4較CK抑菌率減少了3.6%~6.2%,抑菌效果較差.

圖中不同字母表示處理間差異顯著(p<0.05).圖5 KC2-8紫外誘變后復(fù)篩菌株發(fā)酵液對峙尖孢鐮刀桿菌生長的抑菌率Fig.5 Inhibition rate of KC2-8 fermentation broth byUV radiation on the growth of fusarium oxysporum
3 討論與結(jié)論
大量研究表明:生防菌,如芽孢桿菌具有內(nèi)生固氮、防治病害等生物學(xué)作用且對人畜無害,對環(huán)境友好.其生防機制主要表現(xiàn)在拮抗病原菌[10-14]、誘導(dǎo)植物產(chǎn)生抗病性[15-17]、溶解病原菌[18]、競爭[19]等方面.特基拉芽孢桿菌是Gatson等[20]從墨西哥的一個墓穴中首次分離得到的,它是一種廣譜拮抗菌,可有效抑制黑曲霉、毛霉菌[21]、小麥赤霉病菌[22]、桑樹地杖菌[23]、煙草黑脛病菌[24]、西瓜枯萎病菌[25]、大豆炭疽病菌[26]等.近年來,特基拉芽孢桿菌分離提取在國內(nèi)外已有較多研究,如:Paliya等[27]從城市生活垃圾處理廠中分離出好氧降解的特基拉芽孢桿菌,為污染環(huán)境中PBDEs的生物修復(fù)提供了新的解釋;Nayarisseri等[28]從微咸水中分離鑒定出一株新型的生物表面活性劑產(chǎn)生菌,即特基拉芽孢桿菌.Pradhan等[29]研究發(fā)現(xiàn),特基拉芽孢桿菌通過產(chǎn)生生物表面活性劑等物質(zhì),破壞病原菌的生物膜,以達(dá)到抑菌效果.而特基拉芽孢桿菌開發(fā)利用仍有待研究.江蘇師范大學(xué)邢珂等[30]申請了一種產(chǎn)揮發(fā)性抑菌氣體的特基拉芽孢桿菌的專利,特基拉芽孢桿菌產(chǎn)生的揮發(fā)性氣體對植物病原菌有強烈的拮抗作用,可顯著抑制其致病力,對遠(yuǎn)距離防治植物病原菌具有參考價值.
本研究通過平板對峙對3個菌株進(jìn)行篩選,篩選到一株對Fob具有拮抗活性的菌株KC2-8,該菌可有效抑制Fob的擴(kuò)散.利用16S rDNA序列分析,將該菌株鑒定為特基拉芽孢桿菌BacillustequilensisstrainKT982221.1.通過對KC2-8進(jìn)行紫外誘變,選擇20 s為最佳誘變時間,致死率為89.6%.通過平板對峙篩選得到6株穩(wěn)定突變株,其中UV7抑菌率高達(dá)48.9%,隨著誘變時間的增加,抑菌率呈現(xiàn)先降低后升高的趨勢.本研究結(jié)果可為由尖孢鐮刀桿菌F.oxysporum引起的甘薯蔓割病的防治提供參考,但是對KC2-8菌株的抑菌活性物質(zhì)及其對甘薯蔓割病的田間防治效果尚需進(jìn)一步研究.

