茶樹轉錄因子CsbHLH137基因鑒定及光合特性與生物鐘響應分析
劉春方,劉文艷,滕瑞敏,楊 妮,劉潔霞,莊 靜*
(1 南京農業大學 園藝學院,茶葉科學研究所,農業農村部華東地區園藝作物生物學與種質創制重點實驗室,南京 210095;2 南京農業大學,作物遺傳與種質創新國家重點實驗室,南京 210095)
茶樹[Camelliasinensis(L.) O. Kuntze]作為一種重要的葉用經濟作物,在世界范圍內廣泛栽培。茶樹生長在不同的環境條件下,光是影響茶樹生長發育的重要因素之一[1]。茶樹利用光吸收的能量來促進光合作用,也通過監測光的光譜組成、強度(光通量速率)、方向和時空模式來獲得關于周圍環境的信息。茶樹依靠這些信息對環境變化做出反應,調控生長和發育,以適應當地環境條件[2]。光合能力是茶樹生長的關鍵驅動力,光合參數和葉片氣孔開度一定程度上反映茶樹的光合能力。
晝夜節律被定義為在大約24 h的振蕩中發生的內源性生物過程,也被稱為生物鐘[3]。生物鐘作為內源計時分子網絡,可以測量環境中的每日和季節變化,并允許植物相應地調整生理和發育過程[4]。晝夜節律受制于周期性的環境信號,并且可以通過各種刺激(如光信號)來重置。因此,生物鐘整合了環境信號,并協調了植物整個生命周期中的發育事件[5]。
bHLH家族轉錄因子的bHLH結構域高度保守,由大約60個氨基酸組成,有兩個功能不同的區域,即堿性區域和HLH(helix-loop-helix)區域[6]。HLH結構域的主要功能為促進蛋白質間相互作用,并且能形成同源二聚體和異源二聚體復合物[7]。bHLH的N端基本區域介導與特定六核苷酸序列的高親和力DNA結合,bHLH蛋白識別的核心DNA序列基序稱為E-box(5′-CANNTG-3′),bHLH結構域堿性區域的3個殘基是His/Lys-9、Glu-13和Arg-17,構成了典型的G-box結合區[8]。bHLH家族轉錄因子在植物生長發育過程中發揮著重要作用,其中包括光信號傳導、果實和花發育以及氣孔發育等[9]。越來越多的bHLH蛋白在植物中的功能得到了鑒定,調節對環境的反應是植物bHLH蛋白保留的一個原始功能,例如通過生物鐘的組成部分控制對光的反應和相互作用[10]。
植物中的bHLH137最早在擬南芥中鑒定出來,隨后在水稻、大白菜、藍莓和番茄中鑒定到同源基因,如水稻OsbHLH80基因、大白菜BrabHLH139基因和藍莓VcbHLH004基因[6, 11-13]。在擬南芥中,bHLH轉錄因子可以聚為12個亞組,AtbHLH137轉錄因子屬于Ⅻ亞組,劃分為32個亞家族,AtbHLH137轉錄因子屬于25亞家族,預測DNA結合基序包含G結合基序、E-box結合基序和G-box結合基序,該亞家族成員參與植物體內油菜素甾體和脫落酸信號轉導,調控花瓣形態發生[10, 14-15]。AtbHLH137屬于DELLA蛋白應答基因,DELLA蛋白是受光調控的生長抑制因子,DELLA蛋白已被證明在植物體內直接與光敏色素作用因子(phytochrome-interacting factors,PIFs)相互作用,抑制其轉錄活性,在整合光和時鐘信號以驅動日常生長節律方面起著關鍵作用[16-18]。目前鑒定出茶樹bHLH家族轉錄因子主要參與茶樹類黃酮合成和非生物脅迫。有研究篩選出7個bHLH家族轉錄因子基因參與茶樹類黃酮生物合成途徑[19]。此外有研究提出了茶樹中與非生物脅迫相關的bHLH家族成員[9]。
茶樹bHLH轉錄因子調控晝夜節律的表達情況和作用機理尚不清楚。本研究以茶樹‘蒙山9號’為材料,克隆獲得1個編碼CsbHLH137轉錄因子的基因,對該基因編碼的氨基酸序列進行了序列比對、亞細胞定位、理化性質、親水性和疏水性等方面的分析,并研究了其進化樹、二級和三級結構。對不同時間點的茶樹葉片進行氣孔開度分析和光合參數測定,通過實時熒光定量PCR技術研究了茶樹CsbHLH137轉錄因子基因在晝夜節律中的響應情況,旨在為進一步研究茶樹CsbHLH137轉錄因子對茶樹生物鐘的分子調控機制提供一定的參考。
1 材料和方法
1.1 試驗材料與處理
供試材料為茶樹‘蒙山9號’[Camelliasinensis(L.) O. Kuntze cv. Mengshan 9]兩年生扦插盆栽幼苗,種植在南京農業大學作物遺傳與種質創新國家重點實驗室的實驗大棚。
選取長勢良好的‘蒙山9號’兩年生扦插幼苗,茶苗在12 h光照和12 h黑暗條件下(12:00-24:00光照)的光培箱預培養2 d,從中午12:00開始取樣,之后24 h每隔2 h隨機選取健康植株,每株摘取一芽二葉初展葉片,每個處理設置3個生物學重復,提取RNA進行反轉錄成cDNA,用于實時定量的模板。隨機選取6株長勢一致的健康植株測定葉片光合參數,每株重復測定5次。將不同時間點采集的茶樹葉片進行氣孔切片制作。
1.2 測定指標與方法
1.2.1 葉片氣孔切片分析采用指甲油印跡法測定葉片氣孔開度[20]。每個處理隨機選取長勢一致的3株茶苗,測定第2片葉的氣孔。先擦去葉片表面的灰塵,然后在葉片背面均勻涂抹指甲油,待指甲油自然晾干后,用透明膠帶黏貼葉片下表皮,粘取指甲油層,用手指抹平膠帶,使膠帶與指甲油之間充分接觸,無氣泡,撕取粘有指甲油層的膠帶,再貼至載玻片上,制成臨時玻片作為樣本,用Olympus光學顯微鏡(Olympus,Tokyo,Japan)觀察氣孔,測量其長度(縱徑,即啞鈴形保衛細胞的長度)與寬度(橫徑,即垂直于啞鈴形保衛細胞的最寬值),最后計算氣孔開度,測定氣孔的面積用來表示氣孔開度。氣孔開度=π·ab,a=1/2氣孔長度,b=1/2氣孔寬度。
1.2.2 葉片光合參數測定使用Li-6400便攜式光合儀(美國Li-COR公司)測定茶苗光合氣體交換參數。測定指標包括葉片的凈光合速率(Pn)、氣孔導度(Gs)、胞間CO2濃度(Ci)和蒸騰速率(Tr)等。測定條件控制為光強600 μmol·m-2·s-1、CO2濃度400 μmol·mol-1、葉室溫度(25±1)℃,相對濕度70%~80%。
1.2.3 總RNA提取和cDNA合成茶樹葉片總RNA的提取按照多糖多酚植物總RNA提取試劑盒說明書(上海浦迪生物科技有限公司)進行。RNA樣品濃度采用NanoDrop ND 1000(上海譜元儀器有限公司)微量紫外分光光度計檢測,RNA質量用1.2%凝膠電泳檢測。參照HiScript II Q RT SuperMix for qPCR (+ gDNA wiper)試劑盒(南京諾唯贊生物科技有限公司)說明書將總RNA反轉錄成cDNA。
1.2.4CsbHLH137基因的克隆基于茶樹基因組(http://tpdb.shengxin.ren/)數據[21],設計1對特異引物,上游引物CsbHLH137-QF序列為5′-ATGGCAACTTTTGCAAATTACCAACA-3′,下游引物CsbHLH137-QR序列為5′-TTATAAAATTGGGGTGTCCCAAAATG-3′。PCR擴增體系為20 μL,包含7 μL ddH2O、10 μL 2×PrimeSTAR Max Premix酶、1 μL cDNA模板和上下游引物各1 μL。PCR擴增程序:98 ℃預變性10 s;98 ℃變性10 s,55 ℃退火30 s,72 ℃延伸15 s,共35個循環;最后72 ℃延伸10 min。用1.2%瓊脂糖凝膠電泳分離PCR產物并將其回收,與pMD19-T載體連接,轉化至大腸桿菌感受態細胞。挑取陽性克隆菌液送至擎科生物公司測序。
1.2.5 基因表達量的測定參照Hieff qPCR SYBR Green Master Mix(No Rox)試劑盒(上海翊圣生物科技有限公司)的操作說明進行實時熒光定量PCR(Real-time quantitative PCR,RT-qPCR),CFX96TMreal-time PCR system作為熒光定量PCR平臺。采用相對定量的方法,以茶樹actin為內參基因[22]。反應體系為20 μL:SYBR Mix 10 μL,上下游引物各1 μL,cDNA 1 μL,ddH2O 7 μL。擴增程序設置為95 ℃預變性30 s,95 ℃變性5 s,60 ℃退火30 s,40個循環。使用2-ΔΔCT法計算相對表達量[23]。
1.2.6 生物信息學分析在NCBI網站(http://www.ncbi.nlm.nih.gov)預測序列保守域,并用BLAST進行序列同源性比較。利用DNAMAN 8.0軟件進行氨基酸序列多重比對和親/疏水性分析。登陸SMS(http://www.bio-soft.net/sms)和ExPASy(http://web.expasy.org/protparam)分析氨基酸序列組成及理化性質。利用FoldIndex網站(https://fold.weizmann.ac.il/fldbin/findex)分析氨基酸折疊無序化特性。蛋白亞細胞定位采用Cell-PLoc 2.0(http://www.csbio.sjtu.edu.cn/ bioinf/Cell-PLoc-2/)預測。擬南芥AtbHLH137轉錄因子蛋白全長序列登陸TAIR(https://www.arabidopsis.org)下載,并利用MEGA X軟件構建系統進化樹[24]。采用NetPhos 2.0(http://www.cbs.dtu.dk/services/NetPhos-2.0/)預測磷酸化位點。跨膜結構和信號肽分別利用TMpred(https://embnet.vitalit.ch/software/TMPRED_form.html)和SignalP 4.1(http://www.cbs.dtu.dk/services/SignalP-4.1)進行預測。蛋白質二級結構預測采用SOPMA在線網站(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)進行。登陸Swiss-Model(http://www.Swissmodel.expasy.org)預測蛋白質三級結構,并利用PyMOL軟件生成三級結構模型。使用STRING網站(https://string-db.org)預測茶樹CsbHLH137轉錄因子與其他蛋白的相互作用。
1.2.7 數據處理對所測試驗數據使用IBM SPSS Statistics 25.0軟件進行差異顯著性分析,采用Duncan’s多重比較法(P<0.05),使用GraphPad Prism 8繪制折線圖。
2 結果與分析
2.1 茶樹CsbHLH137轉錄因子基因的克隆
以茶樹葉片cDNA為模板,通過引物CsbHLH137-QF和CsbHLH137-QR進行PCR擴增,得到1 000 bp左右的擴增片段。對擴增產物進行測序與分析,結果表明茶樹CsbHLH137基因開放閱讀框為1 023 bp,共編碼340個氨基酸。CsbHLH137基因序列登錄號為OL332046。
2.2 茶樹CsbHLH137轉錄因子進化樹分析
為探究茶樹CsbHLH137轉錄因子的進化關系,選取擬南芥(Arabidopsisthaliana)、獼猴桃(Actinidiadeliciosa)、蓖麻(Ricinuscommunis)等12個物種的bHLH137的氨基酸序列,與茶樹CsbHLH137轉錄因子氨基酸序列構建同源進化樹(圖1)。圖1顯示,CsbHLH137轉錄因子與獼猴桃(A.deliciosa)、藍莓(V.corymbosum)等物種有較近的親緣關系,與毛果楊(P.trichocarpa)、野生大豆(G.soja)等物種親緣關系較遠。
2.3 茶樹CsbHLH137轉錄因子與其他植物相關氨基酸序列比對
茶樹CsbHLH137轉錄因子保守域預測結果(圖2,A)顯示,bHLH_AtBPE_like保守結構域位于該轉錄因子第165~249氨基酸位點之間,CsbHLH137轉錄因子的N端基本區域介導與特定六核苷酸序列的高親和力DNA結合,HLH區域形成同二聚體和異二聚體。將茶樹CsbHLH137轉錄因子氨基酸序列與其他物種bHLH類轉錄因子氨基酸序列進行BLAST比對,結果顯示,茶樹與獼猴桃(A.deliciosa)、藍莓(V.corymbosum)、葡萄(V.vinifera)等物種的bHLH類轉錄因子相似性為61.86%(圖2,B)。
2.4 茶樹CsbHLH137轉錄因子氨基酸組成及理化性質分析
運用ExPASy網站對茶樹、擬南芥和獼猴桃等13個物種bHLH137轉錄因子蛋白的組成成分和理化性質進行分析[25]。由表1可知,bHLH137轉錄因子蛋白相對分子量在31.77~40.63 kD之間,蛋白殘基數為286~364之間,理論等電點pI為5.59~8.75,茶樹CsbHLH137轉錄因子蛋白平均疏水性約為-0.728。不同植物中各氨基酸種類所占比例不同,其中堿性氨基酸所占比例普遍高于酸性氨基酸,脂肪族氨基酸高于芳香族氨基酸,總平均疏水性(Grand average of hydropathicity)均為負值,不同物種bHLH137轉錄因子蛋白理化性質相近且屬于親水性蛋白。利用NetPhos 2.0對CsbHLH137蛋白磷酸化位點進行預測,結果表明,該多肽鏈0.5以上分值的氨基酸位點為20個,其中包含17個絲氨酸(S)和3個蘇氨酸(T)磷酸化位點。
2.5 茶樹CsbHLH137轉錄因子蛋白亞細胞定位預測、氨基酸親疏水性及無序化結構分析
利用Cell-PLoc 2.0對茶樹CsbHLH137轉錄因子蛋白亞細胞定位預測,結果顯示CsbHLH137轉錄因子蛋白主要定位于細胞核。由此推斷,茶樹CsbHLH137轉錄因子蛋白主要在細胞核中發揮生物學作用。CsbHLH137轉錄因子蛋白氨基酸序列的親水性和疏水性分析結果顯示,該轉錄因子疏水性最強的位點是第199位谷氨酰胺(Gln),其次是第253位丙氨酸(Ala);親水性最強的是第142位賴氨酸(Lys),其次為第103位精氨酸(Arg)和第104位賴氨酸(Lys);大部分氨基酸屬于親水性氨基酸。總平均疏水性為負值,表明CsbHLH137轉錄因子蛋白屬于親水性蛋白。利用FoldIndex對CsbHLH137轉錄因子進行氨基酸序列折疊無序化分析,結果表明,該轉錄因子存在4個氨基酸無序化區域,最長無序區數目為116,共包含206個氨基酸,無序化比例為60.59%,無序化特征明顯(圖3)。
2.6 茶樹CsbHLH137轉錄因子信號肽、跨膜結構、二級和三級結構預測與分析
經信號肽預測分析可知,CsbHLH137轉錄因子mean S-score的值小于0.5,表明CsbHLH137轉錄因子蛋白不存在信號肽序列,可能不屬于分泌蛋白。利用Tmpred在線網站進行跨膜結構預測,結果顯示,CsbHLH137轉錄因子蛋白TM-螺旋長度在17~33之間,不存在由內至外螺旋和由外至內螺旋,由此推測CsbHLH137轉錄因子屬于非跨膜蛋白,沒有跨膜區域。
對茶樹CsbHLH137轉錄因子二級結構進行預測,該轉錄因子的組成為α-螺旋有81個氨基酸,占比23.82%;延伸主鏈有39個氨基酸,占比11.47%;β-折疊有10個氨基酸,占比2.94%;隨機卷曲有210個氨基酸,占比61.76%。因此,CsbHLH137轉錄因子主要由α-螺旋和隨機卷曲組成,α-螺旋、延伸主鏈和隨機卷曲貫穿于整個氨基酸鏈,β-折疊主要分布在氨基酸鏈的第170個氨基酸之后。采用Swiss-Model對CsbHLH137轉錄因子進行蛋白質三級結構建模分析,推測為同源二聚體,MITF/CLEAR box結構。其HLH結構域含有2個α-螺旋和3個β-折疊(圖4),該轉錄因子三級結構以隨機卷曲和α-螺旋為主,推測結果與二級結構相吻合。
2.7 茶樹CsbHLH137轉錄因子蛋白相互作用網絡
利用STRING在線網站,通過比對,以擬南芥AtbHLH137轉錄因子為模板構建了茶樹CsbHLH137轉錄因子的蛋白相互作用網絡。結果發現,CsbHLH137轉錄因子與光敏色素E(phytochrome E,PYE)作用較為直接,與R2R3-MYB基因家族轉錄因子MYB60存在共同表達的關系,同時與MYB轉錄因子MYB117、MYB105和MYB110關系密切。另外,二氫黃酮醇還原酶DFR與MYB轉錄因子MYB60、MYB89、MYB105、MYB110和MYB117構成一個復雜的蛋白互作網絡,調控的轉錄網絡可能在調節生物鐘介導的生理反應中發揮重要作用(圖5)。
2.8 不同時間點茶樹葉片氣孔開度及光合參數分析
不同時間點茶樹葉片的氣孔開度不同(圖6)。與對照0 h相比,2 h和12 h顯著促進葉片的氣孔開度,分別高于對照34.99%和21.97%,4 h和18 h氣孔開度顯著降低,分別低于對照16.7%和17.95%。施加光照的12 h中,氣孔開度呈現先上升后下降的趨勢,在2 h的氣孔開度為光照處理下的最大氣孔開度。黑暗處理的12 h中,氣孔開度呈現先下降后上升的趨勢,在18 h的氣孔開度為黑暗處理下的最小氣孔開度。從表2可以看出,相較黑暗處理,光照處理對茶樹葉片氣孔開度的影響在調節氣孔寬度方面更為明顯。凈光合速率(Pn)、氣孔導度(Gs)、胞間CO2濃度(Ci)和蒸騰速率(Tr)是反映植物葉片光合作用最主要的指標。如圖7所示,茶樹葉片Pn、Gs和Tr均在4 h顯著下降達到最低值,分別為對照的0.06、0.11和0.13倍,Ci在2 h顯著下降達到最低,為對照的0.08倍。整體來看Gs、Ci和Tr在白天波動較大,從0 h開始顯著降低,出現最低值后顯著升高,之后在夜間維持較穩定狀態,無顯著變化。
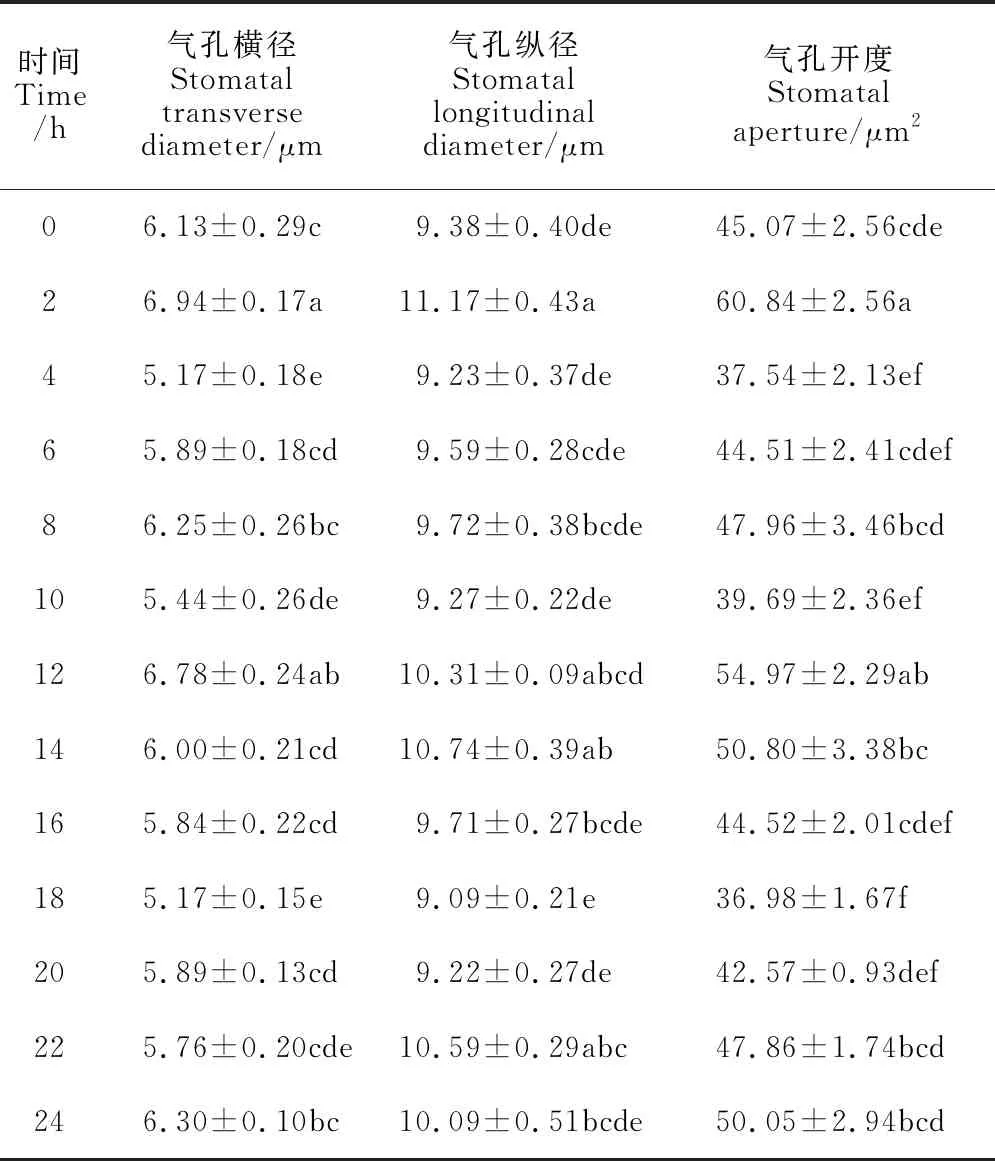
表2 不同時間點對茶樹葉片氣孔開度的影響
2.9 茶樹CsbHLH137轉錄因子基因的表達分析
采用實時熒光定量PCR技術檢測CsbHLH137轉錄因子基因在茶樹的表達水平(圖8)。CsbHLH137轉錄因子基因在一個生物鐘周期中均有表達,在0、6和24 h的表達量顯著高于其他時間段。在光照12 h/黑暗12 h條件下24 h內不同時間點CsbHLH137轉錄因子基因的動態檢測結果顯示,從0 h開始施加光照該基因的表達量降低,4 h的基因表達量為對照的0.23倍,從4 h開始表達量顯著升高,在6 h達到最高值,之后下降,到16 h時降到最低水平,16 h的基因表達量為對照的0.14倍;進入黑夜后基本維持平穩的低表達水平,后隨時間發生改變,在22 hCsbHLH137表達量顯著提高,24 h的基因表達量為對照的0.84倍。從不同時間節點來看,在黑夜進入白天的分界點0 hCsbHLH137表達量最高。結果表明CsbHLH137轉錄因子基因在白天表達量高,在光照后6 h出現一個峰值,之后呈下降趨勢,夜間表達量最低,整體表達呈節律性變化。
3 討 論
3.1 植物中的轉錄因子及與生物鐘調控
植物生物鐘振蕩器以大約24 h的固有周期運行,植物生理節律如氣孔開度控制和光合作用的一個主要來源是轉錄本積累的晝夜節律調節,它影響到大約40%的擬南芥基因[26-29]。轉錄因子家族的節律性表達廣泛地參與晝夜節律的調節,如MYB、bHLH和bZIP轉錄因子家族[30]。一直以來,晝夜節律機制相關的大多數分子成分在細胞核中作為轉錄調節因子發揮作用[31-32]。另外轉錄因子與植物生長發育和逆境脅迫響應密切相關[33-35]。
3.2 CsbHLH137與赤霉素GA信號傳導
植物經歷兩種不同的生長發育過程,這取決于它們是在黑暗中生長(暗形態建成)還是在光存在下生長(光形態建成),這兩條途徑之間的過渡受到嚴格監管。來自擬南芥的研究表明,赤霉素GA是調節光形態發生的主要激素[36]。擬南芥AtbHLH137是GA信號傳導途徑關鍵基因RGA的下游靶基因,參與GA介導的發育過程調控[37]。DELLA蛋白是GRAS轉錄調控因子的一個亞家族,通過負調控赤霉素信號來抑制GA介導的反應[38]。AtbHLH137基因受到DELLA蛋白的強烈調控,DELLA蛋白誘導AtbHLH137轉錄因子作為GA信號的阻遏因子[17]。
3.3 CsbHLH137蛋白結構與互作
茶樹CsbHLH137轉錄因子和其他多個物種進行序列比對,均存在HLH結構域,且一致性高達61.86%,說明茶樹CsbHLH137轉錄因子基因在進化過程中相對保守。采用Swiss-Model對CsbHLH137轉錄因子進行蛋白質三級結構建模分析,其HLH結合域推測為同源二聚體,MITF/CLEAR box結構。在擬南芥中,AtbHLH137轉錄因子可以單獨或作為異源二聚體成為GA信號的阻遏因子,茶樹CsbHLH137轉錄因子因具有與其相似的結構域可能行使相同的功能[37]。
蛋白相互作用網絡分析結果表明CsbHLH137轉錄因子與光敏色素作用較為直接,研究表明紅光受體的作用與生物鐘之間的直接聯系已經建立[39]。一方面,光敏色素介導光信號向核心時鐘的傳遞機制已確立;另一方面,大多數光調控過程都是由時鐘調制的,這說明了光和時鐘信號通路之間復雜的相互作用[40-43]。此外,研究表明植物晝夜節律的核心調控成分是主要由MYB相關轉錄因子組成[3]。CsbHLH137轉錄因子與MYB基因家族轉錄因子MYB60存在共同表達的關系,同時與其他MYB轉錄因子關系密切,表明CsbHLH137可能在生物鐘介導的各種過程中發揮重要作用。
3.4 CsbHLH137基因表達與生物鐘
本研究表明,茶樹CsbHLH137轉錄因子基因在白天的表達量高且出現峰值,在夜間維持平穩的低表達水平,推測茶樹CsbHLH137轉錄因子基因受到DELLA蛋白的調控,DELLA蛋白誘導CsbHLH137轉錄因子作為GA信號的阻遏因子調控光形態發生。研究表明DELLA蛋白的表達符合晝夜節律,其表達在白天達到高峰,在晚上表達水平較低[44]。DELLA蛋白受光控制,它的光調節為在一系列環境光條件下實施生長抑制[37]。相對于夜間,DELLA蛋白在白天更穩定,DELLA蛋白與GA受體蛋白的相互作用可以被核心時鐘蛋白GI抑制,GI可以在光照條件下結合和穩定DELLA蛋白,調節DELLA蛋白的日節律積累模式[45-46]。通過對比茶樹CsbHLH137轉錄因子基因在晝夜節律中的表達特性,推測CsbHLH137轉錄因子基因為DELLA蛋白的應答基因,在光照條件下DELLA蛋白表達水平高導致CsbHLH137表達上調并出現峰值,在黑暗條件下DELLA蛋白表達較低導致CsbHLH137夜間表達維持低水平狀態。相較黑暗處理,光照處理在調節茶樹葉片氣孔寬度方面更為明顯,光合參數Gs、Ci和Tr在白天波動較大,夜間維持較穩定狀態的結果與CsbHLH137轉錄因子基因節律性表達情況相符,一定程度上表明,CsbHLH137轉錄因子基因可能受到DELLA蛋白調控,參與光形態建成。
本研究克隆了CsbHLH137轉錄因子基因并分析了其生物鐘的表達情況,分析了茶樹CsbHLH137轉錄因子基因對晝夜節律的響應,初步推測CsbHLH137轉錄因子基因作為DELLA蛋白應答基因參與茶樹的光形態建成,但其在茶樹中可能存在的作用機制仍需要進一步深入研究。

