基于Nrf2/ARE信號通路研究姜葉三七揮發油對氧化低密度脂蛋白誘導人臍靜脈內皮細胞損傷的保護作用
劉新燕 王羽 尚峰 孫建翔 王敏慧 徐勤
中醫藥在防治心血管疾病方面具有獨特的優勢。姜科植物大多為多年生草本,具有芳香性,包含很多著名的藥材和香料植物[1]。姜葉三七[Stahlianthusinvolucratus(King ex Bak.) Craib]又名土田七,為姜科植物姜葉三七的干燥塊根,具有活血化瘀、消腫止痛、止血散瘀的功效[2]。姜葉三七揮發油(Essential oil fromStahlianthusinvolucratusrhizomes, EOSIR)是從姜葉三七干燥塊根中提取制備的一種油狀液滴,主要成分包括單萜類、倍半萜類、酯類和芳香烴類化合物等。本課題組前期研究表明,EOSIR對損傷的內皮細胞具有很好的療效。但目前對于姜葉三七及其主要有效成分揮發油在治療心血管方面的藥理作用研究在國內外未見報道。因此,本實驗將繼續深入探討其在治療動脈粥樣硬化方面的藥效及其作用機制。
近年來,核因子E2相關因子2(nuclear factory erythroid-2 related, Nrf2)/抗氧化反應元件(antioxidant response element, ARE)信號通路一直是研究的焦點,是機體最為重要的內源性抗氧化應激和防御信號通路[3-6]。當機體處于生理狀態時,細胞內的Nrf2被Keap1蛋白結合在細胞質中,使Nrf2處于一種非游離狀態并且不斷降解的非活性低水平狀態。當受到親電試劑的刺激或處于氧化應激條件下,細胞內的Nrf2解除偶聯[7],游離出Nrf2在細胞質中積累并轉移進入細胞核與ARE相互結合,激活細胞保護基因,發揮保護細胞的作用[8-9]。
本實驗在EOSIR對血管內皮功能調控作用的基礎上,提出EOSIR可通過Nrf2/ARE信號通路保護血管內皮損傷作用及其機制的假說,應用氧化低密度脂蛋白(oxidized low-density lipoprotein, ox-LDL)誘導血管內皮細胞建立氧化損傷模型,運用流式細胞術及實時熒光定量PCR(real-time quantitative PCR,RT-qPCR)、蛋白免疫印跡法(Western blot, WB)等現代分子生物學技術,探討姜葉三七揮發油對損傷的血管內皮保護作用及其機制,旨在為姜葉三七資源的合理利用和開發提供一定科學依據。
1 材料與方法
1.1 細胞株
人臍靜脈內皮細胞(human umbilical vein endothelial cells,HUVECs)購自上海奧陸生物科技有限公司。
1.2 實驗藥物
氧化低密度脂蛋白(大連美侖生物技術有限公司,批號:MB12474);阿司匹林標準品(中國藥品生物制品檢定所,批號:100113-201706);姜葉三七(南寧神能堂保健品科技有限公司,批號:110516),經廣西中醫藥研究院賴茂祥教授鑒定。
1.3 實驗試劑
人乳酸脫氫酶試劑盒,批號:A02022;總超氧化物歧化酶測定試劑盒,批號:A00132;丙二醛(malondialdehyde,MDA)測定試劑盒,批號:A00312;谷胱甘肽過氧化酶(glutathione peroxidase,GSH-Px)測定試劑盒,批號:A00512;一氧化氮(nitric oxide,NO)測定試劑盒,批號:01212;過氧化氫酶(catalase,CAT)測定試劑盒,批號:A00711;以上均購自南京建成生物工程研究所。Annexin V FITC Apoptosis Kit凋亡檢測試劑盒(美國BD公司,批號:556547);活性氧測定試劑盒(碧云天生物技術研究所,批號:S0033S);線粒體膜電位檢測試劑盒(JC-1,南京固與生物有限公司,批號:GY22202);Hoecgst33342細胞凋亡染色試劑(碧云天生物技術公司;批號:C1026);Nrf2(批號:12721)NQO1(批號:62262S)HO-1(批號:43966)BAX(批號:5023)BCL-2(批號:3498)兔抗人單克隆抗體,二抗羊抗鼠IgG(批號:7076)羊抗兔IgG(批號:7074);以上均購自Cell signaling公司。
1.4 實驗儀器
氣相色譜—質譜聯用儀(美國安捷倫公司,型號:Agilent 6890NGC -5975MS);倒置熒光相差顯微鏡(日本Olympus公司,型號:IXTIFL);流式細胞儀(美國Becton Dickinson公司,型號:FACSAria III);Multiskan FC型酶聯免疫檢測儀(美國Thermo Scientifc);7500Fast Real-Time PCR system(美國ABI公司);GENE GENIUS凝膠成像系統(上海天能科技有限公司)。
1.5 EOSIR的提取與成分測定
1.5.1 EOSIR的提取 取姜葉三七干燥塊莖切碎,采用水蒸氣蒸餾法提取,收集得橘黃色揮發油,出油率為3.78%。
1.5.2 GC-MS聯用技術測定EOSIR成分 氣相色譜條件:VF-WAXMS(30 m×250 μm,1.0 μm)。采用程序升溫,初始溫度為50℃,以該溫度保持3分鐘,然后以4℃/min升溫至150℃,保持5分鐘,再以4℃/min升至235℃,保持10分鐘。載氣為高純度氮氣,載氣流量:1.0 mL/min,分流比100∶1。進樣口溫度:200℃。進樣量:0.5 μL。
質譜條件:EI電離:70 eV;離子源溫度:230℃,四極桿溫度:150℃。傳輸線溫度:230℃;掃描質量范圍m/z:40~550 amu。溶劑延遲:3.0分鐘。圖譜檢索庫為NIST2012年版標準質譜圖庫。
1.6 ox-LDL誘導HUVECs損傷模型的建立
取對數生長期HUVECs按細胞密度為4×104個/mL接種于96孔板中,貼壁培養24小時后,加入50、100、200、300 μg/mL的ox-LDL,繼續培養24小時或48小時后,采用MTT法檢測細胞存活率。實驗重復3次。根據細胞存活率選取ox-LDL濃度為200 μg/mL,時間為24小時作為模型組的造模條件。
1.7 EOSIR對ox-LDL誘導HUVECs損傷模型的作用
細胞操作方法同1.6,貼壁培養24小時后分為4組:空白對照組、模型組、EOSIR給藥組、阿司匹林組。空白對照組不加任何藥物處理,其余每孔加入200 μg/mL的ox-LDL繼續孵育24小時建立氧化損傷模型;棄掉損傷液,空白對照組和模型組加入完全培養液,其他組加入不同濃度的EOSIR(0.01、0.05、0.10、0.30、0.50 μg/mL)和阿司匹林(0.05 μg/mL)繼續培養24小時,采用MTT法檢測細胞存活率。實驗重復3次。
1.8 指標檢測
1.8.1 Hoechst33342染色試驗 取對數生長期的HUVECs按細胞密度為3×104個/mL接種于24孔板,貼壁培養24小時后,分別用50、100、200、300 μg/mL的ox-LDL損傷24小時,接下來再用0.01、0.05、0.10 μg/mL的EOSIR處理24小時,用4%多聚甲醛固定30分鐘,Hoechst 33342染色液室溫避光染色5分鐘,在倒置熒光顯微鏡下觀察并拍照。
1.8.2 ELISA法檢測MDA、LDH、SOD、CAT、GSH-Px的含量 取對數生長期的HUVECs細胞按2×105個/mL接種于6孔細胞培養板,用200 μg/mL的ox-LDL損傷24小時,再用0.01、0.05、0.10 μg/mL的EOSIR處理24小時,收集細胞培養基和細胞裂解液,采用ELISA法檢測MDA、LDH、SOD、CAT、GSH-Px的含量。實驗重復3次。
1.8.3 JC-1染色檢測線粒體膜電位的變化 HUVECs用200 μg/mL的ox-LDL損傷24小時,用0.01、0.05、0.10 μg/mL的EOSIR處理24小時,給藥處理后每孔加入500 μL細胞培養液,再加入500 μL 的JC-1染色工作液,充分混勻,在培養箱中孵育20分鐘,1×JC-1染色緩沖液洗滌2次,加入2 mL細胞培養液,在倒置熒光顯微鏡下觀察并拍照。
1.8.4 活性氧(reactive oxygen species,ROS)含量測定 HUVECs用200 μg/mL的ox-LDL損傷24小時,再用0.01、0.05、0.10 μg/mL的EOSIR處理24小時,用0.25%胰酶消化細胞,收集到1.5 mL的EP管中;1000 r/min離心5分鐘,將細胞重懸于DCFH-DA中,培養箱內孵育20分鐘;用無血清細胞培養液洗滌細胞3次;用500 μL的PBS重懸細胞,過200目細胞篩,收集于流失管內,上機檢測。實驗重復3次。
1.8.5 細胞凋亡的檢測 HUVECs用200 μg/mL的ox-LDL損傷24小時,再用0.01、0.05、0.10 μg/mL的EOSIR處理24小時后,收集貼壁細胞及漂浮細胞到1.5 mL的EP管中;1000 r/min離心5分鐘,用500 μL的1×Bingding buffer重懸細胞;加入5 μL Annexin-V混勻,再加入5 μL PI混勻;室溫靜置15分鐘,200目濾網過濾細胞,收集于流式管內,上機檢測。實驗重復3次。
1.8.6 RT-qPCR檢測目的基因的mRNA表達水平 HUVECs用200 μg/mL的ox-LDL損傷24小時,再用0.01、0.05、0.10 μg/mL的EOSIR處理24小時后,用Trizol試劑提取總RNA,FastKing一步法除基因組cDNA第一鏈合成預混試劑盒將RNA逆轉錄成cDNA,以cDNA為模板,根據SuperReal PreMix Plus試劑盒形成一個20 μL擴增體系,檢測Nrf2、HO1、NQO1、Bcl-2、Bax和GAPDHmRNA的表達。用GAPDH為內參,以2-ΔΔCt方法計算各目的基因mRNA的相對表達量,并記錄數據。實驗重復3次。
1.8.7 WB法檢測目的基因蛋白表達水平的變化 提取蛋白質樣品后,根據蛋白質濃度確定樣品體積。用10% SDS-PAGE凝膠進行電泳,然后恒流轉膜至PVDF膜上;將膜與二抗山羊抗兔和山羊抗小鼠IgG-HRP在4℃孵育1小時。然后使用發光液對印跡進行顯影,并使用凝膠圖像處理系統進行成像。實驗重復3次。
1.9 數據處理
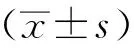
2 結果
2.1 EOSIR成分分析
采用GC-MS技術鑒定EOSIR中揮發性成分,用面積歸一化法測定百分含量,結果見表1。初步鑒定了54種成分,已鑒定揮發油成分占總揮發油含量為98.86%。其中含量最高的是莰烯,占22.38%;其次是α-蒎烯, 占16.11%;居第三位的是D-樟腦,占9.74%;第四位的是3,3,6,6-四甲基-3, 6, 7, 8-四氫化-并茚-1(2H)-酮,占8.41%。

表1 EOSIR成分分析

續表
2.2 EOSIR對正常的HUVECs的影響
EOSIR的濃度在小于等于60 μg/mL時,對正常HUVECs細胞的存活率沒有抑制,說明此濃度范圍的EOSIR對細胞沒有毒性。但當濃度大于等于80 μg/mL時,HUVECs細胞的存活率顯著性下降(P<0.01),說明此濃度范圍的EOSIR對細胞有明顯的細胞毒性。見表2。
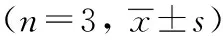
表2 不同濃度EOSIR對正常HUVECs細胞存活率的影響
2.3 ox-LDL誘導HUVECs損傷的量效—時效關系
與空白對照組相比,隨著ox-LDL濃度和時間的增加,HUVECs的存活率明顯下降(P<0.01)。當ox-LDL濃度達到200 μg/mL時,24小時后細胞存活率下降至54.32%(P<0.01),我們選擇細胞的半數致死量作為造模條件,故以此作為最佳造模條件。見表3。
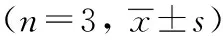
表3 ox-LDL誘導HUVECs損傷的量效—時效關系
2.4 EOSIR對ox-LDL誘導HUVECs損傷存活率的影響
實驗結果提示,ox-LDL能明顯降低HUVECs細胞存活率(P<0.01);但當給藥EOSIR和阿司匹林后,均能顯著提高細胞的OD值和存活率(P<0.05或P<0.01),其中,0.05 μg/mL的EOSIR將ox-LDL處理的HUVECs活力顯著提高(P<0.01),表明EOSIR能抑制ox-LDL誘導的細胞存活率降低。見表4。
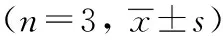
表4 MTT法分析EOSIR與阿司匹林對ox-LDL誘導HUVECs損傷的影響
根據實驗結果,接下來的實驗選擇EOSIR低、中、高劑量組分別為0.01、0.05、0.10 μg/mL。
2.5 EOSIR對ox-LDL誘導HUVECs損傷LDH、MDA、NO、SOD、CAT、GSH-Px含量的影響
與空白對照組相比,模型組的LDH、MDA含量顯著增加(P<0.05或P<0.01),NO、SOD、CAT和GSH-Px的含量顯著下降(P<0.01)。EOSIR處理的HUVECs中SOD活性顯著增加(P<0.01),MDA含量顯著降低(P<0.01)。其中0.1 μg/mL的EOSIR使CAT和GSH-Px活性增加最明顯(P<0.01)。0.05 μg/mL的EOSIR使HUVECs中LDH釋放降低(P<0.01),NO含量增加(P<0.01),CAT和GSH-Px活性增加最明顯(P<0.01)。見表5、表6、表7。
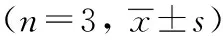
表5 EOSIR對HUVECs損傷LDH外漏量和MDA含量的影響
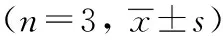
表6 EOSIR對HUVECs損傷NO和SOD含量的影響
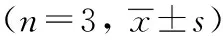
表7 EOSIR對HUVECs損傷CAT和GSH-Px含量的影響
2.6 EOSIR對ox-LDL誘導HUVECs細胞凋亡的影響
空白對照組中的HUVECs顯示出均勻的弱熒光。與空白對照組相比,ox-LDL在HUVECs中誘導了嚴重的功能障礙和細胞凋亡。細胞呈現強烈的藍色熒光,表明廣泛的核損傷和碎裂、細胞質濃縮和細胞體積迅速減少。相比之下,EOSIR和阿司匹林處理后,細胞藍色熒光強度不同程度下降,細胞形態逐漸恢復正常,核損傷減輕。見圖1。

圖1 各藥物對ox-LDL損傷的HUVECs保護作用形態學觀察
使用Annexin V-FITC/PI標記結合流式細胞術檢測EOSIR對ox-LDL誘導的HUVECs凋亡的影響。正常情況下內皮細胞凋亡率約為11.73%,ox-LDL組內皮細胞凋亡率較空白對照組為27.93。0.05 μg/mL EOSIR處理后細胞凋亡率顯著下降(P<0.01),表明EOSIR減少了ox-LDL誘導的HUVEC細胞凋亡。見表8。

表8 EOSIR對ox-LDL誘導HUVECs細胞凋亡率的影響
2.7 EOSIR對ox-LDL誘導HUVECs氧化應激的影響
與空白對照組相比,200 μg/mL ox-LDL處理24小時使HUVECs內ROS顯著增加(P<0.01)。當用0.05 μg/mL的EOSIR處理24小時后,ROS水平顯著降低(P<0.05)。見表9。

表9 EOSIR對ox-LDL誘導HUVECs細胞內ROS的影響
2.8 EOSIR對HUVECs線粒體依賴性細胞凋亡的影響
空白對照組的MMP維持在正常水平,形成了以紅色熒光為主的JC-1聚合物。Ox-LDL處理HUVECs后,MMP降低并且形成具有增強的綠色熒光和減弱的紅色熒光的JC-1單體。在EOSIR處理的HUVECs中,綠色熒光強度降低,紅色熒光強度增加。此外,ox-LDL顯著降低Bcl-2 mRNA和蛋白質的表達(P<0.01),并增加細胞中Bax mRNA和蛋白質的表達(P<0.01)。這種趨勢在EOSIR治療后被逆轉(P<0.05或P<0.01)。EOSIR通過增加Bcl-2 mRNA和蛋白質以及降低Bax mRNA和蛋白質發揮抗凋亡作用。見圖2,表10、表11。

表10 EOSIR對ox-LDL誘導HUVECs的Bax、Bcl-2 mRNA表達的影響

圖2 各藥物對ox-LDL損傷HUVECs線粒體膜電位的影響

表11 EOSIR對ox-LDL誘導HUVECs的Bax、Bcl-2蛋白表達的影響
2.9 EOSIR對ox-LDL誘導HUVECs的Nrf2、HO-1和NQO1表達的影響
與空白對照組相比,ox-LDL導致Nrf2、HO-1和NQO-1 mRNA和蛋白質水平顯著降低(P<0.01)。用不同濃度的EOSIR和阿司匹林處理24小時后,Nrf2、NQO1和HO-1蛋白的表達增強(P<0.05或P<0.01),表明EOSIR能抑制ox-LDL誘導的損傷。見表12、表13。

表12 EOSIR對ox-LDL誘導HUVECs的Nrf2、HO-1、NQO-1 mRNA表達的影響

表13 EOSIR對ox-LDL誘導HUVECs的Nrf2、HO-1、NQO-1蛋白表達的影響
3 討論
3.1 EOSIR對ox-LDL誘導HUVECs損傷的保護作用
ox-LDL是破壞血管內皮細胞抗氧化和分泌活性功能,引起氧化應激、發生線粒體功能障礙,誘導內皮細胞凋亡的主要危險因子,被認為是血管內皮細胞損傷的重要危險因素[10-11]。本實驗中采用ox-LDL誘導HUVECs建立氧化損傷模型,然后給藥EOSIR,發現EOSIR給藥后能抑制ox-LDL誘導的細胞毒性,增加細胞存活率,并且相同濃度下的EOSIR對正常的HUVECs沒有細胞毒性。同時通過Hoechst 33242熒光染色發現ox-LDL作用HUVECs后出現明顯的細胞損傷形態學變化,細胞的體積變小,細胞呈濃縮致密的強藍色熒光。經過EOSIR處理后細胞數量明顯增加,細胞藍色熒光強度減弱,細胞體積也恢復正常。表明EOSIR對損傷的內皮細胞具有保護作用。
3.2 EOSIR對ox-LDL誘導HUVECs氧化應激的影響
CAT和GSH-Px在維持細胞內信號對氧化還原調節以及消除過氧化氫方面起著重要的作用[12-13]。本研究發現,當暴露于ox-LDL時HUVECs細胞脂質過氧化加劇,細胞膜受損,胞漿中的LDH就會迅速釋放到培養基中,同時ROS和MDA的含量顯著增加。相反,NO、SOD、CAT和GSH-Px的活性則顯著下降,這些結果與Geng等[14]的發現一致。當用EOSIR處理后,HUVECs中MDA的含量降低,NO的分泌增加,SOD、CAT和GSH-Px的含量也增加,并進一步降低了ROS的含量。這表明EOSIR通過清除自由基和增強抗氧化酶的活性來發揮抗氧化作用。同時,清除循環中的ROS和提高抗氧酶的活力是防止動脈粥樣硬化的關鍵[15-16]。
3.3 EOSIR對ox-LDL誘導HUVECs細胞凋亡的影響
JC-1染色發現正常培養的HUVECs表現出微弱的綠色熒光,以紅色熒光為主。經ox-LDL誘導HUVECs細胞后出現綠色熒光增強、紅色熒光降低的現象,表現出線粒體膜電位的降低,這是線粒體損傷加重的一個重要指標[17-18],與Liu等[19]觀察結果相一致。經EOSIR處理后能夠逆轉線粒體膜電位的喪失,表明EOSIR能夠通過恢復線粒體膜電位來減少線粒體功能障礙,防止內皮功能障礙。
另外,課題組發現ox-LDL能誘導HUVECs細胞凋亡數目的增加,同時能誘導HUVECs細胞中Bcl-2基因和蛋白表達的減少,以及Bax基因和蛋白表達的增加。當用不同濃度的EOSIR治療后可以逆轉這種變化,表明EOSIR可能通過抑制線粒體功能障礙相關的細胞凋亡信號通路來發揮保護作用。
3.4 EOSIR對Nrf2/ARE信號通路的影響
據文獻報道,許多植物化學物質可以通過上調Nrf2/ARE的激活來保護心血管的正常功能[20]。本研究發現,ox-LDL作用于HUVECs后,細胞的Nrf2、NQO1、HO-1的mRNA和蛋白表達顯著降低,用EOSIR處理后可上調游離Nrf2的mRNA和蛋白表達以及其下游靶基因HO-1和NQO1的mRNA和蛋白表達。表明EOSIR處理上調Nrf2核轉位及其下游靶HO-1、NQO1的表達來發揮其抗氧化損傷的作用。
綜合以上實驗結果,EOSIR具有對ox-LDL誘導HUVECs細胞損傷的抗氧化和細胞保護作用。EOSIR能夠顯著抑制ox-LDL誘導HUVECs引起的氧化應激,抑制線粒體功能障礙引起的細胞凋亡,同時能夠激活Nrf2以及其下游的抗氧化蛋白酶HO-1、NQO1的表達來發揮對ox-LDL誘導HUVECs損傷的保護作用。同時,以阿司匹林標準品作為陽性對照藥[21],能更加可靠地說明EOSIR的療效,以及能清楚地反映EOSIR對ox-LDL誘導內皮細胞損傷的保護作用。該結果為EOSIR的藥理作用提供了科學的實驗依據,對豐富中醫藥防治動脈粥樣硬化方案有現實意義。

