免舉宮技術(shù)應(yīng)用于早期宮頸癌腹腔鏡手術(shù)的可行性分析
趙犁梅,王嬌楊,朱炳鴻,孫丙輝,王小元
(1.山東大學(xué)齊魯醫(yī)學(xué)院,山東 濟(jì)南,250012;2.山東第一醫(yī)科大學(xué)第一附屬醫(yī)院 山東省千佛山醫(yī)院婦產(chǎn)科;3.山東第一醫(yī)科大學(xué))
子宮頸癌居女性惡性腫瘤發(fā)病率的第四位,全球范圍內(nèi)每年新發(fā)病例約604 000例,死亡病例約342 000例[1],嚴(yán)重威脅女性的生命健康。自1992年首例腹腔鏡宮頸癌根治術(shù)成功完成后,宮頸癌的腹腔鏡治療日益成熟[2]。既往較多研究證實,相較開腹手術(shù),腹腔鏡手術(shù)具有解剖層次分明、術(shù)中出血少、患者痛苦小、術(shù)后住院時間短等優(yōu)勢,其安全性、有效性與開腹手術(shù)差異無統(tǒng)計學(xué)意義[3]。腹腔鏡早期宮頸癌根治術(shù)已逐漸成為醫(yī)生及患者的首選。2018年10月新英格蘭醫(yī)學(xué)雜志發(fā)表的兩篇文章[4-5]顯示,與開腹手術(shù)相比,腹腔鏡宮頸癌根治術(shù)具有較高的復(fù)發(fā)率、較低的無瘤生存率。國內(nèi)外專家認(rèn)為,可能系腹腔鏡手術(shù)中應(yīng)用舉宮器及CO2氣腹下離斷陰道斷端造成腫瘤播散引起的[6]。腹腔鏡存在開腹沒有的優(yōu)勢,摒棄先進(jìn)的腹腔鏡手術(shù)平臺,是一種本末倒置[7-8]。基于此,本研究擬探討免舉宮技術(shù)應(yīng)用于早期宮頸癌腹腔鏡手術(shù)中的可行性。
1 資料與方法
1.1 臨床資料 收集2015年11月至2018年11月山東大學(xué)附屬千佛山醫(yī)院婦科行腹腔鏡下早期宮頸癌根治術(shù)及2018年11月至2021年11月應(yīng)用免舉宮技術(shù)行腹腔鏡早期宮頸癌根治術(shù)的患者,將其分為實驗組(免舉宮組,n=38)與對照組(舉宮組,n=26),患者均無生育要求。本研究已通過醫(yī)院醫(yī)學(xué)倫理委員學(xué)會審核與批準(zhǔn)。
1.2 納入與排除標(biāo)準(zhǔn) 納入標(biāo)準(zhǔn):(1)陰道鏡檢查或?qū)m頸錐切病理證實為宮頸癌;(2)婦科檢查及影像學(xué)檢查均提示無宮旁組織、陰道壁及淋巴結(jié)轉(zhuǎn)移;(3)病理類型為鱗癌、腺癌、腺鱗癌,國際婦產(chǎn)科聯(lián)合會(international federation of gynecology and obstetrics,F(xiàn)IGO)分期(2018年)為ⅠB1~ⅠB2期;(4)無子宮次全切手術(shù)史;(5)均由同一手術(shù)主刀施術(shù);(6)有定期隨訪資料。排除標(biāo)準(zhǔn):(1)有血液系統(tǒng)、免疫系統(tǒng)、心血管系統(tǒng)等嚴(yán)重疾病,無法耐受手術(shù)及麻醉;(2)合并其他惡性腫瘤;(3)生殖系統(tǒng)嚴(yán)重畸形或其他系統(tǒng)畸形;(4)重度感染;(5)子宮大于如孕12周;(6)機(jī)器人手術(shù)。
1.3 手術(shù)方法 實驗組:雙極電凝雙側(cè)輸卵管峽部,1-0可吸收線分別縫合雙側(cè)子宮角外側(cè),宮底部打結(jié)(圖1),于恥骨聯(lián)合上方1~2 cm中線處切開皮膚約0.5 cm,穿刺Trocar,放置持針器鉗夾子宮底部線結(jié),前后左右牽拉擺動子宮(圖2),暴露手術(shù)視野。按手術(shù)步驟行腹腔鏡下根治性子宮切除術(shù)(C2型)、雙側(cè)輸卵管切除術(shù)、雙側(cè)或單側(cè)卵巢切除術(shù)、盆腔淋巴結(jié)切除術(shù)、腹主動脈旁淋巴結(jié)活檢或切除術(shù),切除淋巴結(jié)立即裝入標(biāo)本袋(圖3)。切開膀胱返折腹膜,下推膀胱至宮頸下方4 cm處。分離兩側(cè)直腸側(cè)窩,切開子宮直腸返折腹膜,游離陰道后壁約4 cm,緊鄰骨盆壁凝固切斷子宮骶主韌帶約3 cm(圖4)。1-0可吸收線自穹隆下方約2 cm處封閉陰道壁(圖5),于縫線下方環(huán)形切開陰道壁,切除子宮及部分陰道(圖6),經(jīng)陰道取出。切除的左、右兩側(cè)淋巴結(jié)及脂肪組織分別裝袋后經(jīng)陰道取出。消毒陰道,陰道拉鉤暴露陰道殘端,1-0可吸收線連續(xù)縫合陰道斷端,盆腔內(nèi)放置T形引流管一根,自陰道內(nèi)引出。蒸餾水及生理鹽水沖洗腹腔,右側(cè)輸尿管入骨盆段放置1片防粘連膜以預(yù)防粘連。縫合腹部切口。對照組:放置舉宮杯。于宮頸下方3 cm處環(huán)形切開陰道壁(圖7),腹腔鏡下連續(xù)縫合陰道斷端。余手術(shù)步驟同實驗組。

圖1 縫合雙側(cè)子宮角外側(cè),宮底部打結(jié) 圖2 持針器鉗夾線結(jié),牽拉擺動子宮

圖3 淋巴結(jié)裝入標(biāo)本袋 圖4 宮旁組織的處理

圖5 封閉陰道壁 圖6 縫線下端切斷陰道壁

圖7 舉宮杯指示下切開陰道壁
1.4 觀察指標(biāo) 比較兩組患者一般資料:年齡、體質(zhì)指數(shù)、病理類型、FIGO分期;術(shù)中情況:手術(shù)時間、術(shù)中出血量、陰道壁切除長度、切除淋巴結(jié)數(shù)量;術(shù)后情況:拔除尿管時間(術(shù)后拔除尿管時機(jī):自主排尿后插入導(dǎo)尿測膀胱殘余尿量<150 mL)、肛門排氣時間、術(shù)后住院時間、并發(fā)癥等。
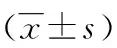
2 結(jié) 果
兩組患者年齡、體質(zhì)指數(shù)、病理類型、FIGO分期差異無統(tǒng)計學(xué)意義(P>0.05),見表1。兩組手術(shù)時間、術(shù)中出血量、陰道壁切除長度、切除淋巴結(jié)數(shù)量、術(shù)后拔除尿管時間、術(shù)后肛門排氣時間、術(shù)后并發(fā)癥差異無統(tǒng)計學(xué)意義(P>0.05),術(shù)后住院時間差異有統(tǒng)計學(xué)意義(P<0.05),見表2、表3。

表1 兩組患者一般資料的比較

表2 兩組患者術(shù)中情況的比較

表3 兩組患者術(shù)后情況的比較
3 討 論
對于早期宮頸癌,手術(shù)是主要的治療方式,與傳統(tǒng)開腹宮頸癌根治術(shù)相比,腹腔鏡宮頸癌根治術(shù)具有術(shù)中出血少、住院時間短、切口感染率低、痛苦輕、不增加術(shù)中與術(shù)后并發(fā)癥等優(yōu)點[9-10],并且其無瘤生存期、總生存率不低于開腹手術(shù)[11]。2018年及此前的美國國立綜合癌癥網(wǎng)絡(luò)指南中推薦宮頸癌根治術(shù)經(jīng)開腹或腹腔鏡進(jìn)行。然而,2018年美國一項多中心隨機(jī)對照實驗指出,對于早期宮頸癌,與開腹宮頸癌根治術(shù)相比,腹腔鏡手術(shù)具有較低的無瘤生存率、總體生存率,較高的復(fù)發(fā)率與死亡率[5]。同期發(fā)表的另一項回顧性研究也指出,通過對納入美國國家癌癥數(shù)據(jù)庫及美國國家癌癥中心的宮頸癌患者匹配分析顯示,微創(chuàng)組較開腹組具有更高的死亡風(fēng)險[6]。此后,2019年美國國立綜合癌癥網(wǎng)絡(luò)指南明確指出,開腹手術(shù)是根治性子宮切除的標(biāo)準(zhǔn)與經(jīng)典手術(shù)入路。有專家認(rèn)為,腹腔鏡早期宮頸癌手術(shù)的生存結(jié)局較開腹手術(shù)差的其中一項原因為,術(shù)中舉宮器的使用違反了腫瘤的不可擠壓原則,術(shù)中陰道切緣需距腫瘤至少5 mm,不可擠壓、弄破腫瘤組織,否則會造成腫瘤局部擴(kuò)散或使腫瘤細(xì)胞栓進(jìn)入微血管、微淋巴管,導(dǎo)致醫(yī)源性局部或遠(yuǎn)處轉(zhuǎn)移[12]。Uppal等[13]認(rèn)為,舉宮器會將腫瘤細(xì)胞帶入宮腔,同時擠壓使腫瘤細(xì)胞脫落于陰道內(nèi),這些均會增加術(shù)后復(fù)發(fā)的風(fēng)險。國內(nèi)學(xué)者也指出,在腹腔鏡宮頸癌根治術(shù)中,舉宮器需與腫瘤組織直接接觸2~3 h,術(shù)中需不斷地變換方向與位置,配合打開子宮頸周圍間隙、游離輸尿管等操作,不可避免地會對腫瘤組織進(jìn)行擠壓、揉搓,導(dǎo)致腫瘤細(xì)胞進(jìn)入微血管、微淋巴管,造成微小腫瘤細(xì)胞栓轉(zhuǎn)移,從而導(dǎo)致預(yù)后較差。有研究指出,在子宮內(nèi)膜癌(FIGO分期Ⅰ~Ⅱ期)腹腔鏡手術(shù)中,使用舉宮器與更壞的腫瘤結(jié)局密切相關(guān)[14],這進(jìn)一步證實了舉宮器會對腹腔鏡手術(shù)的預(yù)后產(chǎn)生影響。術(shù)中CO2氣腹下離斷陰道,違反了腫瘤的隔離原則、減少腫瘤術(shù)中擴(kuò)散原則、減少癌細(xì)胞污染原則[15],這也是腹腔鏡早期宮頸癌手術(shù)的生存結(jié)局較開腹手術(shù)差的一項原因。在CO2氣腹下,腹腔內(nèi)會暫時缺血、缺氧,從而誘導(dǎo)缺氧誘導(dǎo)因子1α的生成,刺激腫瘤蛋白及基因轉(zhuǎn)錄,導(dǎo)致血管內(nèi)皮生長因子大量生成,癌細(xì)胞在腹腔內(nèi)的生長與轉(zhuǎn)移能力大大增強(qiáng)[16]。離斷陰道時腫瘤細(xì)胞直接暴露在CO2氣腹下,在煙囪效應(yīng)下,腫瘤細(xì)胞會擴(kuò)散至盆腔、腹腔、膈肌下等[17]。有研究表明,CO2氣腹下行陰道斷端的切開與縫合,是子宮頸癌腹腔鏡手術(shù)后復(fù)發(fā)的獨立危險因素[18]。
基于此,本研究中實驗組采用子宮角部縫合、恥骨聯(lián)合上置入持針器牽拉子宮等措施,避免了術(shù)中對腫瘤的直接接觸與壓迫。此外,距病灶2.0 cm縫合陰道壁、鏡下自穹隆下方約2.0 cm處封閉陰道壁,將宮頸及宮頸部位的腫瘤封閉,有效減少了腫瘤暴露術(shù)野的機(jī)會。本研究結(jié)果顯示,兩組手術(shù)時間、術(shù)中出血量、切除淋巴結(jié)數(shù)量、陰道壁切除長度、術(shù)后拔除尿管時間、術(shù)后排氣時間及術(shù)后并發(fā)癥差異均無統(tǒng)計學(xué)意義(P>0.05);實驗組術(shù)后住院時間短于對照組,原因是近期為縮短住院時間,不再按照傳統(tǒng)的拔除尿管后再出院的規(guī)定,而是于術(shù)后5~7 d評估患者恢復(fù)情況,體溫正常即可帶尿管出院,術(shù)后14 d門診拔除尿管。近2年早期宮頸癌根治手術(shù)為遵循無瘤原則,以實驗組手術(shù)為主,術(shù)后住院時間明顯縮短。
綜上所述,腹腔鏡早期宮頸癌根治術(shù)中應(yīng)用免舉宮技術(shù)與傳統(tǒng)腹腔鏡手術(shù)的療效差異無統(tǒng)計學(xué)意義,是安全、可行的。本研究納入的樣本量較少,隨訪時間短,術(shù)后復(fù)發(fā)等指標(biāo)有待開展前瞻性多中心大樣本的隨機(jī)對照實驗進(jìn)行臨床觀察,我們下一步將利用調(diào)查、隨訪等方法對比腹腔鏡免舉宮技術(shù)與開腹早期宮頸癌手術(shù)的無進(jìn)展生存期、總生存期,以進(jìn)一步證實免舉宮技術(shù)的可行性。對于腫瘤醫(yī)師而言,規(guī)范化腫瘤治療原則是基礎(chǔ),應(yīng)客觀全面地分析新技術(shù)中遇到的問題,通過不斷改進(jìn)使其更加安全、有效。

