IL-8在人肺上皮細胞的MUC5B表達及調控通路*
蔣海燕 陳 林 邵 春 肖玉蓉 譚小武
南華大學衡陽醫學院附屬第二醫院呼吸與危重癥醫學科,湖南省衡陽市 421001
慢性阻塞性肺疾病(COPD)是一種氣流受限不完全可逆、進行性發展的疾病,氣道炎癥和黏液高分泌相互影響加速了氣流受限的發展,加重疾病的進程[1]。其氣道黏液的主要成分是黏蛋白5B(MUC5B), MUC5B表達上調是COPD氣道區別于哮喘的特征性表現[2]。白細胞介素8(IL-8)是一種重要的趨化因子,趨化COPD氣道局部的炎性細胞加重氣道炎癥,在一定程度上反映COPD氣道炎癥的嚴重程度[3]。然而IL-8是否對氣道黏液高分泌有作用,是通過什么信號途徑調節MUC5B的表達參與COPD發病目前尚未明確[4-5]。本實驗擬IL-8干預、JAK2/STAT6阻斷劑、MUC5B抑制劑預處理的人氣道上皮細胞,分別檢測IL-8、STAT6、JAK2、MUC5B的表達水平,以明確IL-8對MUC5B的表達調控通路,為篩選COPD黏液高分泌的治療靶點提供新思路。
1 材料及方法
1.1 主要實驗儀器及試劑 KM培養基購自Sciencell;AG490試劑購自APExBIO;NAC溶液(乙酰半胱氨酸)購自美國Sigamags公司;MUC5B-ELISA試劑盒購自武漢華美生物工程有限公司(E16039046);HRP標記的抗鼠IgG、HRP標記的抗兔IgG購自美國proteintech(SA00001-1);IL-8(ab259397)、兔抗人JAK2(ab108509)、p-JAK2(ab3210)、STAT6(ab32520)、p-STAT6(ab263947)多克隆抗體購自英國Abcam公司;β-actin多克隆抗體購自美國proteintech(66009-1-Ig)。
1.2 細胞培養 支氣管黏膜上皮細胞(HBE135-E6E7上海富衡)用 KM 培養液置于37℃、5% CO2及飽和濕度條件下培養,細胞融合至 80%傳代,細胞融合至約70%時進行實驗。
1.3 ELISA(酶聯免疫吸附測定法)測不同濃度和時間組中MUC5B蛋白含量的表達 參照文獻報告和廠家說明書,6皿按照不同IL-8濃度分組,分別分為:A組:空白對照組、B組:IL-8 20ng/ml組、C組:IL-8 40ng/ml組、D組IL-8 60ng/ml組、E組IL-8 80ng/ml組、F組IL-8 160ng/ml組;另5皿按照不同處理時間分組,分別分為A組:空白對照組,B組:IL-8 6h組、C組:IL-8 12h組、D組:IL-8 24h組、E組IL-8 48h組(IL-8取最適濃度)。在反應終止后5min內用酶標儀在450nm波長測量各孔的光密度值,并計算MUC5B相對表達含量。
1.4 PT-PCR(實時定量 PCR 法)測MUC5B mRNA的表達 參照文獻報告和廠家說明書略作改進,取對數生長的細胞進行如下分組:A組:空白對照、B組:IL-8最適濃度組(由上述實驗推斷)、C組:IL8+AG490組(加入50μmol/L AG490預處理1h)、D組:AG490組(50μmol/L預處理1h)、E組:IL-8+NAC組(10mmol/L)、F組:NAC組(10mmol/L),處理48h后再進行后續步驟(E、F組只進行PCR檢測)。TRIzol法提取細胞中的總RNA,以總mRNA為模板,逆轉錄cDNA,H-actin上游引物:ACCCTGAAGTACCCCATCGAG,下游引物:AGCACAGCCTGGATAGCAAC(224bp);H-muc5B上游引物:GCCCACATCTCCACCTATGAT,下游引物:GCAGTTCTCGTTGTCCGTCA(141bp)在260nm與280nm處測其吸光度值并計算其濃度跟純度。
1.5 WB(蛋白免疫印跡法)測JAK2、STAT6、p-JAK2、p-STAT6的蛋白含量 參照文獻報告[6]和廠家說明書,一抗1∶5 000比例稀釋與膜孵育,4℃過夜,次日室溫放置30min。二抗孵育同一抗稀釋步驟及比例相同,稀釋后的二抗與膜室溫孵育90min。設置β-actin為內參,quantity one灰度軟件分析,以目的條帶和β-actin 條帶積分光密度值的比值代表目的蛋白的相對表達量。
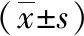
2 結果
2.1 IL-8刺激后各組MUC5B蛋白表達的變化 不同濃度的IL-8刺激HBE135-E6E7細胞48h后,各組MUC5B蛋白的表達水平顯著升高,且刺激效應同IL-8的濃度呈正相關。其中F組MUC5B蛋白相對表達量(16.633 4±1.127 7)最高,且具有統計學意義(P<0.05),見表1。IL-8刺激MUC5B蛋白的表達同處理時間相關,隨著時間的延長,MUC5B的表達逐漸升高,IL-8刺激6h后,MUC5B蛋白的表達水平開始升高,其中E組表達量(16.633 4±1.127 7)最高,且均有統計學差異(P<0.05),見表2。

表1 不同IL-8濃度刺激下MUC5B蛋白相對表達量

表2 IL-8刺激不同處理時間下MUC5B蛋白相對表達量
2.2 阻斷JAK2/STAT6通道后MUC5B mRNA表達的變化 由上述實驗結果,可推斷IL-8刺激黏蛋白MUC5B分泌可能與處理時間、IL-8濃度均相關,因此后續實驗中IL-8濃度設為160ng/ml,處理時間為48h。為了進一步研究IL-8刺激黏蛋白MUC5B分泌的機制,以AG490和NAC為處理因素,通過PCR檢測各組MUC5B mRNA的表達變化,AG490為JAK2抑制劑,能夠阻斷其表達及下游信號轉導,NAC為MUC5B抑制劑,能夠抑制其表達。與E組相比,B組增高, C組降低(P<0.05),提示與NAC類似IL-8可調控MUC5B表達。與A組相比,B組、C組表達均升高且B組升高更明顯(P<0.05),提示IL-8調控MUC5B表達可被JAK2/STAT6抑制劑AG490阻斷,見表3。

表3 AG490、NAC干預后各組MUC5B mRNA相對表達量
2.3 JAK2/STAT6介導IL-8調控MUC5B蛋白表達 與A組相比,B組p-STAT6、p-JAK2的表達明顯增加。與B組相比,C組p-JAK2、p-STAT6的蛋白表達明顯下降。而非磷酸化的JAK2、STAT6在各組表達未見明顯變化,見圖1。通過ELISA檢測加入AG490后各組MUC5B蛋白表達的變化,與A組相比,B組、C組的MUC5B蛋白表達增高,其中B組表達最高,且具有統計學意義(P<0.05)。與B組相比,C組MUC5B蛋白表達降低,有統計學意義(P<0.05)。提示IL-8可通過JAK2/STAT6通道調控MUC5B分泌,且可被STAT6抑制劑AG490阻斷,見表4。

圖1 IL-8刺激下各組JAK2、p-JAK2、STAT6、p-STAT6蛋白表達變化
3 討論
本實驗發現,相同處理時間下,隨著IL-8的濃度增加,MUC5B蛋白表達明顯升高,在相同IL-8濃度刺激下,隨著處理時間的延長,MUC5B蛋白表達亦升高。IL-8主要由肺成纖維細胞產生,作為一種中性粒細胞趨化劑和黏蛋白誘導劑[7],在多種常見氣道慢性疾病患者的肺泡灌洗液及氣管分泌物中表達明顯升高,被認為是慢性氣道疾病的促炎標志物[8]。與本研究類似在研究LPS刺激杯狀細胞黏液分泌體外研究時發現,IL-8的分泌和黏蛋白的分泌具有相關性且兩者成正比,Chen L等研究表明IL-8可刺激呼吸道上皮細胞的黏蛋白MUC基因表達[9]。黏蛋白是黏液的主要大分子成分,目前有21種MUC在人類基因組中被識別,其中4種凝膠形成黏蛋白MUC5AC、MUC5B等表達于氣道中,由氣道上皮細胞的杯狀細胞和黏膜下腺的黏液細胞分泌[10],綜上所述,IL-8參與了調節氣道上皮細胞MUC5B表達,其是氣道炎癥和黏液高分泌的橋梁因子,明確IL介導MUC5B表達的信號轉導通路對于阻斷COPD氣道炎癥和黏液高分泌的惡性循環至關重要,然而目前的報道均以哮喘氣道MUC5AC為主,MUC5B及COPD氣道上皮的研究相對較少。

表4 加AG490后各組MUC5B蛋白相對表達量
IL介導MUC5B表達的信號轉導途徑在不同的刺激物和不同的細胞系中不同,多數報道JAK/STAT6通路可能起重要作用,JAK/STAT家族不但轉導細胞正常分化、增殖的信號,其激活及終止還受到包括炎癥介質在內的多種因素的調控。本實驗發現,在IL-8組中,NAC抑制MUC5B表達的作用減輕,MUC5B mRNA表達及蛋白表達明顯升高,同時p-STAT6、p-JAK2較對照組也明顯升高,提示IL-8可能通過JAK2/STAT6途徑調控MUC5B轉錄及蛋白表達。進一步使用AG490阻斷JAK2的表達,IL-8對MUC5B的刺激作用明顯減弱,MUC5B轉錄及蛋白表達均受抑制。提示JAK2可能是轉導IL信號途徑的關鍵因子,IL與其受體結合,啟動下游JAK2/STAT6/FoxA2相關信號傳導通路,從而介導黏液細胞增生、黏液高分泌[11]。Wu SZ等人指出巨噬細胞來源的IL-8主要刺激JAK2的自磷酸化,Saco TV等發現在香煙煙霧刺激的人氣道上皮中,IL-13通過STAT6/HIF-1途徑上調MUC5AC的表達[12];Sim JH等發現在哮喘患者和正常人體上皮細胞系中,IL-1β通過核因子B通路上調MUC5AC表達水平升高[13];MALAT1通過NF-κB通路促進IL刺激MUC8表達[14];人氣道上皮細胞系中,抵抗素可能通過ERK1/2/P38通路上調MUC5B的表達,該通路是否STAT6介導尚不明確[15];Saco TV等發現肺孢子蟲、肺炎支原體感染的NHBECs,IL4/6等介導激活STAT6通路上調MUC5B表達[11]。因此,JAK/STAT6通路在IL介導氣道上皮MUC5B高分泌中的機制可能為:IL8和受體結合形成異二聚體,激活了其受體上的JAK2,進一步使受體胞漿段的酪氨酸殘基磷酸化,STAT6因此聚集到受體區域,并通過SH2結構域與其結合,STAT6蛋白上的Y641位點酪氨酸殘基磷酸化,磷酸化的STAT6蛋白形成二聚體并易位至細胞核,結合特異的DNA元件,并啟動下游相關基因包括MUC5B的轉錄和表達。
本研究首次發現IL-8調控氣道黏蛋白MUC5B分泌通過JAK2/STAT6信號通路途徑,但相關機制研究存在不足之處:(1)在本研究中,MUC5B表達與其處理時間、IL-8濃度相關,但未明確相關處理時間及濃度下細胞活力情況,無法確定本實驗選用的時間及濃度為最佳時間及濃度。(2)但實驗結果表明阻斷該信號通路后并不能完全抑制黏蛋白MUC5B的表達,因此,其是否合并其他信號通路(如EGFR通道、NOTCH通道)共同調節,仍需進一步驗證。
本實驗僅在正常肺上皮上進行,后續實驗可在慢阻肺動物和患者中驗證,進一步明確黏液高分泌相關機制,尋找相關靶點,為干預黏蛋白高分泌提供新的治療方向。

