納/微秒復合脈沖提高細胞電融合效率的仿真與實驗研究
李成祥 李新皓 柯 強 姚 成 姚陳果
納/微秒復合脈沖提高細胞電融合效率的仿真與實驗研究
李成祥 李新皓 柯 強 姚 成 姚陳果
(輸配電裝備及系統安全與新技術國家重點實驗室(重慶大學) 重慶 400030)
傳統的細胞電融合技術通常采用持續時間為微秒級的短時高壓電脈沖誘導細胞電穿孔來實現。然而,高幅值微秒脈沖在促進細胞電融合的同時易導致細胞過度穿孔而死亡,從而限制了細胞的融合效率。為進一步提高細胞電融合率,該文基于納秒脈沖電場所誘導的“超穿孔現象”,結合常規的微秒脈沖電融合技術,提出納/微秒復合脈沖協同誘導細胞電融合的方法。以SP2/0小鼠骨髓瘤細胞為實驗對象,利用COMSOL軟件分析復合脈沖作用下細胞膜上跨膜電壓與穿孔密度的分布,并進行初步的電融合實驗,探究該融合方法對細胞融合率和死亡率的影響。仿真結果顯示,傳統微秒脈沖作用下,細胞膜的兩極與接觸區域的跨膜電壓均超過穿孔閾值,顯著穿孔面積超過10%。而等劑量的納/微秒復合脈沖作用下,跨膜電壓僅在細胞接觸區域達到較高值,電穿孔也集中于該區域。實驗結果同樣證明,該方法能夠保證較低細胞死亡率(10%)的同時達到較高的細胞融合效率(75%)。該研究為細胞電融合技術的進一步發展提供了新的思路。
細胞電融合 納/微秒復合脈沖 融合效率 跨膜電壓 穿孔密度
0 引言
細胞融合作為細胞工程的一項核心技術,在生產生活中發揮著越來越重要的作用[1]。采用人工干預的細胞融合為某些疾病提供了全新的治療方式,如糖尿病[2]、中樞神經系統軸突再生[3]、自身免疫疾病[4]以及惡性腫瘤[5]等疾病均可通過細胞融合產物得到有效治療。根據所采用干預方式的不同,細胞融合技術可分為化學融合法[6](聚乙二醇)、生物融合法[7](仙臺病毒、日本血凝病毒)和物理融合法[8](離心、振動、電融合)等。其中,細胞電融合作為物理融合方法的一種,相較化學融合法、生物融合法以及其他物理因子所誘導的細胞融合方法,具有可重復性高、操作簡便、對細胞無毒、便于實時觀察等突出優勢,已經逐漸發展成為最有效、最具前景的細胞融合技術之一[1]。
事實上,細胞電融合技術是由人們所熟知的微秒脈沖電場(microsecond Pulsed Electric Fields,msPEF)誘導細胞電穿孔現象發展而來。維爾茲堡大學的U. Zimmermann[8]利用msPEF進行電穿孔實驗時,發現經過脈沖處理的部分細胞發生了融合,由此便創立了一種全新的細胞融合方法——電融合法。基于msPEF的細胞電融合技術一經提出便得到了國內外學者的廣泛關注和持續研究,日本學者M. Senda等[9]利用msPEF成功實現了植物原生質體的電融合,并迅速將該技術推廣到動物、微生物的原生質體融合中,推動了電融合技術的跨越式發展;南開大學汪和睦團隊[10-11]實現了鼠源B淋巴細胞和骨髓瘤細胞的電融合,并在此基礎上制備了多種不同抗性的雜交瘤細胞株;盧布雅爾納大學的D. Miklavcic等[12]采用電場強度1.2kV/cm、脈寬100ms、頻率1Hz的8個脈沖分別單獨處理B16-F1細胞和CHO細胞,發現兩種細胞都能夠進行融合,但融合效率有所差別;瓦倫西亞理工大學的J. Cardona- Costa等[13]采用不同電場強度、脈寬的msPEF處理太平洋牡蠣受精卵,探討受精卵融合效率與微秒脈沖參數的依賴關系;上海瑞金醫院李雁等[14]研究發現,200V、25ms的直流脈沖是人體細胞核移植的最佳電融合參數,融合率達到53.6%。除了上述理論研究成果之外,基于msPEF的細胞電融合在設備研制方面也取得了積極的進展。重慶大學Hu Ning等[15]為提高融合效率,研制出高通量細胞電融合芯片;東京大學K. Sugahara等[16]開發了有利于大細胞高效配對的動態微陣列電融合設備。
盡管基于msPEF的電融合技術已經取得了長足的進展,但是在融合過程中仍存在較高的細胞死亡率,極大地限制了融合效率的進一步提升。為此,M. Kanduser等[17]提出通過添加脂質抗氧化劑對細胞進行保護以有效降低細胞死亡率;Qu Pengxiang等[18]則嘗試通過添加褪黑素來達到降低死亡率的效果。然而,化學試劑的添加無疑會導致步驟的增加、生產工序的繁雜以及經濟成本的提高。M.Kanduser等[19]研究發現,融合細胞的死亡率之所以居高不下,其關鍵在于msPEF施加過程中導致細胞膜上出現大面積穿孔。因此,欲從根本上提升細胞電融合效率,應在保證產生滿足電融合需求的穿孔的同時,盡可能地避免細胞膜過度穿孔情況的出現。
近年來,脈寬相對更窄的納秒脈沖電場(nano- second Pulsed Electric Fields, nsPEF)以其獨特的“細胞內電處理”效應在生物醫學領域得到了越來越多的關注[20-21]。同時,也有大量的仿真和實驗研究證實,nsPEF同樣可以作用在細胞外膜,并使其產生大量納米級尺寸的微孔,即所謂的“超穿孔”(supra- electroporation)現象。Hu Qingfang等[22]基于分子動力學仿真發現,電場強度100kV/cm、脈寬10ns的nsPEF能在細胞外膜上快速產生納米級微孔;L. M. Mir等[23]采用電場強度40kV/cm、脈寬10ns的單個nsPEF處理DC-3F細胞,發現nsPEF同樣可以使細胞膜穿孔,但穿孔尺寸較小,常用的大分子染色劑并不能通過細胞膜進入細胞內部;G. Saulis 等[24]也同樣證實nsPEF作用下細胞膜上產生孔洞數量遠大于msPEF,但尺寸較小,恢復時間較短,不易造成細胞死亡。
鑒于此,本文嘗試將nsPEF引入細胞電融合,使其首先在細胞膜上產生尺寸相對較小的微孔,繼而再施加低幅值msPEF對孔洞進行維持和擴張,以避免直接施加高幅值msPEF造成細胞膜大面積穿孔,從而降低死亡率,最終達到提高細胞融合效率的目的。為此,本文選擇小鼠骨髓瘤細胞SP2/0為研究對象,建立融合細胞動態電穿孔模型,對比分析msPEF及納/微秒復合脈沖作用下,細胞膜的跨膜電壓(Transmembrane Voltage, TMV)分布及穿孔變化情況,并初步開展細胞融合實驗,利用熒光顯微鏡觀察染色細胞的融合情況,探究納/微秒復合脈沖提高細胞電融合效率的可行性。
1 模型建立與實驗設計
1.1 數值仿真模型的建立
在COMSOL Multiphysics中建立相互接觸的雙細胞模型,采用有限元方法,對脈沖作用下細胞跨膜電壓的分布及細胞膜穿孔情況進行仿真分析。
1.1.1 雙細胞幾何模型
由于細胞融合實驗是在低滲融合緩沖液中進 行[25],待融合細胞會略微膨脹接近球體,因此,本文將細胞簡化為標準球體[19]。標準球體具有空間軸對稱性,可以建立二維幾何模型來減少計算量,以縮短仿真時間。細胞融合仿真模型示意圖如圖1所示,用一個長200mm、寬200mm的空間來模擬細胞融合時的外環境,兩側的條狀矩形用于模擬銅制極板,其中,左側極板施加高電位,右側極板接地。細胞的物理尺寸按SP2/0骨髓瘤細胞的實際尺寸進行設置,其中,細胞半徑為5.6mm,細胞核半徑為4.723mm,細胞核質比約為70%。令兩細胞相互接觸并沿電場方向排列,接觸區域垂直于電場,長度設置為2mm。將細胞各部分簡化為各向同性的線性均勻介質,分別用電導率和介電常數表示細胞模型各部分的電特性,各區域邊界設置為電絕緣,計算時用三角形進行剖分,并對需要重點求解的細胞膜部分進行二次細化,剖分單元為12 368個域單元(999個邊界元)。
1.1.2 動態電穿孔模型

圖1 細胞融合仿真模型示意圖
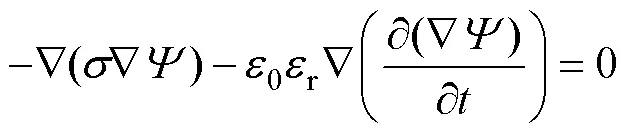

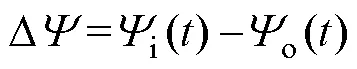
式中,DY為跨膜電壓;i為膜的內電位;o為膜的外電位。
在外加電場的作用下,細胞內外離子運動并聚集在膜兩側,細胞膜和核膜的穿孔可以描述為磷脂雙分子層受電位變化影響形成大量親水微孔。穿孔的形成為跨膜電流提供新的通道,大量的穿孔將顯著提高膜的導電性。此時,整體的跨膜電流密度可以表示[26-27]為
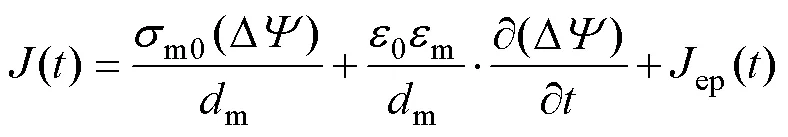
式中,為電流密度;m0為膜的初始電導率;m為細胞外溶液介電常數;m為細胞膜厚度;ep為跨膜電流密度增量,其計算公式由K. A. De Bruin和W. Krassowska提出[28],有



其中

式中,ep為流過單個微孔的電流;為孔密度;p為孔隙電導率;為微孔半徑;0為孔隙阻礙能量系數;為孔隙相對密度;為法拉第常數;為氣體常數;為熱力學溫度。孔密度呈動態變化,可通過Smoluchowsky方程[28]求解,有
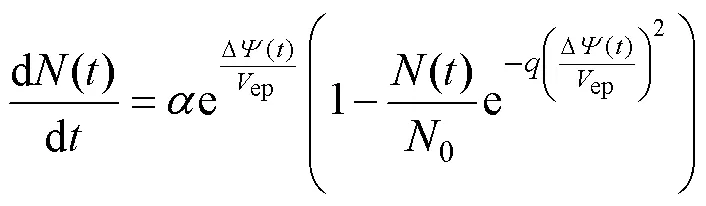
式中,0為初始孔密度;ep為電穿孔特征電壓;為穿孔有效形成率系數;為穿孔系數。ep決定了細胞膜的穿孔閾值T,文獻[27]給出了二者之間的關系,生物質膜的T通常取值為500~1 000mV,本文選取T=1 000mV(ep=258mV)[19, 29]。
將式(5)~式(7)代入式(4),可得到電流增量為
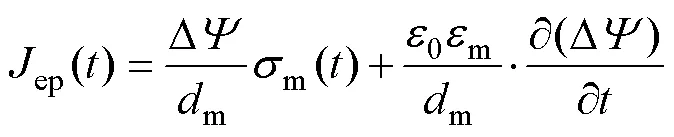
膜電導率m與孔密度呈正相關,膜動態電導率由初始電導率及穿孔后的電導率增量相加得到[30-31],有

電場作用下穿孔半徑的變化情況[30-31]為
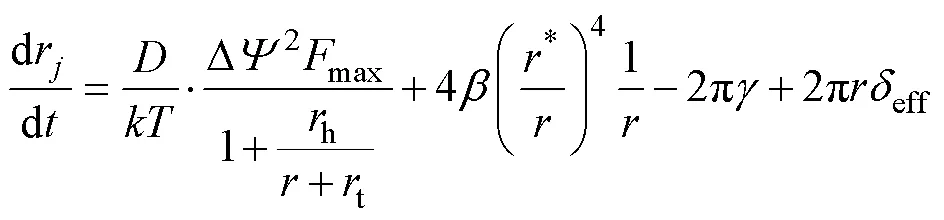
式中,為孔半徑擴散系數;為玻耳茲曼常數;為空間排斥能;為邊緣能量;h和t為平流速度常數;max為TMV=1V時的最大電動力;*為親水孔最小半徑;eff為膜有效張力系數,可求得eff為


仿真研究中細胞所有幾何參數和電氣參數的取值及其來源見表1。
表1 仿真模型幾何參數與電氣參數

Tab.1 The geometric and electrical parameters used in the simulation
1.1.3 復合脈沖電穿孔效應仿真
利用COMSOL軟件中的AC-DC模塊和PDE模塊對兩個接觸細胞在脈沖作用下的電穿孔情況進行瞬態仿真。為了準確地對比單msPEF和納/微秒復合脈沖的作用效果,本文采用等劑量的脈沖施加方式,脈沖劑量[32, 35]為
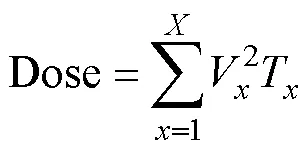
式中,V為第個脈沖的幅值;T為第個脈沖的脈寬;為脈沖個數。
脈沖波形示意圖如圖2所示。參考細胞融合儀(ECM2001,美國BTX Corporation)參數推薦,選用電場強度2.21kV/cm,脈寬40ms的單個msPEF作為對照組的脈沖施加方案(見圖2a)。鑒于單個nsPEF對細胞膜作用有限[19],本文經過初步實驗探究,選取5個電場強度6kV/cm,脈寬200ns的nsPEF,結合一個電場強度2kV/cm,脈寬40ms的msPEF作為復合脈沖的組合方式(見圖2b)。nsPEF的施加間隔為1ms,兩種脈沖轉換間隔設置為5ms。對整個模型區域進行有限元仿真計算,由于雙細胞模型的對稱性,為避免重復,在進行細胞膜分析時僅對部分膜區域進行展示,具體區域如圖3加粗部分所示。

圖2 脈沖波形示意圖
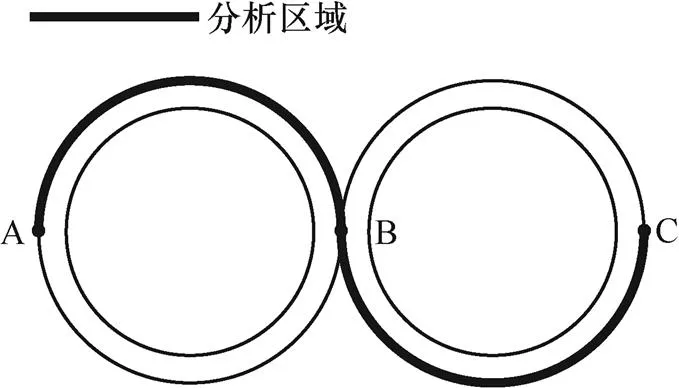
圖3 仿真分析區域示意圖
1.2 實驗材料與方法
本文通過開展細胞電融合實驗,進一步從實驗的角度驗證納/微秒復合脈沖作用細胞電融合的可行性。為更好地對比納/微秒復合脈沖及msPEF的作用效果,采用三種不同的脈沖劑量分別進行實驗并統計細胞融合效率和死亡率,所涉及的實驗方法和材料如下。
1.2.1 融合緩沖液配置
低滲融合緩沖液通常用于脈沖處理細胞的實驗過程,該緩沖液(90mOsm/L)包含Mg2+(0.1mmol/L)、Ca2+(0.1mmol/L)、牛血清蛋白(1mg/mL)以及D-甘露醇(所有試劑均購自美國Sigma Corporation)。等滲融合緩沖液含120mmol/L D-甘露醇,該緩沖液僅用于洗滌細胞。用電導率儀測試兩種緩沖液的電導率,電導率均為0.01S/m。
1.2.2 細胞處理
實驗所用的小鼠骨髓瘤細胞(SP2/0)購自上海雅潔生物科技有限公司,培養在37℃、5% CO2加濕的環境中,含10%胎牛血清的RPMI1640培養基上。在脈沖處理前,先將清洗、消化、潤洗后的細胞通過血細胞計數板進行計數,并配制成細胞密度為1×106/mL的細胞懸液。將0.5mL的細胞懸液和0.5mL的Hoechst 33342(10mg/mL,美國Solarbio Corporation)加入培養皿中充分混合,并置于培養箱中培養20min充分染色。染色完成后使用5mL磷酸緩沖鹽溶液(Phosphate Buffered Saline, PBS)洗滌兩次,以去除剩余染料。再用5mL等滲融合緩沖液洗滌一至兩次,即可將細胞置于500mL低滲融合緩沖液中,進行脈沖處理。
1.2.3 細胞電融合實驗驗證
取Hoechst染色完成的細胞接種于平行電極(45-0105,美國BTX Corporation)進行細胞融合實驗,該電極由帶有矩形極板的玻璃微載玻片制成,電極間距為3.2mm,體積為650mL。細胞電融合實驗平臺為課題組自行設計,如圖4所示。數字信號發生器和功率放大器用于生成正弦波形,并輸入脈沖發生器進行統一控制。脈沖發生器中有納微秒脈沖發生模塊及切換模塊,可以輸出不同脈寬的方波脈沖或正弦電壓波形。不同波形之間的切換由繼電器(JPK43A234,中國 WPVAC)實現,并通過現場可編程門陣列(Field Programmable Gate Array, FPGA)(EP4CE6,中國 ALINX)進行控制。示波器(DPO3024,美國Tektronix)用于顯示電流傳感器(2100,美國Pearson)和高壓探頭(PPE5kV,美國LeCroy)采集的電流和電壓信號。融合實驗所施加的脈沖參數見表2,脈沖施加結束繼續培養10min,在細胞懸液中加入20mL碘化丙啶(PI;1mg/mL,美國Life Technologies Corporation)并靜置8min,用熒光顯微鏡(美國Life Technologies Corporation)觀察Hoechst 33342以及PI對細胞的染色情況。Hoechst 33342用于細胞核染色,融合實驗后通過觀察熒光場和明場圖像可以判斷兩個或多個細胞是否融合。PI用于死亡細胞的染色,若細胞被PI染成紅色,則認為細胞已經死亡。

圖4 細胞融合實驗平臺
表2 實驗脈沖參數
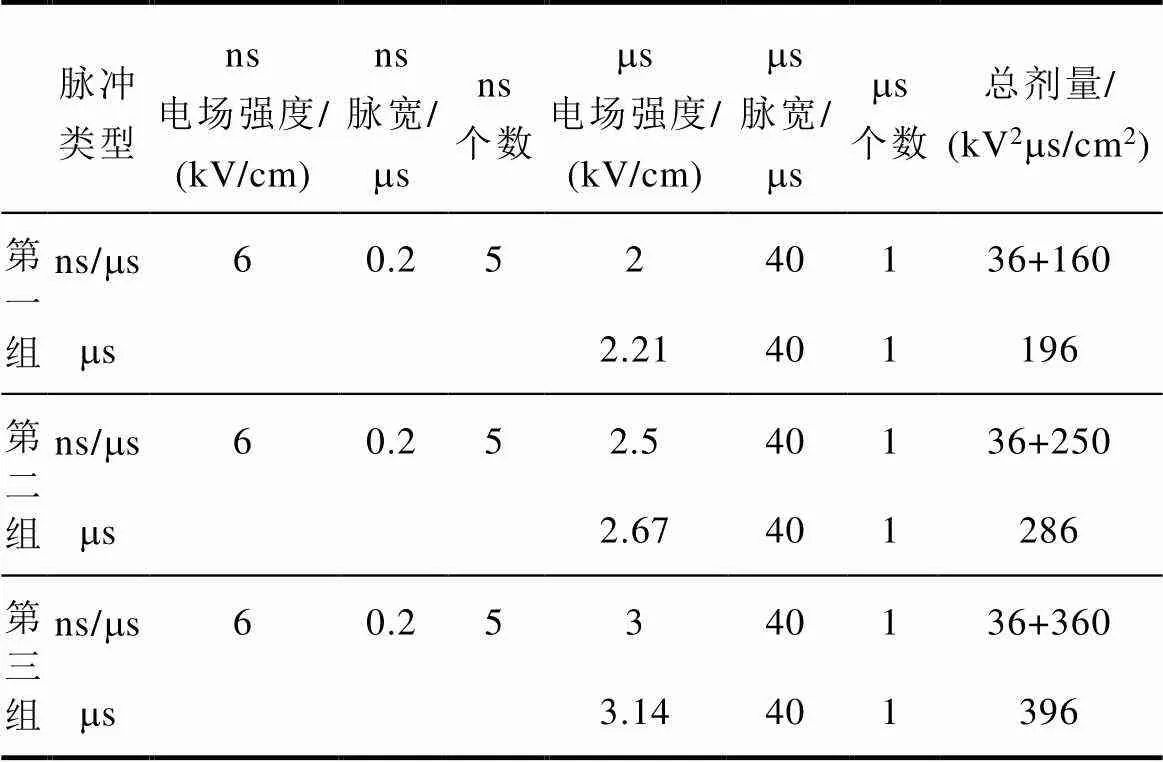
Tab.2 Experimental pulse parameter
1.2.4 細胞電融合效率統計分析
細胞融合率通常被定義為參與融合的細胞數與細胞總數之比[19, 32],細胞死亡率為被PI染色的細胞數與細胞總數之比。若參與融合的細胞同時被PI染色,則計入死亡細胞,不計入融合細胞。
所有數據均以四組獨立實驗的均數±標準差表示,并對不同脈沖組合的實驗結果進行顯著性檢驗,用Origin 2019b進行繪制。
2 結果與分析
2.1 跨膜電壓仿真分析
在外加脈沖電場的作用下,細胞膜由于電容效應的存在表現出充放電過程,跨膜電壓隨之發生變化,本節對單msPEF及納/微秒復合脈沖作用下,雙細胞模型跨膜電壓分布情況進行分析。圖5所示為兩種脈沖作用后細胞膜表面跨膜電壓沿弧長的分布情況(分析區域見圖3)。根據仿真結果可知,單msPEF作用下細胞膜跨膜電壓分布(虛線部分)呈“W”型,細胞模型的左右兩極及接觸區域(黑色點劃線范圍)的跨膜電壓均達到了較高值(>1V),說明這些區域均存在較大可能被誘導產生顯著穿孔。在納/微秒復合脈沖作用時(實線部分),細胞接觸區域產生的跨膜電壓略大于msPEF作用,而在細胞兩極的跨膜電壓則僅為0.3~0.5V,遠小于細胞膜的穿孔閾值。
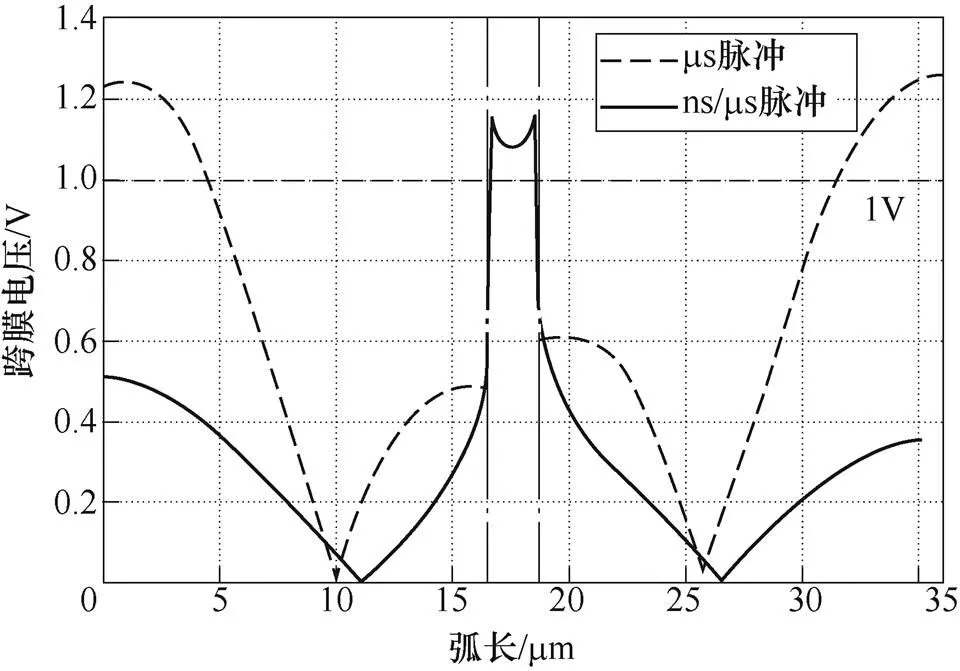
圖5 細胞膜跨膜電壓分布情況
2.2 穿孔密度仿真分析
當細胞跨膜電壓達到穿孔閾值時,會在膜上誘導產生大量的親水孔,這些孔洞的產生與分布和所施加的脈沖參數密切相關。本節分別選取細胞模型的兩個極點以及接觸區域的中點(見圖3)來研究脈沖作用時膜上孔密度隨時間的變化情況,并分析脈沖作用結束后發生顯著穿孔(孔密度>1×1013/m2)的區域[19,32]。
圖6為msPEF及納/微秒復合脈沖分別誘導細胞融合產生的孔密度隨時間的變化情況。由圖6a可見,msPEF單獨作用時,前3ms孔密度并沒有發生明顯變化,隨后B點(見圖3)率先出現穿孔,并于7ms左右率先達到了顯著穿孔臨界點,并最終維持在2.5×1014/m2左右。隨著脈沖的持續作用,兩級位置的孔密度分別于8ms(A點)和10ms(C點)開始增加,并先后超過了1×1013/m2,但上升趨勢較緩,最終穩定的孔密度在1013/m2量級,略小于接觸區域孔密度。
納/微秒復合脈沖作用下的細胞膜穿孔情況如圖6b所示。由圖可見,在nsPEF作用時間段(前5ms),細胞膜接觸區域的孔密度迅速上升,并最終穩定在1.17×1015/m2,在此期間,兩極位置的孔密度幾乎沒有變化。隨著msPEF的施加,A點和C點的孔密度開始緩慢增加,增加的速率明顯小于單msPEF作用結果,直至脈沖施加結束,兩極的孔密度均沒有超過1×1013/m2,而B點的孔密度在msPEF作用下一直保持到脈沖作用結束。
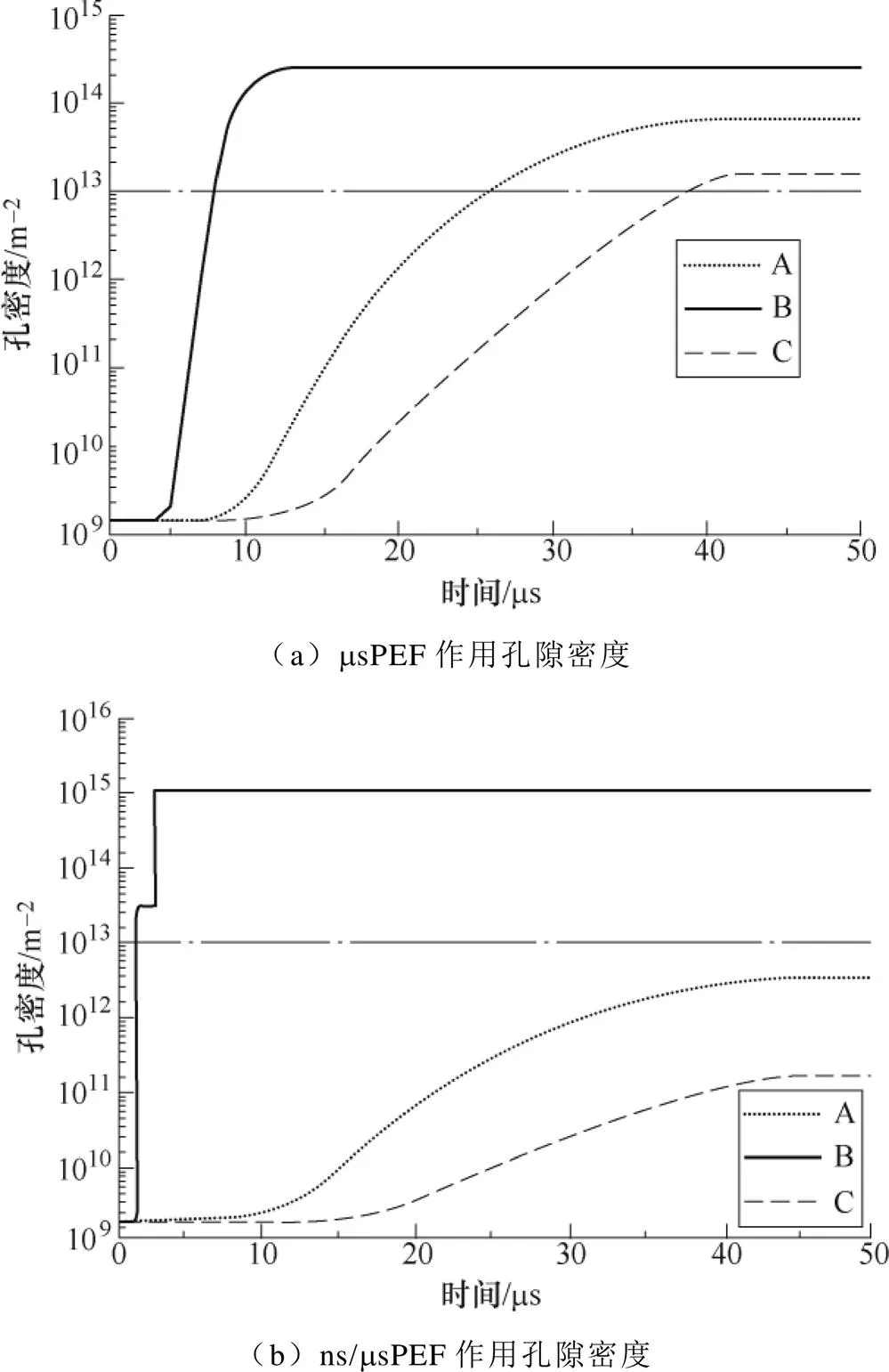
圖6 細胞膜孔密度隨時間變化情況
顯著穿孔分布如圖7所示。為了更加直觀地展示細胞膜上顯著穿孔的分布,在圖7中將膜上孔密度大于1×1013/m2的區域用粗實線標出。由圖7a可知,msPEF作用下,細胞膜表面約有10%的膜區域發生了顯著穿孔,除了接觸區域,細胞的左右兩極也發生了大面積的顯著穿孔,且靠近正電極的左側極點區域的顯著穿孔面積要大于靠近接地電極的右側極點區域。而納/微秒復合脈沖作用下(見圖7b),細胞膜顯著穿孔都集中在細胞膜接觸區域,其余區域并沒有發生顯著穿孔。

圖7 顯著穿孔分布
仿真結果表明,納/微秒復合脈沖這種脈沖組合方式能有效地將穿孔集中于細胞接觸區域并可以在較長時間內有效地維持,而對其余膜區域的影響較小。從理論上分析,該現象有利于降低融合細胞的死亡率,提高細胞的融合效率。
2.3 細胞電融合實驗結果分析
使用已經過Hoechst 33342染料對細胞核進行染色的SP2/0小鼠骨髓瘤細胞進行電融合實驗。在進行脈沖處理前需先施加20s的高頻正弦電壓(100V/cm,1MHz)進行細胞排隊,正弦電壓作用結束后在較短時間內切換為脈沖電壓誘導細胞融合。細胞在電處理結束后繼續培養10min,再經過PI染色,即可分別獲取經Hoechst和PI染色的細胞明場圖像及紅色和藍色的細胞熒光圖像。每種脈沖施加方案分別進行四組獨立實驗,每組實驗中隨機選取3個視野進行融合細胞、死亡細胞及細胞總量的計數,取平均數計算各組細胞融合率和死亡率。
實驗中獲得的細胞排隊圖像及熒光成像結果如圖8所示,其中,圖8a為細胞排隊圖像,在交變電壓導致的介質電泳效應作用下,細胞沿電場方向排列成珍珠串狀。圖8b為假處理對照組,該組不進行脈沖處理,其余步驟及培養時間均與實驗組相同。圖8c和圖8d分別為總劑量為286kV2·ms/cm2的msPEF和復合脈沖作用電融合的實驗結果。

圖8 熒光染色實驗成像


圖9 細胞融合率、死亡率統計結果
msPEF和納/微秒復合脈沖作用細胞電融合時,細胞死亡率的變化情況如圖9b所示。由對照組死亡率可知,細胞排隊所用的高頻正弦電壓也會對細胞造成一定傷害,死亡率約為6%;在單msPEF作用時,隨著脈沖劑量的上升,細胞死亡率從19.12%上升到了27.83%、53.16%,死亡率增長十分顯著;而納/微秒復合脈沖作用下,隨著脈沖劑量的提升,細胞的死亡率分別為13.58%、9.76%、39.35%。由此可見,相較于單個較高幅值的msPEF,高幅值nsPEF結合較低幅值的msPEF這種脈沖施加方式能夠顯著降低細胞死亡率,并且在一定的脈沖劑量范圍內,復合脈沖作用下的細胞死亡率不會隨著劑量的增加發生明顯變化。
3 討論
外加脈沖電場會改變細胞膜內外原有的離子分布狀態,造成跨膜電壓的變化。而跨膜電壓的提高會降低膜脂重排所需的能量,從而導致親水孔的形成[36]。通過分析細胞膜上跨膜電壓分布(見圖5)可知,持續時間足夠短的脈沖(納秒級別)可以在細胞膜接觸區域有選擇性地進行大量穿孔,通過計算脈沖作用引起的跨細胞膜的孔密度變化進一步證明了這一點(見圖6)。在脈寬40ms的msPEF作用下,細胞膜接觸區域的電穿孔同時伴隨著細胞兩極區域的較大范圍穿孔(見圖7a),靠近正極板的細胞左極由于靜息電位的影響比右極附近區域穿孔更加嚴重[37]。而在脈沖劑量相同的情況下,先施加5個高幅值nsPEF,再使用低幅值msPEF作用只會導致接觸區域發生顯著電穿孔,對細胞膜上其他區域則影響較小(見圖7b)。過度的細胞電穿孔容易導致細胞死亡,本文的數值仿真結果與實驗觀察到,單msPEF作用時,SP2/0骨髓瘤細胞的高死亡率相一致。
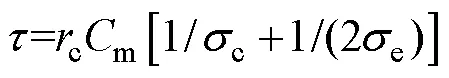
有研究表明[24, 38],細胞膜上的電穿孔數量由施加脈沖的幅值決定,而孔洞的尺寸則更多受脈沖施加時間的影響。在較高幅值的納秒級別脈沖作用下,孔隙的生成速率會遠遠大于孔擴張的速率(超穿孔現象),但較短的脈沖持續時間不足以支撐孔的擴張,生成的微孔半徑僅為0.8nm左右,且極容易重新封閉。根據電融合基本條件,細胞融合過程的持續時間約為數分鐘[39],在這個過程中需要微孔一直保持“打開”的狀態才能保證細胞的成功融合,若通過提高nsPEF的頻率和數量來延長孔隙的維持時間,則可能因為nsPEF的高頻透膜性誘導其他生物效應的產生而對細胞活性產生影響[40-41]。因此,本文利用msPEF僅靶向作用細胞膜的特點[42],對已經生成的孔隙進行維持和擴張。低幅值msPEF作用產生的跨膜電壓很難達到穿孔閾值,因此不易在其他區域產生大面積穿孔,造成細胞死亡。
本文對SP2/0小鼠骨髓瘤細胞進行了電融合實驗,從實驗角度驗證nsPEF協同msPEF進行細胞電融合的可行性。圖9表明,在SP2/0細胞電融合實驗中,復合脈沖作用的細胞融合效率普遍大于傳統msPEF作用結果,而細胞死亡率則普遍小于msPEF作用結果,該現象證實本文提出的納/微秒復合脈沖協同作用的細胞電融合效率高于傳統微秒脈沖。與msPEF作用相似,隨著脈沖劑量的增加,復合脈沖作用下細胞融合效率也經歷了先增大后減小的過程,但通過細胞死亡率統計結果可知,復合脈沖作用時,在一定的電場強度范圍內細胞死亡率不會隨著電場強度的提升而發生顯著改變。此現象說明,納/微秒復合脈沖可以在提高細胞融合效率的同時不增加細胞的死亡率。
若將本文的研究內容擴展到實際應用中,可為脈沖組合的選取提供依據和理論支撐。本實驗中所采用的5個脈寬200ns,電場強度6kV/cm的nsPEF結合1個脈寬40ms,電場強度2.5kV/cm的msPEF的復合脈沖組合方式雖然已經超過了傳統msPEF的電融合效率,但是并沒有考慮到脈沖參數的優化問題,40ms的微秒脈沖也僅為細胞融合儀推薦使用的脈沖參數,并不一定為復合脈沖作用細胞電融合的最優脈沖參數,最優脈沖組合問題仍需后續進一步開展實驗進行探究。另一方面,本文僅通過細胞融合率來表征復合脈沖作用細胞電融合的結果,而在實際雜交瘤制備過程中,融合的細胞不一定都能有效存活并發展成為雜交瘤細胞,因此,在后續研究中需要引入雜交瘤培養技術,來探究納/微秒復合脈沖電融合產生雜交瘤細胞的實際生產效率。
4 結論
本文從數值仿真和實驗分析兩個方面,開展了納/微秒復合脈沖作用細胞電融合融合效率及細胞死亡率的研究,證明了該融合方法提高細胞融合效率、降低細胞死亡率的可行性。
對脈沖作用下細胞跨膜電壓分布及穿孔動態過程的仿真研究中,發現納/微秒復合脈沖具有明顯的細胞接觸區域靶向穿孔的特性,能夠將穿孔集中于細胞接觸位置并維持較長時間,而對細胞膜其他區域的影響較小。該研究結果證明,納/微秒復合脈沖能夠結合兩種脈沖各自的優勢,避免了高幅值微秒脈沖作用下細胞膜過度穿孔情況的出現。通過SP2/0小鼠骨髓瘤細胞的電融合實驗研究,證實納/微秒復合脈沖與微秒脈沖相比,可以降低細胞死亡率,提高細胞融合效率。同時,該融合方法的作用效果同樣對脈沖劑量具有一定的依賴性,最優的電融合脈沖組合仍需進一步探索。
[1] Bajaj Y. Plant protoplasts and genetic engineering II[M]. Berlin: Springer-Verlag, 1989.
[2] Mccluskey J T, Hamid M, Guo-Parke H, et al. Development and functional characterization of insulin-releasing human pancreatic beta cell lines produced by electrofusion[J]. Journal of Biological Chemistry, 2011, 286(25): 21982-21992.
[3] Sretavan D W, Chang W, Hawkes E, et al. Microscale surgery on single axons[J]. Neurosurgery, 2005, 57(4): 635-646.
[4] Avigan D, Rosenblatt J, Kufe D. Dendritic/tumor fusion cells as cancer vaccines[J]. Seminars in Oncology, 2012, 39(3): 287-295.
[5] Trontelj K, Reber?ek M, Kandu?er M, et al. Optimi- zation of bulk cell electrofusion in vitro for pro- duction of human-mouse heterohybridoma cells[J]. Bioelectrochemistry, 2008, 74(1): 124-129.
[6] Golestani R, Pourfathollah A A, Moazzeni S M. Cephalin as an efficient fusogen in hybridoma technology: can it replace poly ethylene glycol?[J]. Hybridoma, 2007, 26(5): 296-301.
[7] Okada Y, Koseki I, Kim J, et al. Modification of cell membranes with viral envelopes during fusion of cells with HVJ (Sendai virus): I. Interaction between cell membranes and virus in the early stage[J]. Experimental Cell Research, 1975, 93(2): 368-378.
[8] Zimmermann U, Neil G A. Electromanipulation of Cells[M]. New York: CRC Press, 1996.
[9] Senda M, Takeda J, Abe S, et al. Induction of cell fusion of plant protoplasts by electrical stimulation[J]. Plant and Cell Physiology, 1979, 20(7): 1441-1443.
[10] 謝廷棟, 汪和睦, 魯玉瓦, 等. 鼠B淋巴細胞和骨髓瘤細胞的電融合[J]. 中國生物醫學工程學報, 1989, 8(1): 25-31.
Xie Tingdong, Wang Hemu, Lu Yuwa, et al. Elec- trical fusion of mouse B lymphocytes and myeloma cells[J]. Chinese Journal of Biomedical Engineering, 1989, 8(1): 25-31.
[11] 紀其雄, 魯玉瓦, 汪和睦. 運用高效率電融合技術建立抗-hCG雜交瘤細胞株[J]. 生物物理學報, 1993, 9(3): 507.
Ji Qixiong, Lu Yuwa, Wang Hemu. A high- efficiency electrofusion technique was used to establish anti-hCG hybridoma cell line[J]. Acta Biophysica Sinica, 1993, 9(3): 507.
[12] Usaj M, Flisar K, Miklavcic D, et al. Electrofusion of B16-F1 and CHO cells: the comparison of the pulse first and contact first protocols[J]. Bioelectro- chemistry, 2013, 89(2): 34-41.
[13] Cardona-Costa J, García-Ximénez F, Espinós F J. Definition of fusion medium and electric parameters for efficient zygote electrofusion in the Pacific oyster (Crassostrea gigas)[J]. Theriogenology, 2010, 74(5): 828-834.
[14] 李雁, 馮云, 孫貽娟, 等. 人卵母細胞與體細胞的電融合效率[J]. 上海交通大學學報(醫學版), 2007, 27(7): 837-840.
Li Yan, Feng Yun, Sun Yijuan, et al. Efficiency of electrofusion of human somatic cells with oocytes[J]. Journal of Shanghai Jiaotong University (Medical Science), 2007, 27(7): 837-840.
[15] Hu Ning, Yang Jun, Joo S W, et al. Cell electrofusion in microfluidic devices: a review[J]. Sensors and Actuators B: Chemical, 2013, 178: 63-85.
[16] Sugahara K, Morimoto Y, Takamoei S, et al. A dynamic microarray device for pairing and electro- fusion of giant unilamellar vesicles[J]. Sensors and Actuators B: Chemical, 2020, 311: 127922.
[17] Kanduser M, Imsirovic M K, Usaj M. The effect of lipid antioxidanta-tocopherol on cell viability and electrofusion yield of B16-F1 cells in vitro[J]. The Journal of Membrane Biology, 2019, 252(1): 105-114.
[18] Qu Pengxiang, Shen Chong, Du Yue, et al. Melatonin protects rabbit somatic cell nuclear transfer (SCNT) embryos from electrofusion damage[J]. Scientific Reports, 2020, 10(1): 1-9.
[19] Rems L, Usaj M, Kanduser M, et al. Cell electro- fusion using nanosecond electric pulses[J]. Scientific Reports, 2013, 3(1): 1-10.
[20] Stacey M W, Fox P, Buescher S, et al. Nanosecond pulsed electric field induced cytoskeleton, nuclear membrane and telomere damage adversely impact cell survival[J]. Bioelectrochemistry, 2011, 82(2): 131-134.
[21] 劉紅梅, 董守龍, 寧郡怡, 等. 納秒脈沖高頻透膜效應優先殺傷化療抗性腫瘤細胞的仿真與實驗研究[J]. 電工技術學報, 2019, 34(22): 4839-4848.
Liu Hongmei, Dong Shoulong, Ning Junyi, et al. Simulation and experimental study on preferential killing of chemoresistance tumor cells induced by the high-frequency permeation effect of nanosecond pulse field[J]. Transactions of China Electrotechnical Society, 2019, 34(22): 4839-4848.
[22] Hu Qingfang, Viswanadham S, Joshi R P, et al. Simulations of transient membrane behavior in cells subjected to a high-intensity ultrashort electric pulse[J]. Physical Review E, 2005, 71(3): 31914.
[23] Silve A, Leray I, Mir L M. Demonstration of cell membrane permeabilization to medium-sized mole- cules caused by a single 10ns electric pulse[J]. Bioelectrochemistry, 2012, 87(10): 260-264.
[24] Saulis G, Saul? R. Size of the pores created by an electric pulse: microsecond vs millisecond pulses[J]. Biochimica et Biophysica Acta (BBA)-Biomembranes, 2012, 1818(12): 3032-3039.
[25] Usaj M, Kanduser M. The systematic study of the electroporation and electrofusion of B16-F1 and CHO cells in isotonic and hypotonic buffer[J]. The Journal of Membrane Biology, 2012, 245(9): 583-590.
[26] Pucihar G, Miklavcic D, Kotnik T. A time-dependent numerical model of transmembrane voltage indu- cement and electroporation of irregularly shaped cells[J]. IEEE Transactions on Biomedical Engin- eering, 2009, 56(5): 1491-1501.
[27] Krassowska W, Filev P D. Modeling electroporation in a single cell[J]. Biophysical Journal, 2007, 92(2): 404-417.
[28] De Bruin K A, Krassowska W. Modeling electro- poration in a single cell. I. Effects of field strength and rest potential[J]. Biophysical Journal, 1999, 77(3): 1213-1224.
[29] Liu Linying, Mao Zheng, Zhang Jianhua, et al. The influence of vesicle shape and medium conductivity on possible electrofusion under a pulsed electric field[J]. PloS One, 2016, 11(7): e0158739.
[30] Neu J C, Smith K C, Krassowska W. Electrical energy required to form large conducting pores[J]. Bioelectrochemistry, 2003, 60(1): 107-114.
[31] Yao Chenguo, Liu Hongmei, Zhao Yajun, et al. Analysis of dynamic processes in single-cell electro- poration and their effects on parameter selection based on the finite-element model[J]. IEEE Transa- ctions on Plasma Science, 2017, 45(5): 889-900.
[32] Li Chengxiang, Ke Qiang, Yao Cheng, et al. Com- parison of bipolar and unipolar pulses in cell elec- trofusion: simulation and experimental research[J]. IEEE Transactions on Biomedical Engineering, 2018, 66(5): 1353-1360.
[33] Polevaya Y, Ermolina I, Schlesinger M, et al. Time domain dielectric spectroscopy study of human cells: II. Normal and malignant white blood cells[J]. Biochimica et Biophysica Acta (BBA)-Biomembranes, 1999, 1419(2): 257-271.
[34] Garner A L, Chen G, Chen Nianyong, et al. Ultrashort electric pulse induced changes in cellular dielectric properties[J]. Biochemical and Biophysical Research Communications, 2007, 362(1): 139-144.
[35] 姚陳果, 鄭爽, 劉紅梅, 等. 面向臨床多針消融腫瘤的不可逆電穿孔量效關系模型[J]. 電工技術學報, 2020, 35(11): 2491-2498.
Yao Chenguo, Zheng Shuang, Liu Hongmei, et al. Model of irreversible electroporation dose-effect relationship for clinical multi-needle ablation tumors[J]. Transactions of China Electrotechnical Society, 2020, 35(11): 2491-2498.
[36] Kotnik T, Miklav?i? D. Theoretical evaluation of voltage inducement on internal membranes of biological cells exposed to electric fields[J]. Bio- physical Journal, 2006, 90(2): 480-491.
[37] 姚陳果, 劉紅梅, 趙亞軍, 等. 基于有限元分析的球形單細胞及不規則真實細胞電穿孔動態過程仿真[J]. 高電壓技術, 2016, 42(8): 2479-2486.
Yao Chenguo, Liu Hongmei, Zhao Yajun, et al. Simulation on the process of electroporation in spherical single-cell and irregularly shaped real cells based on finite elements analysis[J]. High Voltage Engineering, 2016, 42(8): 2479-2486.
[38] 姚陳果, 呂彥鵬, 趙亞軍, 等. 基于能量概率與微孔力模型的脈沖電場對細胞電穿孔動態過程的仿真分析[J]. 電工技術學報, 2016, 31(23): 141-149.
Yao Chenguo, Lü Yanpeng, Zhao Yajun, et al. Simulation analysis on dynamic process of elec- troporation by the model based on energy probability and pore force in cell exposed to pulsed electric field[J]. Transactions of China Electrotechnical Society, 2016, 31(23): 141-149.
[39] Pucihar G, Kotnik T, Teissié J, et al. Electro- permeabilization of dense cell suspensions[J]. European Biophysics Journal, 2007, 36(3): 173-185.
[40] 米彥, 李盼, 劉權, 等. 納秒脈沖電場聯合多壁碳納米管對皮膚癌細胞活性的劑量效應研究[J]. 電工技術學報, 2019, 34(22): 4849-4857.
Mi Yan, Li Pan, Liu Quan, et al. Dose effect of the activity of skin cancer cells treated by nanosecond pulsed electric field combined with multi-walled carbon nanotubes[J]. Transactions of China Elec- trotechnical Society, 2019, 34(22): 4849-4857.
[41] 米彥, 劉權, 李盼, 等. 低強度納秒脈沖電場聯合靶向金納米棒對A375黑色素瘤細胞的殺傷效果研究[J]. 電工技術學報, 2020, 35(12): 2534-2544.
Mi Yan, Liu Quan, Li Pan, et al. Study of killing effects of A375 melanoma cells treated by low intensity nanosecond pulsed electric fields combined with targeted gold nanorods[J]. Transactions of China Electrotechnical Society, 2019, 35(12): 2534-2544.
[42] 姚陳果, 寧郡怡, 劉紅梅, 等. 微/納秒脈沖電場靶向不同尺寸腫瘤細胞內外膜電穿孔效應研究[J]. 電工技術學報, 2020, 35(1): 115-124.
Yao Chenguo, Ning Junyi, Liu Hongmei, et al. Study of electroporation effect of different size tumor cells targeted by micro-nanosecond pulsed electric field[J]. Transactions of China Electrotechnical Society, 2020, 35(1): 115-124.
Simulation and Experimental Research on Improving the Efficiency of Cell Electrofusion by Nano-Microsecond Pulsed Electric Fields
(State Key Laboratory of Power Transmission Equipment & System Security and New Technology Chongqing University Chongqing 400030 China)
Cell electrofusion technology is usually performed by short-term high-voltage electrical pulses with a duration of microseconds to induce cell electroporation. However, exposure to high amplitude microsecond pulses can easily lead to excessive cell electroporation while promoting cell electrofusion, resulting in the death of the fused cells, thereby limiting the efficiency of cell fusion. To increase the rate of cell electrofusion, this paper proposes a method of synergistic induction of cell electrofusion by combining nanosecond and microsecond pulsed electric fields, based on the phenomenon of “super-electroporation” induced by nanosecond pulsed electric field. In this paper, SP2/0 mouse myeloma cells are used as the experimental object. The COMSOL software is used to analyze the distribution of transmembrane voltage and electroporation density on the cell membrane under the exposure of the composite pulse, and preliminary electrofusion experiments are performed to explore the mortality and fusion rate of the fusion method. The simulation results show that under the traditional microsecond pulse, the transmembrane voltage across the two poles of the membrane and the contact area both exceed the perforation threshold, and the significant perforation area exceeds 10%. Besides, under the action of the same dose of nano/microsecond composite pulse, the transmembrane voltage only reaches a higher value in the cell contact area, and the electroporation is also concentrated in this area. Experimental results also prove that this method can guarantee a lower mortality rate (10%) while achieving a higher cell fusion efficiency (75%), which provides new ideas for the further development of cell electrofusion technology.
Cell electrofusion, nano-microsecond pulsed electric fields, fusion efficiency, transmembrane voltage, electroporation density
10.19595/j.cnki.1000-6753.tces.201315
TM11; TM836; Q64
李成祥 男,1979年生,研究員,博士生導師,研究方向為生物醫學中的電工新技術、脈沖強磁場工業應用技術及電力設備在線監測及故障診斷。E-mail: lichengxiang@cqu.edu.cn(通信作者)
李新皓 男,1997年生,碩士研究生,研究方向為生物醫學中的電工新技術。E-mail: lixinhao@cqu.edu.cn
2020-09-29
2021-05-20
國家自然科學基金專項基金(81727802)和國家自然科學基金面上(51677017)資助項目。
(編輯 崔文靜)

