基于形態學和高通量測序的海水池塘生態養殖系統中浮游植物多樣性比較*
喬 玲 常志強 李 健 任成喆
基于形態學和高通量測序的海水池塘生態養殖系統中浮游植物多樣性比較*
喬 玲1常志強2李 健2①任成喆3
(1. 浙江省海洋水產研究所 浙江省海洋漁業資源可持續利用技術研究重點實驗室 浙江 舟山 316021;2. 中國水產科學研究院黃海水產研究所 農業農村部海水養殖病害防治重點實驗室 青島海洋科學與技術試點國家實驗室海洋漁業科學與食物產出過程功能實驗室 山東 青島 266071;3. 浙江海洋大學海洋科學與技術學院 浙江 舟山 316022)
利用形態學鑒定方法結合高通量測序技術,對2018年12月海水池塘生態養殖系統中浮游植物群落組成及多樣性進行研究,結果顯示,2種方法共鑒定浮游植物8個門,綠藻門(Chlorophyta)和隱藻門(Cryptophyta)為主要優勢類群。共鑒定浮游植物39個屬,僅有5個屬,包括裸藻屬()、顫藻屬()、擬菱形藻屬()、塔胞藻屬()和全溝藻屬()為2種方法的共有鑒定結果。一些微微型(≤2 μm)和較小的微型浮游植物(>2 μm且≤10 μm)僅在高通量測序結果中發現,其中,微微型浮游植物占總浮游植物序列豐度的25.24%,較小的微型浮游植物占60.42%。形態學方法調查的浮游植物多樣性指數低于高通量測序方法。因此,利用形態學鑒定方法結合高通量測序技術,更能全面、準確地了解養殖生態系統中浮游植物群落結構及多樣性。
生態養殖;浮游植物;多樣性;形態學分析;高通量測序
海水池塘養殖歷來是我國沿海水產養殖的主要方式,主要以養殖蝦、蟹等甲殼類為主。2019年全國海水池塘養殖面積為376 091 hm2,約占海水養殖總面積的18%左右,海水池塘養殖產量為250.35萬t,約占總產量的12%以上(中國漁業統計年鑒, 2020)。傳統池塘養殖易受氣候條件、環境變化和病害等因素的影響。近年來,傳統海水池塘養殖面臨底質老化和水域環境惡化等突出問題,導致養殖容納量下降,多種病害頻繁暴發。與此同時,池塘養殖尾水排放對周邊水域生態環境造成的壓力日益凸顯,嚴重威脅產業的穩定和可持續發展(王武, 2009)。隨著國家對生態環境的重視程度越來越高,未來的水產養殖要著眼于可持續發展,在提高產量的同時要保證質量,又要注意環境保護,研究和開發“高效、生態、安全”的健康養殖技術和模式已成為國內外漁業生產的重要發展方向。
海水池塘生態養殖模式是一種新興的養殖理念(馬雪健等, 2016),通過基礎食物網的建立,利用不同營養級生物的生活習性,使系統中投餌性養殖單元(如魚、蝦類)產生的殘餌、糞便、營養鹽等有機或無機物質成為其他類型養殖單元(如濾食性貝類)的食物或營養物質來源,將系統內多余的營養物質轉化到養殖生物體內,達到系統內營養物質的高效循環利用,在減輕養殖對環境壓力的同時,提高養殖種類的多樣性和經濟效益(Chopin, 2008; Troell, 2009; Chang, 2020)。該養殖模式已經在世界多個國家,如中國、加拿大、智利、南非、挪威、以色列等廣泛實踐,并取得了諸多積極效果。
浮游植物是養殖生態系統的重要組成部分,不僅可以通過光合作用利用環境中的氮、磷等營養物質,起到調控水質的作用(Harrison, 2005),還可以作為養殖生物的直接或間接餌料(Pulz, 2004)。研究發現,以綠藻和硅藻為優勢種的養殖池水質相對穩定,養殖生物生長較好,而以藍藻為優勢種的養殖池中,養殖生物生長緩慢且易發生病害(蘇永金等, 1994)。綠藻和硅藻不僅對養殖水體有重要的調節作用,而且含有豐富的蛋白質、碳水化合物、維生素等重要營養成分,可滿足養殖生物的營養需求(張繼紅等, 2016);而藍藻,如在養殖后期占優勢的顫藻()、微囊藻(),在富營養化水體中能迅速生長繁殖,釋放大量羥胺、硫化物等物質,致使水體散發腥臭味,有些藻可分泌毒素,危害養殖生物健康生長(Paerl, 1995)。目前,針對原位監測水體中浮游植物的研究更多集中在利用傳統鏡檢鑒定方法(Soares, 2011; 常孟陽等, 2019; 潘玉龍等, 2019)。鏡檢鑒定方法主要基于細胞形態對浮游植物進行鑒定分類,不僅費時耗力,且容易遺漏個體較小或豐度較低的物種(Manoylov, 2014),不能全面、準確地評價水生生態系統中浮游植物群落結構及多樣性。近年來,隨著分子生物學技術的發展,高通量測序技術被廣泛應用于浮游植物群落結構和多樣性研究(Penna, 2017; Oliveira, 2018)。與形態學方法相比,高通量測序技術省時節力、靈敏度高、檢出限低(Reuter, 2015),可檢測到豐度低、個體小的物種,甚至可能會發現新物種(de Vargas, 2015; Oliveira, 2018)。但高通量測序不能對浮游植物進行絕對定量,且可能會高估某些物種的相對豐度,因此,僅利用高通量測序評價浮游植物群落結構也是不準確的(Quince, 2009)。
本研究利用形態學鑒定方法結合高通量測序技術調查養殖末期蝦–蟹–魚混養池塘和貝養殖池中浮游植物群落組成和多樣性,比較分析2種檢測方法獲得的結果,探討基于形態學和高通量測序檢獲的浮游植物群落組成和多樣性的異同,為更全面、準確研究浮游植物群落結構及多樣性提供理論依據。
1 材料與方法
1.1 樣品采集
樣品于2018年12月采自山東省日照開航水產有限公司。該海水池塘生態養殖系統由蝦–蟹–魚混養池塘和貝養殖池組成,混養池塘中混養品種分別為中國對蝦()、三疣梭子蟹()和羅非魚(),貝養殖池中養殖品種為文蛤()。用YSI手持式多參數水質分析儀(YSI Incorporated,美國)現場測定水溫、鹽度、溶解氧和pH;取1 L水樣,加入5 mL魯格試劑固定后用于浮游植物形態學鑒定與計數;取100 mL水樣經0.22 μm微孔濾膜過濾,濾膜用于高通量測序分析浮游植物群落組成,濾液用于氨氮(NH4+)、硝態氮(NO3–)、亞硝態氮(NO2–)、磷酸鹽(DIP)、硅酸鹽(DSi)、總溶解氮(DTN)和總溶解磷(DTP)濃度的測定。
1.2 水質參數測定
養殖水體中NH4+、NO3–、NO2–、DIP和DSi濃度采用QuAAtro營養鹽自動分析儀(Seal Analytical Ltd., 德國)測定;先用堿性過硫酸鹽消化,用營養鹽自動分析儀測定DTN和DTP濃度;溶解無機氮(DIN)濃度為NH4+、NO3–和NO2–濃度之和;溶解有機氮(DON)和溶解有機磷(DOP)濃度分別為DTN與DIN和DTP與DIP濃度之差。
1.3 浮游植物形態學分析
采集1 L未過濾水樣,加5 mL魯格試劑固定,樣品帶回實驗室后,濃縮至50 mL,然后用光學顯微鏡進行物種鑒定和計數。
1.4 浮游植物高通量測序和生物信息分析
采用土壤DNA提取試劑盒(MP Biomedicals, 美國)提取樣品總DNA。用23S rDNA引物p23SrV_f1 (5′-GGA CAG AAA GAC CCT ATG AA-3′)和p23SrV_r1 (5′-TCA GCC TGT TAT CCC TAG AG-3′) (Sherwood, 2007)對樣品DNA進行PCR擴增,反應產物用2%瓊脂糖凝膠電泳檢測,然后用PCR產物純化試劑盒(Axygen Biosciences, 美國)純化上述所得的PCR產物,利用QuantiFluor?-ST (Promega, 美國)進行定量檢測,純化后的PCR產物送美吉測序公司采用Illumina MiSeq平臺進行PE300測序。本研究測序得到的23S rDNA基因核酸序列已上傳至美國國立生物技術信息中心(NCBI)高通量測序數據庫Sequence Read Archive (SRA),登錄號為SRP185765。
下機后的數據用軟件QIIME (V1.70)處理。使用Trimmomatic軟件對原始數據進行質量控制,并用FLASH軟件進行拼接,使用UPARSE軟件(V7.1 http://drive5.com/uparse/)以99%的相似度對序列進行OTU聚類,并用UCHIME軟件去除嵌合體,利用BLAST在NCBI數據庫對每條序列進行物種分類注釋。保留所有注釋到真核浮游藻類和藍藻的序列,用于后續浮游植物群落組成分析。
1.5 浮游植物群落分析
浮游植物在門水平和屬水平上的相對豐度以該類別的細胞密度或序列數占總細胞密度或總序列數的比例來表征;浮游植物群落結構多樣性則是用香農–威納多樣性指數來衡量。本研究中,浮游植物按粒徑大小分為微微型浮游植物(≤2 μm)、較小的微型浮游植物(>2 μm且≤10 μm)、較大的微型浮游植物(>10 μm且≤20 μm)和小型浮游植物(>20 μm且<200 μm)。
2 結果
2.1 水質分析
海水池塘生態養殖系統的水質參數見表1。該海水池塘生態養殖系統中的平均水溫、鹽度、pH分別為4.87℃、26.01 g/L和9.03;蝦–蟹–魚混養池塘中的溶解氧濃度高于貝養殖池,分別為10.29 mg/L和9.08 mg/L。混養池塘中的NH4+、NO3–和NO2–濃度均低于貝養殖池,而DON濃度則是混養池塘中的高;混養池塘和貝養殖池中的DIP濃度均為0.02 mg/L,DOP濃度分別為0.02 mg/L和0.03 mg/L;混養池塘中DSi濃度低于貝養殖池,分別為0.55 mg/L和0.95 mg/L。
表1 海水池塘生態養殖系統中的水質參數

Tab.1 Quality parameters of water in the ecological aquaculture system in marine pond
2.2 高通量測序結果分析
對蝦–蟹–魚混養池塘和貝養殖池中浮游生物的23S rDNA進行Illumina高通量測序,分別獲得71 097和70 324條原始序列,通過質量控制分別得到64 298和60 599條高質量序列,平均序列長度為388 bp,在99%相似性水平上劃分OTU,共得到283個OTU (表2)。利用BLAST在NCBI數據庫對每個OTU的代表序列進行物種分類注釋,注釋到真核生物和細菌的序列數分別占總序列數的54%和43%。在門水平上,變形菌門(Proteobacteria)和隱藻門(Cryptophyta)的相對豐度最高,分別為38.33%和33.33%,其次為綠藻門(Chlorophyta, 11.12%)、硅藻門(Bacillariophyta, 7.99%)和疣微菌門(Verrucomicrobia, 2.85%),其余門的相對豐度均低于1% (圖1)。保留所有注釋到真核浮游藻類和藍藻的序列,共得到72個OTU、66 300條序列,混養池塘和貝養殖池中OTU數分別為51和37,序列數分別為41 247和25 053,混養池塘高于貝養殖池(表2)。
表2 不同池塘樣品中序列數和OTU數

Tab.2 Number of sequences and OTUs from different ponds

圖1 海水池塘生態養殖系統中真核生物和細菌組成
2.3 浮游植物多樣性分析
利用形態學方法和高通量測序技術分析蝦–蟹–魚混養池和貝養殖池中浮游植物多樣性發現,混養池塘中浮游植物多樣性指數低于貝養殖池,且形態學方法調查的浮游植物多樣性指數低于高通量測序方法(圖2)。
2.4 浮游植物群落結構
門水平上,利用形態學鑒定方法共鑒定浮游植物6個門,分別為隱藻門、綠藻門、硅藻門、藍藻門(Cyanophyta)、甲藻門(Dinophyta)和裸藻門(Euglenophyta),其中,綠藻門平均相對豐度最高,達90%以上。蝦–蟹–魚混養池和貝養殖池中綠藻門的細胞密度分別為1.03×107cells/L和3.51×105cells/L,分別占總細胞密度的99.85%和91.05%。利用高通量測序技術共鑒定浮游植物8個門,除形態學方法鑒定出的6個門,還包括定鞭藻門(Haptophyta)和金藻門(Chrysophyta),8個門中,隱藻門的平均相對豐度最高,為60.11%,其次為綠藻門(26.64%)和硅藻門(12.20%)。混養池中,隱藻門的相對豐度最高(70.57%),其次為硅藻門(24.10%)和綠藻門(3.59%);貝養殖池中,綠藻門和隱藻門的相對豐度較高,分別為49.68%和49.64%(圖3)。
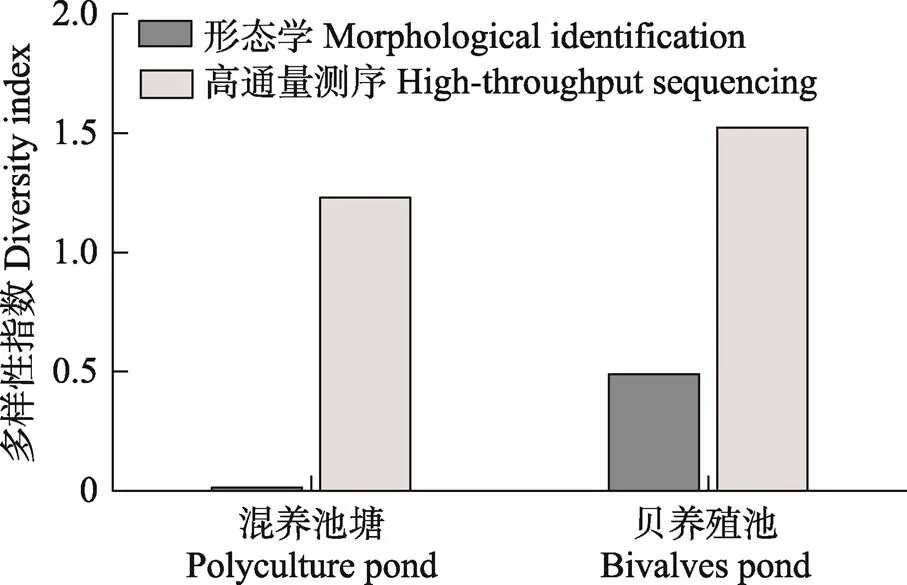
圖2 海水池塘生態養殖系統中浮游植物多樣性

圖3 海水池塘生態養殖系統中浮游植物在門水平和屬水平上的相對豐度
屬水平上,利用形態學鑒定方法共鑒定浮游植物14個屬,其中,塔胞藻屬的平均相對豐度最高,蝦–蟹–魚混養池塘和貝養殖池中的相對豐度分別為99.85%和91.05%。利用高通量測序技術共鑒定浮游植物30個屬,其中,全溝藻屬()的平均相對豐度最高(58.31%),其次為微球藻屬() (17.62%)、輻環藻屬() (7.87%)、微胞藻屬() (7.25%)、海鏈藻屬() (3.40%)、蛋白藻屬()(1.78%)和(1.62%),其余屬的相對密度均低于1%。混養池塘中全溝藻屬的相對豐度最高(68.81%),其次為輻環藻屬(15.69%)和海鏈藻屬(6.79%);貝養殖池中,全溝藻屬的相對豐度最高,為47.81%,其次為微球藻屬(35.23%)和微胞藻屬(14.35%) (圖3)。
種水平上,利用形態學鑒定方法共鑒定浮游植物16種(表3),混養池塘中塔胞藻的細胞密度最高,為1.03×107cells/L,其次是裸甲藻,達8.00×103cells/L;貝養殖池中也是塔胞藻細胞密度最高,細胞密度為3.51×105cells/L,其次是尖尾藍隱藻和菱形藻,細胞密度分別為9.00×103cells/L和8.00×103cells/L。對比發現,混養池中浮游植物種數低于貝養池。
表3 形態學鑒定方法揭示的浮游植物及其細胞密度

Tab.3 Phytoplankton cell density revealed by morphological analysis
3 討論
池塘養殖是我國傳統的養殖模式,在我國水產養殖發展中占據舉足輕重的地位。近年來,傳統海水池塘養殖面臨著底質老化和水域環境惡化等突出問題,導致養殖容納量下降,多種病害頻繁暴發,養殖尾水的排出還可能加劇周邊區域的水體富營養化,嚴重制約著海水池塘養殖產業的可持續發展(王武, 2009)。隨著國家對生態環境的重視程度越來越高,海水池塘生態養殖模式因環境友好、生態高效的特點得到了迅速發展(馬雪健等, 2016)。浮游植物是養殖生態系統中的重要組成部分,一些浮游植物,如硅藻和綠藻,營養價值高且無毒害作用,對養殖是有益的(Roy, 2015; Brito, 2016);一些浮游植物,如藍藻和甲藻,營養價值低且可能會產生毒素,不利于養殖生物的生長(Sinden, 2016; Pérez-Morales, 2017)。因此,了解浮游植物群落,對如何構建經濟、安全、有效的生態養殖模式有重要的科學依據和現實意義。
本研究中,利用形態學鑒定方法結合高通量測序技術研究了海水池塘生態養殖系統中浮游植物群落結構,共鑒定浮游植物8個門,形態學鑒定結果中,綠藻門的平均相對豐度最高,達90%以上,而高通量測序結果中,綠藻門和隱藻門的相對豐度較高;8個門中有2個門(定鞭藻門和金藻門)僅在高通量測序結果中出現,鏡檢并未檢測到(圖3)。屬水平上,2種方法共鑒定浮游植物39個屬,僅有5個屬是2種方法鑒定結果中共有的,包括裸藻屬()、顫藻屬()、擬菱形藻屬()、塔胞藻屬()和全溝藻屬()(圖3)。此外,形態學方法調查的浮游植物多樣性指數低于高通量測序方法(圖2)。
形態學鑒定結果和高通量測序結果產生差異的原因包括以下幾個方面。首先,形態學鑒定方法主要基于細胞形態對浮游植物進行鑒定分類,對一些形態相似、細胞較小或豐度較低的類群,該方法難以識別和鑒定(Manoylov, 2014)。而高通量測序技術檢測速度快、檢出限低,可以極大地擴展對水生生態系統中浮游植物多樣性的認識(Reuter, 2015)。本研究中,利用高通量測序檢測到一些微微型和較小的微型浮游植物,但在顯微鏡鑒定結果中并未出現(表4),其中,微微型浮游植物占總浮游植物序列豐度的25.24%,較小的微型浮游植物占總浮游植物序列豐度的60.42%。其次,高通量測序不能對物種進行絕對定量,利用物種的相對豐度對物種進行定量分析可能會高估其豐度,一方面,浮游植物基因組的rDNA序列包含大量重復序列(Schippers, 2006),基因拷貝數的變化可能會影響物種的相對豐度(Reeder, 2010);另一方面,通過高通量測序還可以檢測到某些類群的休眠細胞、死亡細胞或分子碎片,從而高估其相對豐度。第三,23S rDNA的數據庫不完整,分類信息并不能覆蓋所有物種,通過核苷酸搜索發現,該數據庫中缺少雙眉藻屬()等的23S rDNA序列,因此,需要進一步完善23S rDNA參考數據庫,提高其物種分類信息的覆蓋率。綜上所述,利用傳統的形態學鑒定方法結合分子生物學技術更能全面地揭示養殖系統中浮游植物群落組成和多樣性。
利用形態學鑒定方法調查海水池塘生態養殖系統中浮游植物群落組成及多樣性發現,塔胞藻為絕對優勢種,其在蝦–蟹–魚混養池和貝養殖池中的細胞密度分別為1.03×107cells/L和3.51×105cells/L,分別占總細胞密度的99.85%和91.05% (圖3)。塔胞藻屬于綠藻門,易培養,溫度耐受性好,且細胞內含有豐富的蛋白質、多糖和不飽和脂肪酸等營養物質(張福綏等, 1983; 繆錦來等, 2005),被廣泛應用于雙殼類的養殖及養蝦前期培樣中(張福綏等, 1984; 王廷貴, 2011)。研究表明,塔胞藻對貽貝()幼蟲、蝦夷扇貝()幼蟲和櫛孔扇貝()幼蟲的飼養效果比常用的褐指藻、扁藻及小球藻等的效果要好(張福綏等, 1983)。本研究中,貝養殖池中塔胞藻的細胞密度比蝦–蟹–魚混養池中低了2個數量級,可能與文蛤對塔胞藻德攝食有關。此外,塔胞藻對海水中的苯、苯酚、二甲苯等有機物及敵敵畏、氧化樂果、辛硫磷等常見農藥具有較強的吸附作用,對有機物和農藥造成的污染有一定的凈化作用,且藻細胞密度達到1.0×104cells/mL時,凈化效果最顯著(張建民等, 2006、2007)。塔胞藻還含有抗植物病原菌成分,抑菌效果非常明顯(江紅霞等, 2008、2009)。
利用高通量測序技術調查海水池塘生態養殖系統中浮游植物群落組成及多樣性發現,雙尖全溝藻()的平均相對豐度最高,為52.30% (表4)。雙尖全溝藻屬于隱藻門,廣泛分布于許多國家的沿海地區(Yoo, 2017)。研究發現,雙尖全溝藻可以以完整細胞形式在紅色中縊蟲()(赤潮種)體內進行內共生,紅色中縊蟲一方面幫助隱藻從環境中吸收營養物質供隱藻細胞增殖所用,另一方面又從隱藻的光合產物中獲益,而鰭藻()又通過攝食紅色中縊蟲而獲得隱藻的葉綠體(Kim, 2015; Qiu, 2016)。因此,雙尖全溝藻在海洋食物網中占有重要地位。微球藻屬和微胞藻屬是通過高通量測序檢測到的2種微微型綠藻,分別占總浮游植物序列豐度的17.62%和7.25% (圖3)。研究發現,它們廣泛分布在世界各地的沿海地區(Foulon, 2010; Rodríguez, 2010; Kilias, 2014; Rashid, 2018),微球藻屬甚至會形成短暫的藻華(O’Kelly, 2003),但在以往對黃海海域的浮游植物調查中并未發現該藻(黃備等, 2018)。這可能是因為微球藻屬和微胞藻屬的細胞均< 3 μm,利用光學顯微鏡難以辨別。因此,僅利用形態學鑒定方法并不能全面、準確地評價水生生態系統中浮游植物群落結構及多樣性。
水產養殖的關鍵環境問題之一是營養物質的積累,這會導致水質惡化和有害藻的繁殖(Huang, 2016)。研究表明,海水池塘生態養殖模式不僅比傳統的單種養殖具有更高的營養物質利用效率,而且可以提高水產養殖的產量(Li, 2019),但池塘養殖的經濟效益和生態影響很大程度上取決于養殖品種的組成(Jena, 2002; Rahman, 2007)。本研究中,蝦–蟹–魚混養池塘中的混養品種為中國對蝦、三疣梭子蟹和羅非魚,貝養殖池中養殖品種為文蛤。羅非魚是一種濾食雜食性魚類,其選擇性攝食對浮游植物的豐度及組成有很大影響(Menezes, 2010; Sun, 2011)。研究表明,羅非魚的攝食選擇性隨體重的增加而略有變化(Abdel-Tawwab, 2011),羅非魚在整個生長過程中均可攝食藍藻和裸藻類,體重較大的魚對綠藻和硅藻的選擇性較弱,這個可能是混養池塘中綠藻和硅藻相對豐度較高的原因之一(圖3)。貝類的生長對溫度和餌料的變化具有很強的適應性,是池塘生態養殖模式中的常見物種(Troell, 2009)。濾食性貝類具有很發達的濾水系統,可以通過生物過濾作用攝食水體中的微藻及顆粒有機物,從而對浮游植物豐度產生影響。本研究中,貝養殖池中浮游植物總密度為3.86×105cells/L(表3),比混養池低2個數量級,這可能與貝類攝食有關。研究表明,貝類對浮游植物的攝食也具有選擇性,從而影響浮游植物群落結構(Newell, 2004)。本研究中,貝養殖池中微微型浮游植物如微球藻屬和微胞藻屬的序列豐度較高,占總浮游植物序列豐度的35.23%和14.25% (圖3)。研究發現,與個體較小的微微型浮游植物(< 2 μm)相比,微型浮游植物(2~20 μm)更容易被攝食(Newell, 2004),從而有利于微微型浮游植物的生長繁殖(Newell, 2009)。除了細胞大小,取食的選擇性還取決于浮游植物的游動能力(Zhuang, 2004)。全溝藻有鞭毛,可以自由移動(Laza-Martínez, 2012),從而不易被攝食,這可能是其相對豐度較高的原因之一。

綜上所述,利用形態學鑒定方法結合高通量測序技術研究海水池塘生態養殖系統中浮游植物群落組成及多樣性,2種方法共鑒定浮游植物8個門,綠藻門和隱藻門為主要優勢類群;共鑒定浮游植物39個屬,僅有5個屬是2種方法鑒定結果中共有的,包括裸藻屬、顫藻屬、擬菱形藻屬、塔胞藻屬和全溝藻屬;一些微微型(≤2 μm)和較小的微型浮游植物(>2 μm且≤10 μm)僅在高通量測序結果中發現,其中,微微型浮游植物占總浮游植物序列豐度的25.24%,較小的微型浮游植物占總浮游植物序列豐度的60.42%;形態學方法調查的浮游植物多樣性指數低于高通量測序方法。因此,利用形態學鑒定方法結合高通量測序技術,更能全面、準確地了解養殖生態系統中浮游植物群落結構及多樣性。本研究僅對該養殖系統進行了一次取樣調查,未對海水池塘生態養殖系統中浮游植物群落動態進行描述。因此,有必要進行連續監測調查,以探索海水池塘生態養殖系統中浮游植物群落的演替規律,并闡明該演替的主要驅動因素。本研究結果為后續利用形態學結合分子手段進行海水池塘生態養殖系統中浮游植物群落演替規律及其關鍵驅動因素的研究奠定了基礎。
ABDEL-TAWWAB M. Natural food selectivity changes with weights of Nile tilapia,(Linnaeus), reared in fertilized earthen ponds. Journal of Applied Aquaculture, 2011, 23(1): 58–66
AMSPOKER M C.sp. nov. a marine epipsammic diatom from Southern California, USA. Diatom Research, 2016, 31(4): 1–7
BERGHOLTZ T, DAUGBJERG N, MOESTRUP ?,. On the identity ofand description ofsp. nov. (Dinophyceae), based on light and electron microscopy, nuclear-encoded LSU rDNA, and pigment composition. Journal of Phycology, 2010, 42(1): 170–193
BRITO LO, DOS SANTOS I G S, DE ABREU JL. Effect of the addition of Bacillariophyta (spp.) and rotifers () on water quality and growth of thepostlarvae reared in a biofloc system. Aquaculture Research, 2016, 47(12): 3990–3997
CHANG M Y, LI C L, DONG J,. Dynamic changes of phytoplankton composition during cyanobacteria blooms in aquaculture ponds. Progress in Fishery Sciences, 2019, 40(1): 36–45 [常孟陽, 李晨露, 董靜, 等. 藍藻水華暴發期間養殖池塘浮游藻類動態變化. 漁業科學進展, 2019, 40(1): 36–45]
CHANG Z Q, NEORI A, HE Y Y,. Development and current state of seawater shrimp farming, with an emphasis on integrated multi-trophic pond aquaculture farms, in China: A review. Reviews in Aquaculture, 2020, 12(4): 2544–2558
CHOPIN T, ROBINSON S M C, TROELL M,. Multitrophic integration for sustainable marine aquaculture. Encyclopedia of Ecology, 2008, 2463–2475
DE VARGAS C, AUDIC S, HENRY N,. Eukaryotic plankton diversity in the sunlit ocean. Science, 2015, 348(17): 1261605
DROOP M R. Some new supra-littoral Protista. Journal of the Marine Biological Association of the United Kingdom, 1955, 34(2): 233–245
Fishery Administration Bureau of Ministry of Agriculture and Rural Affairs, National Aquatic Technology Extension Station, China Society of Fisheries. China fishery statistical yearbook. Beijing: China Agriculture Publishing House, 2020 [農業農村部漁業漁政管理局, 全國水產技術推廣總站, 中國水產學會. 中國漁業統計年鑒. 北京: 中國農業出版社, 2020]
FOULON E, NOT F, JALABERT F,. Ecological niche partitioning in the picoplanktonic green alga: Evidence from environmental surveys using phylogenetic probes. Environmental Microbiology, 2010, 10(9): 2433–2443
HARRISON W G, PERRY T, LI W K W. Ecosystem indicators of water quality Part I. Plankton biomass, primary production and nutrient demand. In Anderson R (Ed.), Environmental Effects of Marine Finfish Aquaculture. Berlin Heidelberg: Springer, 2005, 59–82
HEIMANN K, BENTING J, TIMMERMANN S,. The flagellar developmental cycle in algae: Two types of flagellar development in uniflagellate algae. Protoplasma, 1989,153(1/2): 14–23
HERDMAN M, CASTENHOLZ R W, WATERBURY J B,. Form-genus XIII. Synechococcus. In: Boone DR, Castenholz RW (Eds.), Bergey’s Manual of Systematic Bacteriology, Springer-Verlag, New York, 2001, 508–512
HUANG B, WEI N, TANG J L,. Changes of phytoplankton community structure and diversity in the south Yellow Sea during 2007–2017. Environmental Monitoring in China, 2018, 34(6): 137–148 [黃備, 魏娜, 唐靜亮, 等. 南黃海2007–2017年浮游植物群落結構及多樣性變化. 中國環境監測, 2018, 34(6): 137–148]
HUANG S, WU M, ZANG C,. Dynamics of algae growth and nutrients in experimental enclosures culturing bighead carp and common carp: Phosphorus dynamics. International Journal of Sediment Research, 2016, 31(2): 173–180
JENA JK, AYYAPPAN S, ARAVINDAKSHAN P K,. Evaluation of production performance in carp polyculture with different stocking densities and species combinations. Journal of Applied Ichthyology, 2002, 18(3): 165–171
JIANG H X, LEI H J, XUAN W J. Studies on antimicrobial activities against three plant pathogen by using eleven microalgae extracts. Journal of Anhui Agricultural Sciences, 2008, 38(10): 4167–4169 [江紅霞, 雷紅娟, 軒文娟. 11種微藻提取物對3種植物病原菌抗菌活性的研究. 安徽農業科學, 2008, 38(10): 4167–4169]
JIANG H X, ZHOU X Y, LEI M Y,. Antimicrobial activities and chemical compositions of liposoluble compounds in. Journal of Henan Agricultural Sciences, 2009(8): 88–91 [江紅霞, 周曉楊, 雷夢云, 等. 嬌柔塔胞藻脂溶性化合物抗植物病原菌活性及成分分析. 河南農業科學, 2009(8): 88–91]
KILIAS E S, N?THIG E M, WOLF C,. Picoeukaryote plankton composition off West Spitsbergen at the entrance to the Arctic Ocean. Journal of Eukaryotic Microbiology, 2014, 61(6): 569–579
KIM J I, YOON H S, YI G,. The plastid genome of the cryptomonad. PLoS One, 2015, 10(6): e0129284
LAZA-MARTíNEZ A, ARLUZEA J, MIGUEL I,. Morphological and molecular characterization ofsp. nov. andsp. nov.(Cryptophyceae). Phycologia, 2012, 36(1): 37–52
LI Y, QIN J, ZHENG X,. Production performance of largemouth bassand water quality variation in monoculture, polyculture and integrated culture. Aquaculture Research, 2019, 50(2): 423–430
MA X J, LIU D H, HU G B,. Development of integrated multi trophic aquaculture mode and its application on management. Ocean Development and Management, 2016, 33(4): 74–78 [馬雪健, 劉大海, 胡國斌, 等. 多營養層次綜合養殖模式的發展及其管理應用研究. 海洋開發與管理, 2016, 33(4): 74–78]
MANOYLOV K M. Taxonomic identification of algae (morphological and molecular): Species concepts, methodologies, and their implications for ecological bioassessment. Journal of Phycology, 2014, 50(3): 409–424
MEDLIN L K, ELWOOD H J, STICKEL S,. Morphological and genetic variation within the diatom(Bacillariophyta): Evidence for a new species,. Journal of Phycology, 2010, 27(4): 514–524
MENEZES R F, ATTAYDE J L, VASCONCELOS F R. Effects of omnivorous filter-feeding fish and nutrient enrichment on the plankton community and water transparency of a tropical reservoir. Freshwater Biology, 2010, 55(4): 767–779
MIAO J L, WANG B, KAN G F,. The influence of environment factors on lipid content and fatty acid composition in two species of Antarctic green microalga. Marine Sciences, 2005, 29(1): 4–11 [繆錦來, 王波, 闞光鋒, 等. 環境因子對2種南極綠藻脂肪含量和脂肪酸組成的影響. 海洋科學, 2005, 29(1): 4–11]
MOESTRUP ?, ETTL H. A light and electron microscopical study of(Prasinophyceae). Opera Botanica, 1979, 49: 1–40
MOESTRUP ?, THRONDSEN J. Light and electron microscopical studies on, a primitive scaly green flagellate (Prasinophyceae) with posterior flagella. Canadian Journal of Botany, 1988, 66(7): 1415–1434
NEWELL R I E, TETTELBACH S T, GOBLER C J,. Relationships between reproduction in suspension-feeding hard clamsand phytoplankton community structure. Marine Ecology Progress, 2009, 387(12): 179–196
NEWELL R I E. Ecosystem influences of natural and cultivated populations of suspension-feeding bivalve molluscs: A review. Journal of Shellfish Research, 2004, 23(1): 51–62
O’KELLY C J, SIERACKI M E, THIER E C. A transient bloom of(Chlorophyta, Prasinophyceae) in west Neck Bay, Long Island, New York. Journal of Phycology, 2003, 39(5): 850–854
OLIVEIRA M C, REPETTI S I, IHA C,. High-throughput sequencing for algal systematics. European Journal of Phycology, 2018,53(3): 1–17
PAERL H W, TUCKER C S. Ecology of blue-chlorophyta in aquaculture ponds. Journal of the World Aquaculture Society, 1995, 26(2): 109–131
PAN Y L, LIU X, SHA J J,. Influence of environmental factors on phytoplankton community structure and its relationship with coastal aquaculture in the waters adjacent to Rongcheng. Progress in Fishery Sciences, 2019, 40(5): 26–33 [潘玉龍, 劉瀟, 沙婧婧, 等. 榮成近岸養殖海域浮游植物群落結構及與環境因子的關系. 漁業科學進展, 2019, 40(5): 26–33]
PENNA A, CASABIANCA S, GUERRA A F,. Analysis of phytoplankton assemblage structure in the Mediterranean Sea based on high-throughput sequencing of partial 18S rRNA sequences. Marine Genomics, 2017,36: 49–55
PéREZ-MORALES A, BAND-SCHMIDT C J, MARTíNEZ-DíAZ S F. Mortality on zoea stage of the Pacific white shrimpcaused by(Dinophyceae) andspp. (Raphidophyceae). Marine Biology, 2017, 164(3): 57
PULZ O, GROSS W. Valuable products from biotechnology of microalgae. Applied Microbiology and Biotechnology, 2004, 65(6): 635–648
QIAO H, WANG G, ZHANG X. Isolation and characterization ofGXNN01 (Chlorophyta) with the properties of heterotrophic and microaerobic growth. Journal of Phycology, 2009, 45(5): 1153–1162
QIU D, HUANG L, LIN S. Cryptophyte farming by symbiotic ciliate host detected in situ.eedings of the Nationalemy ofences of the USA, 2016, 113(43): 12208–12213
QUINCE C, LANZéN A, CURTIS T P,. Accurate determination of microbial diversity from 454 pyrosequencing data. Nature Methods, 2009, 6(9): 639–641
RAHMAN M M, VERDEGEM M C. Multi-species fishpond and nutrients balance. In: van der Zijpp A J, Verreth J A J, Tri L Q,. (eds.) Fishponds in farming systems. Wageningen Academic Publishers, Netherlands, 2007, 79–88
RASHID J, KOBIYAMA A, REZA M S,. Seasonal changes in the communities of photosynthetic picoeukaryotes in Ofunato Bay as revealed by shotgun metagenomic sequencing. Gene, 2018, 665: 127–132
REEDER J, KNIGHT R. Rapidly denoising pyrosequencing amplicon reads by exploiting rank-abundance distributions. Nature Methods, 2010, 7(9): 668–669
REUTER J, SPACEK D V, SNYDER M. High-throughput sequencing technologies. Molecular Cell, 2015, 58(4): 586– 597
RIPPKA R, CASTENHOLZ R W, HERDMAN M. Form- Cyanobium. Bergey's manual of systematics of archaea and bacteria. John Wiley & Sons, Ltd, 2015
RODRíGUEZ F, DERELLE E, GUILLOU L,. Ecotype diversity in the marine picoeukaryote(Chlorophyta, Prasinophyceae). Environmental Microbiology, 2010, 7(6): 853–859
ROY S S, PAL R. Microalgae in aquaculture: A review with special references to nutritional value and fish dietetics. Proceedings of the Zoological Society, 2015, 68(1): 1–8
SCHIPPERS A, NERETIN L N. Quantification of microbial communities in near-surface and deeply buried marine sediments on the Peru continental margin using real-time PCR. Environmental Microbiology, 2006, 8(7): 1251–1260
SHERWOOD AR, PRESTING G G. Universal primers amplify a 23S rDNA plastid marker in eukaryotic algae and cyanobacteria. Journal of Phycology, 2010, 43(3): 605–608
SINDEN A, SINANG S C. Cyanobacteria in aquaculture systems: Linking the occurrence, abundance and toxicity with rising temperatures. International Journal of Environmental Science and Technology, 2016, 13(12): 1–8
SLANKIS T, GIBBS S P. The fine structure of mitosis and cell division in the Chrysophycean alga. Journal of Phycology, 2008, 8(3): 243–256
SOARES M C S, LúCIA M L, VIDAL L O,. Light microscopy in aquatic ecology: Methods for plankton communities studies. Methods in Molecular Biology, 2011, 689: 215–227
SU Y J, CAI X Y, WANG J,. A preliminary study on water quality affected by algae in shrimp ponds.Journal of Fisheries Research, 1994(4): 36–39 [蘇永金, 蔡心一, 王軍, 等. 藻類影響蝦池若干水質因子初探. 漁業研究, 1994(4): 36–39]
SUBIRANA L, PéQUIN B, MICHELY S,. Morphology, genome plasticity, and phylogeny in the genusreveal a cryptic species,sp. nov. (Mamiellales, Mamiellophyceae). Protist, 2013, 164(5): 643–659
SUN W, DONG S, JIE Z,. The impact of net-isolated polyculture of tilapia () on plankton community in saline-alkaline pond of shrimp (). Aquaculture International, 2011, 19(4): 779–788
SYM S D, PIENAAR R N. Taxonomy ofand other observations on the subgenus Vestigifera of(Prasinophyceae, Chlorophyta). Phycological Research, 1995, 43(1): 17–32
TOMAS C R. Identifying marine phytoplankton. Academic Press, New York, 1997
TROELL M, JOYCE A, CHOPIN T,. Ecological engineering in aquaculture-potential for integrated multi- trophic aquaculture (IMTA) in marine offshore systems. Aquaculture, 2009, 297(1): 1–9
VAULOT D, EIKREM W, VIPREY M,. The diversity of small eukaryotic phytoplankton (≤3 μm) in marine ecosystems. FEMS Microbiology Reviews, 2008,32(5): 795–820
WANG T G. Overwintering cultivation technique of bay scallop. Hebei Fisheries, 2011(12): 42–43 [王廷貴. 海灣扇貝種貝越冬培育技術. 河北漁業, 2011(12): 42–43]
WANG W. Current situation and development trend of aquaculture industry in China. Fishery Guide to be Rich, 2009, 271(7): 12–18 [王武. 我國水產養殖業的現狀與發展趨勢. 漁業致富指南, 2009, 271(7): 12–18]
WEI Y X. Chrysochromulina parva lackey (Prymnesiophyceae): New record in China and its seasonal fluctuation in Lake Donghu, Wuhan. Acta Hydrobiologica Sinica, 1996, 20(4): 317–321 [魏印心. 中國新記錄: 小金色藻在武漢東湖的季節消長. 水生生物學報, 1996, 20(4): 317–321]
YOO Y, SEONG K A, JEONG H J,. Mixotrophy in the marine red-tide cryptophyteand ingestion and grazing impact of cryptophytes on natural populations of bacteria in Korean coastal waters. Harmful Algae, 2017, 68: 105–117
ZHANG F S, HE Y C, MA J H,. The introduction of the Japanese scallop,(Jay), into China, its spat-rearing and experimental cultivation. Marine Sciences, 1984, 8(5): 38–45 [張福綏, 何義朝, 馬江虎, 等. 蝦夷扇貝的引種、育苗及試養. 海洋科學, 1984, 8(5): 38–45]
ZHANG F S, LI S Y. Discovery ofsp. in China seas and its application in feeding bivalve larvae. Marine Sciences, 1983, 7(6): 49–50 [張福綏, 李淑英. 塔胞藻在中國海的發現與應用. 海洋科學, 1983, 7(6): 49–50]
ZHANG J M, HAN X D, JIA H F. The study of decontamination of microalgae to organic compound in the ocean. Journal of Linyi Teachers′ College, 2006, 28(3): 79–82 [張建民, 韓曉弟, 賈宏福. 海洋微藻對海水中有機物的凈化作用研究. 臨沂師范學院學報, 2006, 28(3): 79–82]
ZHANG J M, HAN X D, WANG X W,. The study of decontamination of microalgae to pesticide in the ocean. Journal of Yunnan Agricultural University, 2007, 22(3): 462–465 [張建民, 韓曉弟, 王相偉, 等. 塔胞藻對海水中農藥的響應及凈化作用初步研究. 云南農業大學學報, 2007, 22(3): 462–465]
ZHANG J H, REN D D, JIANG Y S,. Microalgae in aquaculture: A review to nutritional value and rotifers enrichment. Science and Technology of Food Industry, 2016, 37(20): 371–376 [張繼紅, 任丹丹, 姜玉聲, 等. 微藻營養價值及其在水產生物營養強化中的應用. 食品工業科技, 2016, 37(20): 371–376]
ZHUANG S H, WANG Z Q. Influence of size, habitat and food concentration on the feeding ecology of the bivalve,Linnaeus. Aquaculture, 2004, 241(1/2/3/4): 689–699
Comparison of Phytoplankton Community Diversity in the Ecological Aquaculture System of a Marine Pond Using Morphological Analysis and High-Throughput Sequencing
QIAO Ling1, CHANG Zhiqiang2, LI Jian2①, REN Chengzhe3
(1. Key Laboratory of Sustainable Utilization of Technology Research for Fishery Resource of Zhejiang Province, Zhejiang Marine Fisheries Research Institute, Zhoushan, Zhejiang 316012, China; 2. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs; Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Laboratory for Marine Fisheries and Food Production Processes, Pilot National Laboratory for Marine Sciences and Technology (Qingdao), Qingdao, Shandong 266071, China; 3. Marine Science and Technology College, Zhejiang Ocean University, Zhoushan, Zhejiang 316022, China)
With increasing concern over the negative environmental impact of mariculture, ecological aquaculture based on multi-trophic systems has received extensive attention in recent years. Phytoplankton are important components of aquaculture ecosystems. They are useful in maintaining water quality by uptake of nutrients during photosynthesis and serve as a direct or indirect food source for cultured organisms. Some phytoplankton, such as diatoms and green algae, are conducive to the growth of shrimp, crab, shellfish, and fish, whereas others (such as cyanophytes and dinoflagellates) may be toxic to aquatic organisms in aquaculture systems. In the present study, a combination of traditional morphological analysis and high-throughput sequencing was used to comprehensively assess phytoplankton community composition and diversity in the ecological aquaculture system of a marine pond in December 2018. Eight phyla were detected using two methods, Chlorophyta and Cryptophyta being the most frequently recorded. Notably, the phyla Haptophyta and Chrysophyta were only found via high-throughput sequencing. Additionally, a total of 39 genera were detected using two methods, but only five genera,,,,, andwere shared in both methods. Some picophytoplankton (≤2 μm) and small nanophytoplankton (>2 μm and≤10 μm) were detected via high-throughput sequencing, but were not observed via morphological analysis. Picophytoplankton represented 25.24% of the total phytoplankton sequence abundance, and small nanophytoplankton accounted for 60.42%. Phytoplankton diversity revealed upon morphological analysis was lower than that revealed via high-throughput sequencing. Therefore, the combination of traditional morphological analysis and high-throughput sequencing will be useful for obtaining a comprehensive understanding of phytoplankton community composition and diversity in aquatic ecosystems. This study serves as a foundation for the characterization of phytoplankton community dynamics in the ecological aquaculture systems of marine ponds for future research.
Ecological aquaculture; Phytoplankton community; Diversity; Morphological analysis; High-throughput sequencing
LI Jian, E-mail: lijian@ysfri.ac.cn
S917.3
A
2095-9869(2022)02-0032-12
10.19663/j.issn2095-9869.20201229001
* 國家重點研發計劃課題(2018YFD0900702-4)、國家自然科學基金資助項目(31873039)、浙江省海洋水產研究所博士啟動基金項目(2020B01)和浙江海洋大學博士啟動基金項目(11034150220004)共同資助 [This work was supported by the National Key Research and Development Program of China (2018YFD0900702-4), National Natural Science Foundation of China (31873039), Start-up Foundation for Doctors of Zhejiang Marine Fisheries Research Institute (2020B01), and Start-up Foundation for Doctors of Zhejiang Ocean University (11034150220004)]. 喬 玲,E-mail: qiaoling1990123@126.com
李 健,研究員,E-mail: lijian@ysfri.ac.cn
2020-12-29,
2021-02-02
喬玲, 常志強, 李健, 任成喆. 基于形態學和高通量測序的海水池塘生態養殖系統中浮游植物多樣性比較. 漁業科學進展, 2022, 43(2): 32–43
QIAO L, CHANG Z Q, LI J, REN C Z. Comparison of phytoplankton community diversity in the ecological aquaculture system of a marine pond using morphological analysis and high-throughput sequencing. Progress in Fishery Sciences, 2022, 43(2): 32–43
(編輯 馮小花)

