實驗教學中苯酚硫酸法檢測靈芝多糖的探索*
郜玉欣,孫立權,田 虹
(北京理工大學生命學院,北京 100081)
實驗教學是本科生教學大綱的重要組成部分。開展實驗教學目的就是要培養(yǎng)學生的動手能力、運用書本理論的能力、分析解決問題的能力,養(yǎng)成學生的實事求是的科學態(tài)度和認真細致的工作作風和良好的科學素養(yǎng)。實驗技能也是為學習后續(xù)課程和獨立開展科學研究奠定基礎,有助于對學生的創(chuàng)新思維、創(chuàng)新意識和創(chuàng)新理念的形成[1-4]。隨著科學技術的發(fā)展和儀器價格等降低,原來主要用于前沿科學研究實驗的大量先進儀器設備也越來越多地用于實驗教學。因此,在實驗教學改革中,要結合理論教學積極引入科研中的先進方法和設備,讓實驗教學與理論知識傳授、能力培養(yǎng)和素質提高協(xié)調發(fā)展。 實驗設計時,要本著“將經(jīng)典實驗教學內容進行升級改造,引入現(xiàn)代分析技術,加強綜合性和研究性訓練、促進教與學”的教改思路,來助力“新工科”建設[5-6]。
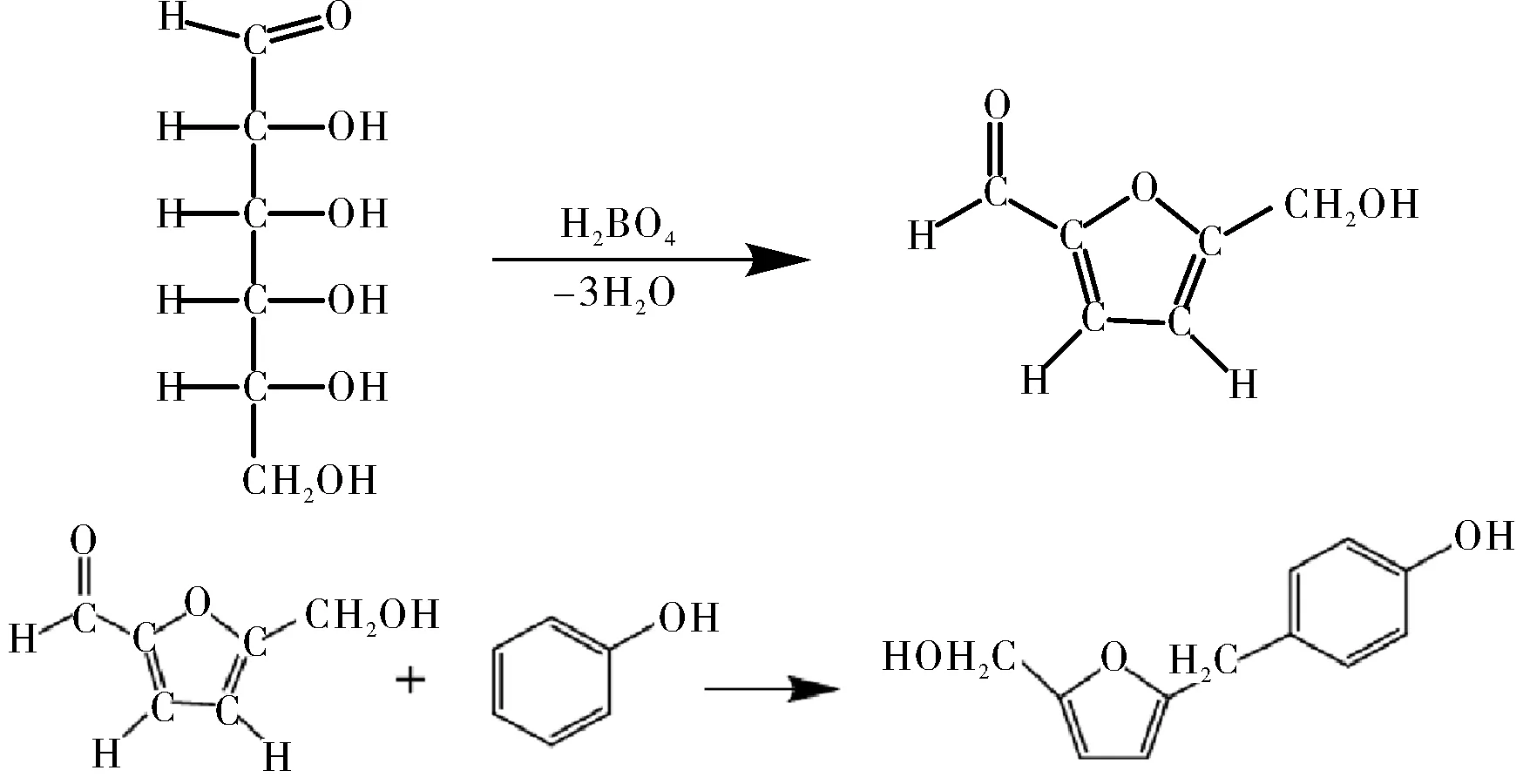
圖1 苯酚-硫酸法反應方程式
多糖提取純化是生物分離工程教學實驗中一個經(jīng)典內容。植物總多糖的檢測可以選擇比色法、色譜法[7]和色質譜聯(lián)用等方法[8]。利用苯酚與被酸水解的單糖顯色反應就是比色法檢測多糖的原理,反應方程式見圖1。分光光度計作為比色法使用的儀器,結構簡單,價格低廉,是利用光吸收定律的基本分析儀器。其中樣品池的容量通常為4 mL,每個樣品的檢測都需要 5~10 mL的濃酸(濃度大于70%硫酸)[9],因此,每次實驗中使用濃硫酸的總量很大。而作為高腐蝕性危化品的濃硫酸在使用過程中具有較高的風險,我們希望在實驗中盡量減少濃硫酸使用量,就不會產生大量酸性廢液,減小廢棄物處理的壓力。
酶標儀作為生物類實驗中基本分析儀器,雖然在光路方向與分光光度計有些不同,但是其工作原理也是遵循光吸收基本定律——朗伯-比爾定律[10],目前基本型號儀器價格也不高,是在生物實驗室中廣泛使用的儀器。與普通分光光度計相比,酶標儀使用多孔板作為盛放樣品的部件,比普通比色皿需要的樣品少,并且可以多個樣品(96孔板同時測96個樣品)同時檢測,增加了檢測通量,提高了檢測速度。酶標儀具有溫度調節(jié)的功能,能夠對樣品進行恒溫加熱[11]。因此,我們以靈芝多糖為檢測對象設計了使用酶標儀檢測提取實驗中多糖的新實驗方案。在方案中可以實現(xiàn)一次測量多個樣品(由孔板上孔數(shù)量決定),同時對樣品加熱,節(jié)約實驗時間,進而節(jié)約苯酚和濃硫酸等試劑,減少酸性廢液產生。實驗內容也有助于學生熟練使用移液槍和96孔板等生物實驗中基本器材,拓展了酶標儀等基本儀器的應用范圍,提升了學生獨立操作的實驗水平,鍛煉了綜合設計實驗和解決問題的能力[12]。
1 實驗部分
1.1 試劑與儀器
靈芝多糖(本實驗室純化樣品);無水葡萄糖、苯酚、濃硫酸,均為分析純試劑,購自伊諾凱科技有限公司。
(ELx808)酶標儀,Bio-rad;(FA2204C)電子天平,上海越平;超聲清洗儀,昆山超聲;(DHG-9030A)鼓風干燥箱,上海齊欣;真空干燥箱,上海一恒。
1.2 實驗方法
1.2.1 實驗溶液配制
(1)靈芝多糖溶液的配制
精密稱定靈芝多糖樣品5.0 mg,置于50ml的容量瓶中,再加蒸餾水定容,配成0.1mg/ml靈芝多糖樣品溶液。
(2)苯酚溶液的配制
精密稱定重蒸[13]苯酚5.0 g,溶解后倒入100 mL棕色的容量瓶中,再加蒸餾水定容,混勻即得。
(3)葡萄糖標準溶液的配制
精密稱定無水葡萄糖標準品5.0 mg,置于50 mL的容量瓶中,再加蒸餾水定容,配成0.1 mg/mL葡萄糖標準品溶液,再分別移取該葡萄糖溶液,配成20、40、60、80和100 μg/mL系列葡萄糖標準溶液。
1.2.2 方法精密度
(1)苯酚-硫酸法線性范圍
分別移取標準葡萄糖溶液(20、40、60、80、100 μg/mL)與5%苯酚溶液以及濃硫酸在96孔板中混合,體積比為1:1:5, 總體積為180 μL,在酶標儀上進行震蕩,反應溫度為25 ℃,顯色時間30 min,測定吸光度,酶標儀檢測波長設置在490 nm,并使用蒸餾水作為試劑空白。繪制標準曲線,用直線回歸方程擬合。
(3)方法穩(wěn)定性考察
分別移取靈芝多糖溶液于96孔板中,按苯酚-硫酸法顯色條件顯色,并在酶標儀對其進行時間-吸光度曲線的掃描,考察其穩(wěn)定性。
1.2.3 單因素試驗
采用苯酚-硫酸法,用葡萄糖標準溶液為對象,分別考察以下因素:苯酚用量:標準溶液/苯酚溶液(V/V)(1:1、1:1.25、1:1.5、1:1.75、1:2);濃硫酸用量:標準溶液/濃硫酸溶液(V/V)(1:4、1:4.25、1:4.5、1:4.75、1:5);反應時間(20、25、30、35、40 min);加熱溫度(60、70、80、90、100 ℃)對吸光度值的影響。
1.2.4 實際多糖含量的測定
取多糖溶液按照單因素確定的最佳條件進行顯色反應,在最佳吸收波長處測得吸光度代入葡萄糖標準曲線,計算靈芝多糖含量。
2 結果與討論
2.1 方法線性范圍考察
以葡萄糖質量濃度為橫坐標、以吸光度為縱坐標,繪制葡萄糖標準曲線如圖3所示,苯酚-硫酸法得出線性回歸方程為 y=0.0037x+0.2433 (R2=0.9993),表明本方法擬合曲線在 0~100 μg/mL范圍內具有良好的線性關系。
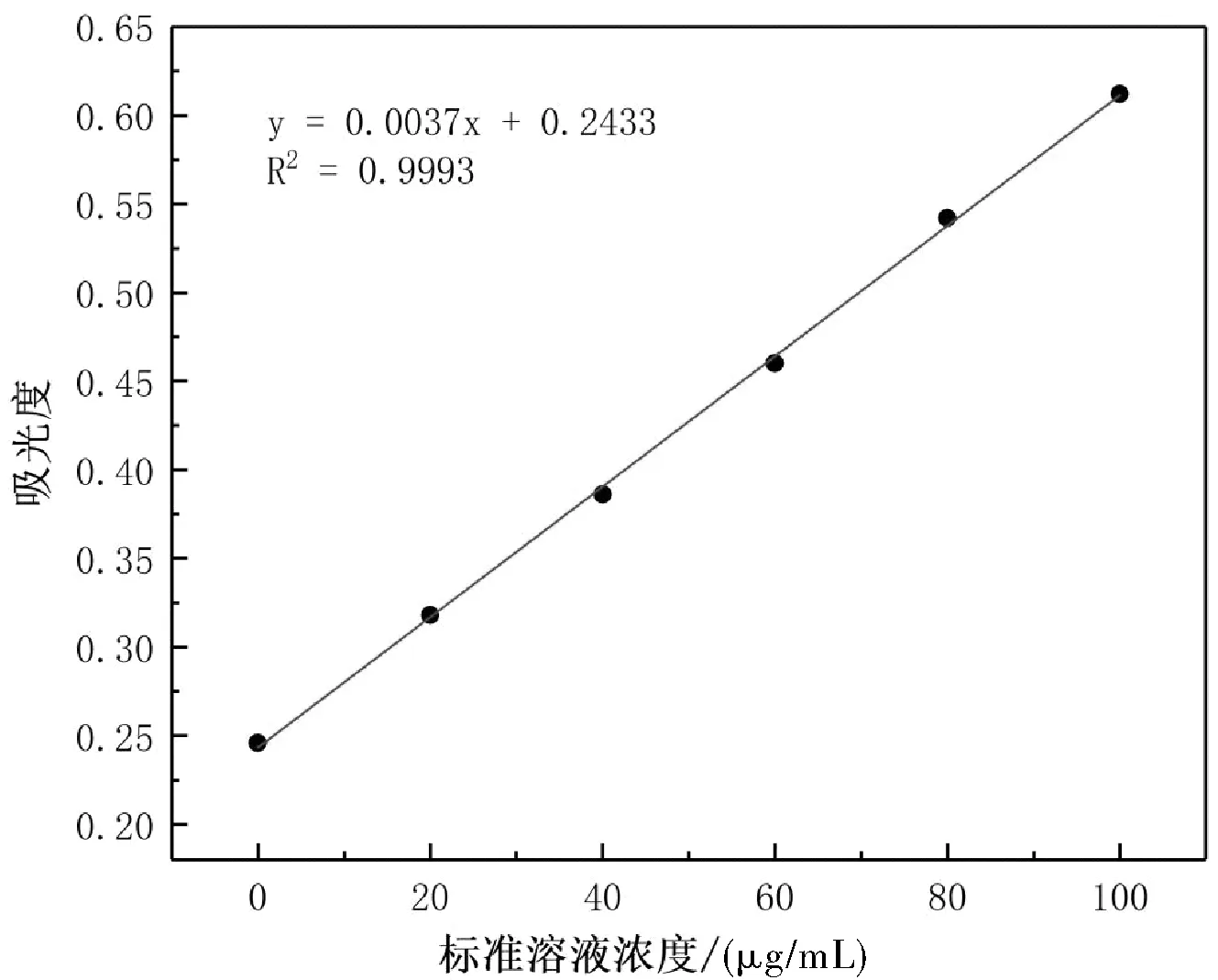
圖2 苯酚-硫酸法的葡萄糖標準曲線
根據(jù)圖2可知,苯酚-硫酸法標準曲線的線性范圍內相關系數(shù)R2為0.9993,表明苯酚-硫酸法標準曲線線性擬合度高、準確。
2.2 方法穩(wěn)定性考察
采用苯酚硫酸法檢測靈芝多糖溶液和葡萄糖標準溶液,用酶標儀進行動力學監(jiān)測,30min內每間隔2 min進行一次檢測,結果如圖3所示。從圖3中可看出苯酚-硫酸法測得的吸光度穩(wěn)定。
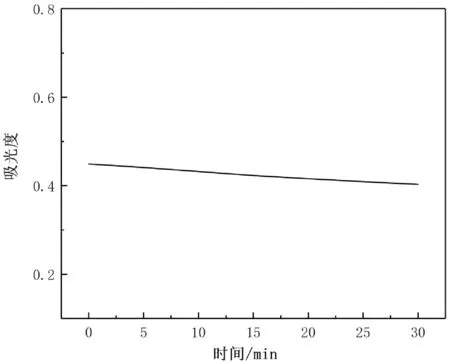
圖3 苯酚-硫酸法的穩(wěn)定性
2.3 苯酚-硫酸法中單因素試驗參數(shù)優(yōu)化
2.3.1 苯酚溶液用量的影響
由圖4可知,葡萄糖標準溶液/苯酚溶液(V/V) 為1:1.5時吸光度值最大,而其他苯酚用量的吸光度均比葡萄糖標準溶液/苯酚溶液(V/V) 為1:1.5時的吸光度小,故合適的待測溶液/苯酚溶液(V/V) 為1:1.5。
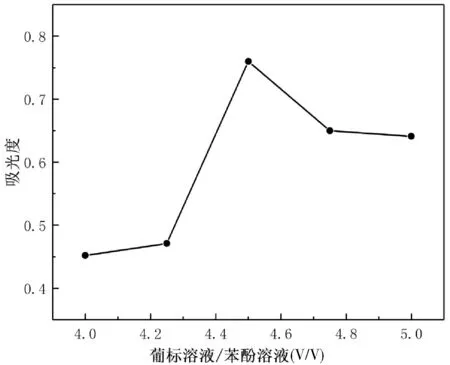
圖4 苯酚-硫酸法中不同苯酚溶液量對吸光度的影響
2.3.2 濃硫酸用量的影響
由圖5可知,葡萄糖標準溶液/濃硫酸(V/V) 為1:4.5時吸光度值最大,而其他濃硫酸用量的吸光度均比葡萄糖標準溶液/濃硫酸(V/V) 為1:4.5時的吸光度小,故合適的待測溶液/濃硫酸(V/V)為1:4.5。
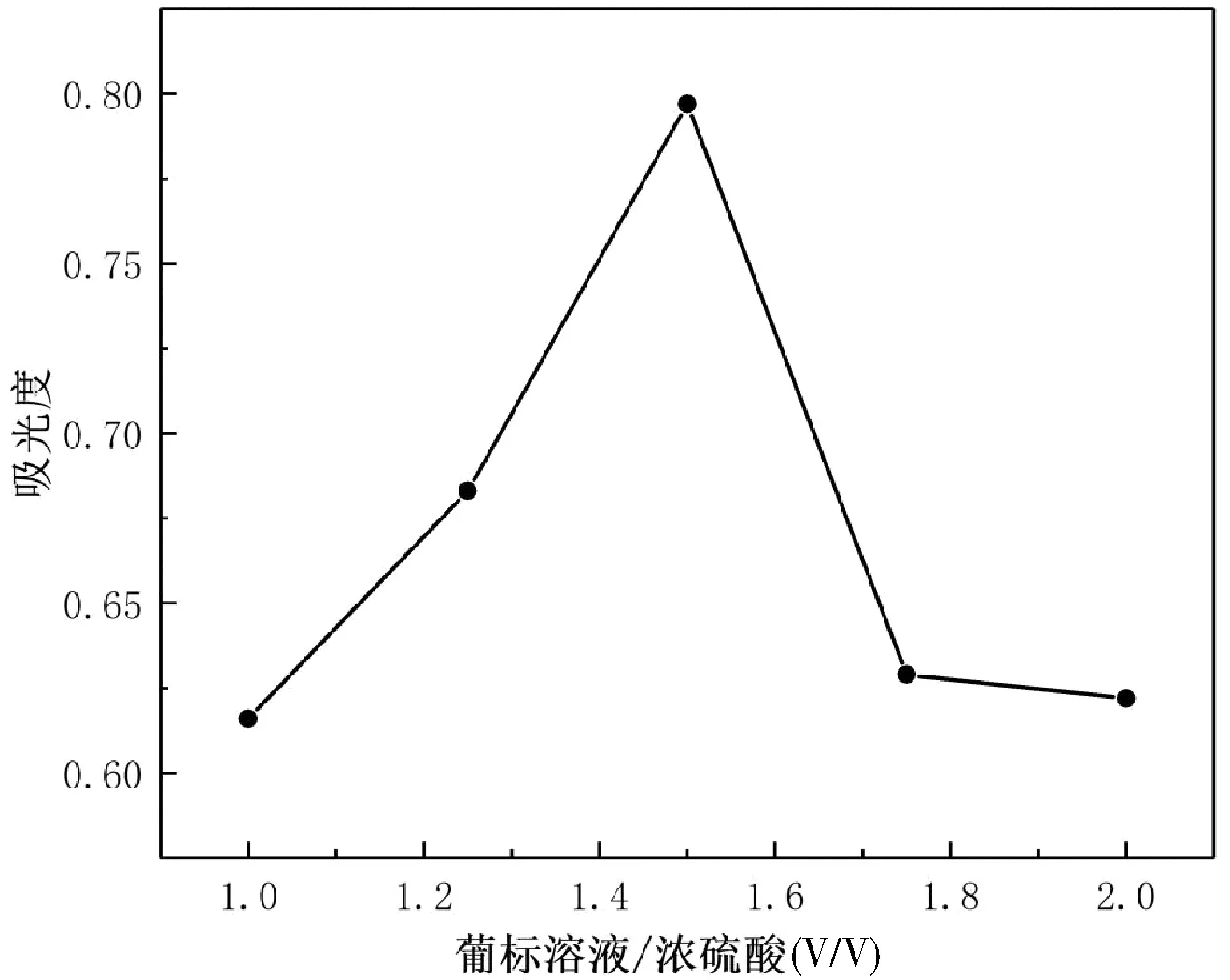
圖5 苯酚-硫酸法中不同濃硫酸量對吸光度的影響
2.3.3 顯色反應時間的影響
由圖6可知,在加熱時間低于30 min時,吸光度略低,可能是顯色反應不夠完全;達到30 min時,吸光度最大,而超過30 min時,隨著時間的增加,吸光度逐漸降低,因此顯色反應時間應選擇30 min左右,故合適的苯酚-硫酸法顯色反應時間為30 min。
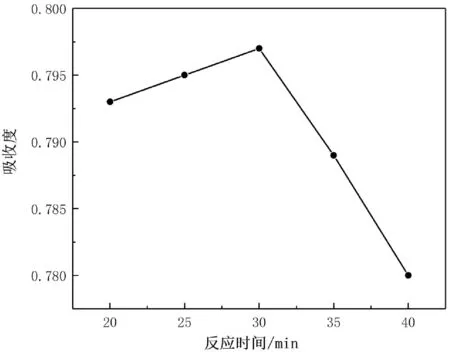
圖6 苯酚-硫酸法中不同反應時間對吸光度的影響
2.4 方法的可行性
上述單因素實驗給出了苯酚-硫酸法能較好地應用于酶標儀檢測多糖。雖然苯酚-硫酸法由于需要配制苯酚溶液和濃硫酸,并需要較長的顯色時間,比報道的蒽酮-硫酸法[14]所需要的時間稍長,但是苯酚-硫酸法顯色所需要的溫度遠低于蒽酮-硫酸法,因此在實際實驗教學過程中,指導教師選擇苯酚-硫酸法方法用于教學實驗內容。
3 新方法的實際檢測應用
在《生物分離工程實驗》課程中,我們應用了新的苯酚-硫酸法檢測靈芝多糖含量,通過與分光光度法對比(對比結果見表1),得出了用酶標儀檢測多糖的優(yōu)點:
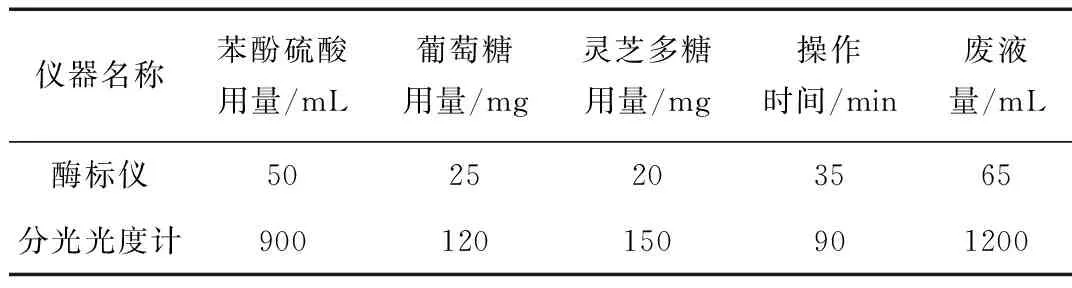
表1 不同儀器苯酚-硫酸法檢測多糖比較
(1)采用酶標儀檢測多糖,在一個教學班次(分組10組)中所用濃硫酸的量由900 mL減少到50 mL,所用靈芝多糖樣品、葡萄糖、苯酚的試劑量也減少了近90%;
(2)檢測時間由每組需要近一個小時,縮短到每個實驗班次35分鐘,減少了近三分之二的實驗教學時間,給其他實驗內容(比如實驗結果分析)提供了較充裕的教學時間;
(3)減少了酸性實驗廢液,使用酶標儀時只產生使用分光光度計時的廢液的5%。
在實驗教學中發(fā)現(xiàn)新檢測方法會提高學生移液槍和多孔板的使用熟練程度,深入了解酶標儀的原理和結構,降低了使用濃硫酸的安全風險。本次教學改革內容是一個將儀器設備由科研使用轉入實驗教學使用的有力示范,對培養(yǎng)學生的創(chuàng)新思維、創(chuàng)新意識,強化學生多渠道解決實際問題的能力將發(fā)揮重要作用,有助于實現(xiàn)“新工科”人才的培養(yǎng)目標[15]。

