高鹽暴露對高脂飲食母代敏化雄性子代血壓的影響
修天元 彭偉
高血壓作為全球罹患人數第一的心腦血管疾病,人們對其認識已逐漸深入到基因層面。在同樣的生活條件下,何種群體更易被誘發高血壓、其誘發機制又如何,已成為高血壓一級預防里最為重要的研究方向。1990年提出了“發育源性的成人健康和疾病”假說,之后大量的實驗證明,母代的肥胖狀態激活了子代原本被弱化的生存基因,使后代更傾向于表現出節約能量、升高血壓[1]。血壓中樞敏化指由于在母體受到不良因素的影響,導致子代的中樞系統發生一系列神經重塑,使其在成年后暴露于不良因素時更易發生高血壓[2]。本系列研究已證明高脂飲食飼養下的母代可上調子代中樞下丘腦內和升壓相關核團的敏感性,無論是正常飲食飼養還是繼續給予高脂飲食,子代成年后在升壓藥物的急、慢性刺激下,較正常飲食母親的正常飲食后代,均表現出更明顯的血壓升高狀態[3]。本實驗將繼續探尋高脂飲食母代的雄性子代,在成年后給予不同的危險因素(如高鹽飲食)暴露,對比正常飲食的后代血壓變化情況。
1 材料與方法
1.1 實驗動物 8周齡SPF級SD(Sprague-Dawley)大鼠,雌性20只,體重(160±10)g,雄性10只,體重(180±10) g,均購自北京華阜康生物科技股份有限公司,動物合格證書SCXK-(京)2019-0008,繁殖使用,購進后全部使用正常飼料適應性喂養1周。實驗涉及飼料均購自北京華阜康生物科技股份有限公司,合格證書SCXK-(京)2014-0008。6周齡SD大鼠(雌性20只,雄性10只)購入后全部正常飼料適應性喂養1周,將雌鼠隨機分為2組,每組10只,合籠前分別予正常飲食和高脂飲食喂養2周后,雄∶雌采取1∶2循環交配法合籠,正常飲食組(C)孕前4周、孕期和哺乳期均正常飲食,高脂飲食組(H)孕前4周、孕期和哺乳期均高脂飲食。所有子代出生后,將正常飲食組母代(C)的雄性子代隨機分為正常飲食組(C/MC)和高鹽飲食組(C/MH),將高脂飲食組母代(H)的雄性子代同樣隨機分為正常飲食組(H/MC)和高鹽飲食組(H/MH),保證4組雄性子代每組≥24只。為了消除哺乳期間每窩幼鼠數量不同導致母鼠喂養帶來的體重差異,每窩數量控制在9只左右,所有雌性子代和多余雄性子代均去除。
1.2 藥品與試劑
1.2.1 主要試劑:血管緊張素Ⅱ(AngⅡ),批號:ALX-160-042-M349,購自蘇州信達生物科技有限公司;異氟烷,批號:P8410-45,購自德國默克;肝素鈉,批號:F20171203,購自天津福晨化學試劑有限公司;地佐辛注射液,批號:H5330205,購石家莊制藥有限公司;Trizol Reagent,購自美國 Invitrogen 公司;實時熒光定量所需引物,由賽默飛(中國)有限公司合成;PrimeScript TM RT Master Mix,購自日本 TaKaRa 公司;SYBR?Premix Ex Taq TM Ⅱ,購自中國 TaKaRa 公司;RNeasy? Mini Kit,購自美國 Qiagen公司。
1.2.2 主要儀器:HD-S10動物生理信號無線遙測系統,購自于美國DSI公司;Version Gold 4.0 Dataquest ART ?數據分析系統,提供于美國DSI公司; Chart version 7.2Powerlab 四通道生物機能實驗系統,購于美國instrumen公司;M-CENTRIFUGE 小型離心機,美國 AndyBio公司;LE225D 型電子天平(1/100 000),購于德國賽多利斯股份公司;Mini-osmotic Pump 滲透泵,美國 DURECK 公司;77019 雙目萬向支架體視顯微鏡和68001R 腦立體定位儀,均購于深圳瑞沃德生命科技有限公司;1864干燥滅菌器,美國 Cell Point Scientific公司;ABI7300 實時熒光定量 PCR 儀,美國應用生物系統公司;RT-2100C 酶標儀,上海創奕科技設備有限公司;顯微手術器械(包括 Vannas 剪(500086)、Dumont鑷),購于美國 WPI;聚氨酯管 PE10、PE50,不銹鋼套管,購于美國 Braintree 公司。
1.3 實驗方法
1.3.1 功能試驗:4組雄性后代10周齡時進行2個相互獨立的功能試驗,分別記錄子代在不同方式刺激下全身壓力反射應答,檢測高脂飲食母代是否會使子代暴露在高鹽環境下更易出現血壓和心率變化。
1.3.1.1 植入腦室套管及急性微量注入AngⅡ的效應:10周齡雄性子代異氟烷吸入麻醉后,使用2%戊巴比妥鈉(50 mg/kg)腹腔注射麻醉,將PE50導管前端適度拉伸后,植入股動脈,深入長度3~5 cm,插入腹主動脈、腎動脈水平,將導管結扎后,腹內至頸后皮下做隧道,將導管引出至頸后妥善固定,使用肝素鹽水封管。同時,使用小動物腦室套管,于右側腦室置管,坐標為前囟門向右1.5 mm,向后1.0 mm,向下4.5 mm深度,術后至少恢復24 h,建立清醒動物模型。第1天從側腦室套管微量注射2 μl 0.9%氯化鈉溶液,記錄心率、血壓變化,1 h后予AngⅡ 200 ng經微量注射器行變化側腦室注射,同樣記錄壓力反射變化,次日倒序進行。為排除側腦室插管位置異常導致的統計誤差,所有試驗用鼠最終給藥結束后,均經側腦室置管注入美蘭染劑,解剖確定置管所在腦室位置正確后,再將該試驗數據納入最終數據分析,經后期統計該插管準確率≥95%。
1.3.1.2 股動脈安裝植入子和外周慢性灌注AngⅡ實驗:8周齡雄性子代異氟烷吸入麻醉后,2%戊巴比妥鈉腹腔注射麻醉,通過股動脈安裝植入子(DSI),手術后恢復7 d,開始記錄基礎血壓5 d。根據大鼠體重,配制可緩釋2周的AngⅡ(130 ng·kg-1·min-1)裝入滲透泵(2002,Alzet),植入前1 d將裝滿藥物的滲透泵浸入0.9%氯化鈉溶液中孵育過夜,以保證滲透泵工作時釋放藥物狀態穩定。次日動物在麻醉狀態下,于頸后兩肩胛中間前方皮膚做縱行切口將滲透泵植入,灌流AngⅡ 14 d,期間股動脈探針24 h持續采樣,設置采樣頻率為1 000 Hz,每隔1 h采樣1次,每次從整點開始記錄,每次采樣5 min。
1.3.2 壓力感受器反射性檢測:急性股靜脈泵入苯腎上腺素/硝普鈉實驗:10周齡雄性子代異氟烷吸入麻醉后,使用2%戊巴比妥鈉(50 mg/kg)腹腔注射麻醉,將PE50導管前端適度拉伸后,分別植入股動脈和股靜脈,深入長度3~5 cm,插入腹主動脈、腎動脈水平,將導管結扎后,腹內至頸后皮下做隧道,將導管引出至頸后生物膠固定,使用肝素鹽水封管、定時沖管,避免堵塞。皮下注射慶大霉素抗感染和地佐辛止痛,術后動物至少恢復24 h,建立清醒動脈模型,待動物能夠自由活動后,股靜脈用于給藥,股動脈用于連接小動物生命信號采集系統記錄給藥后生命體征變化。第1天記錄5 min基礎生命體征后,1 mg/ml苯腎上腺素3 μl/min速度泵入5 min,2 h后給予2 mg/ml濃度硝普鈉3 μl/min 泵入,同樣記錄5 min,次日倒序進行。
1.4 觀察指標 (1)母代繁殖能力、子代體重增加差異;(2)子代急性側腦室給藥導致的全身壓力應答反應;(3)記錄血壓波形進行血壓變化、心率變異等方面的分析,確定子代雄鼠對慢性灌流AngⅡ誘發高血壓的反應性;(4)外周給予腎上腺素/硝普鈉后不同子代血壓和心率變化的相關性。

2 結果
2.1 母代繁殖能力 正常飲食組與高脂飲食組母代繁殖能力比較差異無統計學意義(P>0.05)。見表1。
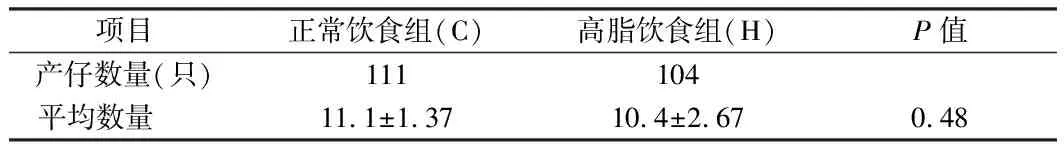
表1 母代繁殖能力 n=20
2.2 子代體重觀察 不同飲食母代的幼鼠出生體重間差異無統計學意義(P>0.05),出生后1周開始高脂飲食母代的后代體重比正常飲食組增長快,差異有統計學意義(P<0.05),該現象持續到離乳后第1周,后子代體重增長程度無差異,直至成年前2周,高脂飲食組子代再次出現較快的體重增長,差異有統計學意義(P>0.05)。見表2。
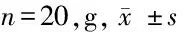
表2 子代體重觀察
2.3 急性側腦室注射AngⅡ對MAP和HR的影響 腦室給藥后正常飲食母代比較高脂飲食母代的后代MAP差異有統計學意義(P<0.01)。各組MAP均有明顯上升,H/MH組側腦室注射AngⅡ后誘發的升壓效應巨大(n=6,P<0.05),該組比較其他3組血壓變化差異有統計學意義(P<0.01),但4組后代間血壓變化差異無統計學意義(P>0.05);對于側腦室給予AngⅡ后心率均有所下降,高脂飲食母代的后代對比正常飲食母代組后代的心率變異率差異有統計學意義(P<0.05),4組后代間心率變化差異有統計學意義(P<0.05),其中H/MH組心率變異率最大(P<0.05)。見表3、4。
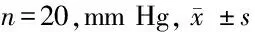
表3 急性側腦室注射AngⅡ后正常飲食和高脂飲食母代的后代△MAP變化

表4 急性側腦室注射AngⅡ后△HR變化 n=20,次
2.4 慢性灌注AngⅡ對血壓的影響 10周齡時高脂飲食母代的雄性子代(n=12)基礎血壓為(118.57±4.75) mm Hg,基礎心率為(349.08±3.37)次/min,較正常飲食母代的雄性子代(n=12)的基礎血壓(119.93±6.29) mm Hg和基礎心率(349.81±3.99)次/min均有輕微升高,但差異無統計學意義(P>0.05)。在慢性滲透泵給藥AngⅡ后,與對照組子代比較,差異有統計學意義(P<0.05),妊娠期、哺乳期高脂飲食母代的后代均表現出顯著增強的血壓升高反應(P<0.05),2組差異有統計學意義(P<0.01)。在AngⅡ開始緩慢釋放后,各組子代MAP均有上升,HR均有下降,差異有統計學意義(P<0.01),其中H/MH組緩慢給藥AngⅡ后誘發的升壓效應巨大(P<0.05),心率下降幅度同樣巨大,該組比較其他3組血壓變化(P<0.01)。見表5~7。

表5 正常飲食組和高脂飲食組雄性子代10周齡基礎血壓/心率比較

表6 慢性灌流AngⅡ后正常飲食和高脂飲食母代的后代△MAP/△HR變化
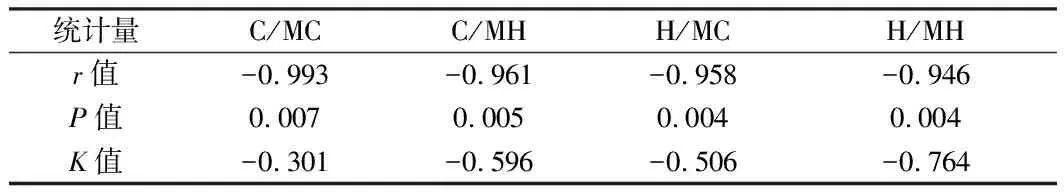
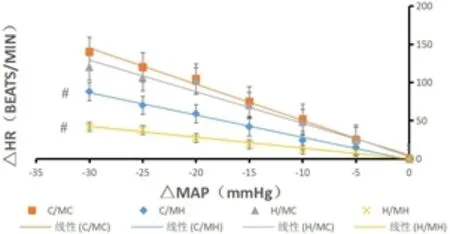
2.5 壓力反射功能的影響 采用藥理學方法研究心臟壓力反射功能,通過苯腎上腺素或輸注硝普鈉期間血壓與心率變化相關的回歸線斜率來確定的。輸注苯腎上腺素(PE)和硝普鈉(SNP)后,無論子代是否高鹽飲食,高脂飲食母代的后代組血壓和心率的變化斜率均小于正常飲食母代組的正常飲食子代(H/MH 表7 4組雄性子代慢性灌流AngⅡ后△MAP和△HR的變化 表8 股靜脈注射PE后△MAP和△HR的相關性分析 圖1 股靜脈注射PE后△MAP和△HR的相關性 表9 股靜脈注射SNP后△MAP和△HR的相關性分析 圖2 股靜脈注射SNP后△MAP和△HR的相關性 本研究中正常飲食母代和高脂飲食母代的子代在出生時體重并無明顯差異,但1周后高脂飲食組子代體重明顯增加,這種增勢一直延續至8周齡成年,鄭佳等[4]發現高脂飲食母代的后代出生體重較低,但3周后體重將明顯高于正常飲食組子代,這種現象被稱為“追趕型生長”,是一種補償性生長,也是后代成年后體脂更易增多、炎性因子更易釋放的基因基礎[5]。大量證據表明追趕型生長在子代成年后顯著增加胰島素抵抗、2型糖尿病和心血管疾病的易感性[6]。由于體重受各種干擾因素較多,將其作為代謝指標的評估過于簡單,建議使用腹部脂肪含量(腹型肥胖者更有意義)和血液內瘦素水平進行比較。有研究證實了該論點,同大多數該類實驗相同,高脂飲食母代的子代體質量較正常飲食組母代的后代,差異并無統計學意義(P>0.05),但前者子代存在較典型高瘦素血癥,且隨著年齡增長持續升高,同時腹部脂肪含量(大網膜脂肪層克數)也明顯高于對照組[7-9]。 脂肪細胞可分泌多種激素和炎性因子[10],AngⅡ是RAS的主要活性成分,脂肪組織可不受循環中RAS活動的影響而單獨合成AngⅡ[11,12],該因子是導致肥胖高血壓的重要因素,研究表明孕期和/或哺乳期高脂飲食促使脂肪組織合成大量AGT,激活RAS系統,編程子代血壓中樞[13],從而導致子代更易發生高血壓。 孕期和哺乳期高脂飲食可敏化雄性子代的高血壓相關核團,該系列實驗已證實8周齡子代中,高脂飲食母代組的雄性后代較正常飲食對照組腦中RAS系統相關受體、炎性因子活性表達均明顯增加,說明高脂飲食組子代在血壓升高之前這些基因表達已經上調,該種效應為成年后高血壓的發生起到易化作用[14]。前期研究也發現給予母代高脂飲食實現子代血壓中樞對AngⅡ的敏感化效應,與其子代PVN和LT中RAS成分的mRNA表達增加有關[7]。 SFO 是 LT 的一個室周器官,缺乏血腦屏障,是中樞神經系統結構中直接感知循環各種信號分子的界面,它與 PVN 間的信號聯系是 AngⅡ誘導的交感輸出增加型高血壓形成的重要路徑[15]。PVN 是下丘腦的一個關鍵核團,分為大細胞區和小細胞區,小細胞區功能為接受來自SFO 關于循環肽的關鍵信息,例如循環中AngⅡ增加,SFO 神經元的刺激會增加,隨后 PVN 神經元發出纖維直接投射到腦干和脊髓調節交感活動[16]。PVN 中已活化的星形膠質細胞可以感知血壓升高和高能量攝入等不良刺激,并作出應答,影響交感輸出,最終導致神經源性高血壓的產生。而星形膠質和小膠質細胞激活后還可導致PVN 中 RAS 成分的mRNA 表達增加,從而引起血壓波動和能量代謝失衡[17]。SFO 含有大量的 ACE 和AT1R,均為中樞神經RAS 系統的重要成分,SFO 神經元激活,引起交感神經激活,是心力衰竭和血壓升高的生理基礎[18]。結合前期研究,可顯示高脂飲食導致子代 PVN 中膠質細胞活化,通過相應機制易化神經源性高血壓。 本實驗急性側腦室給藥作用于下丘腦鹽感受器、滲透壓感受器和數個參與血壓調控的核團,如SFO、PVN和OVLT[19],注射1 min后,各組子代血壓均開始升高,5~10 min左右H/MC和H/MH組引起的變化幅度最大,這個結果與既往研究相符合,說明高脂飲食子代表現出對中樞應激刺激的高反應性[20]。 結合前期試驗已證明,高脂飲食的雄性子代,在成年前,中樞神經核團血壓調控功能已出現改變,并且這些改變易化了成年暴露于高危因素下發生高血壓的傾向,因此可明確SFO成分表達是高血壓形成的基因層面的主要機制。本研究可進一步完善原發性高血壓的發病機制,為后續治療手段提供更多的介入點,對于防治兩代健康均有積極意義。


3 討論

