經典Wnt信號通路中β-catenin在細胞核內外分布的調控機制及潛在治療靶點的研究進展
顧嘉偉 牛耿明 柯重偉
(復旦大學附屬上海市第五人民醫院普外科 上海 200240)
經典Wnt信號通路在胚胎發育、正常干細胞以及腫瘤細胞的增殖分化中發揮重要作用。當Wnt信號通路處于非激活狀態時,胞質內游離的β-連環蛋白(β-catenin)會在胞內降解復合體的作用下持續降解,使其胞內數量處于較低水平。該降解復合體由軸抑制蛋白(Axin)、腺瘤性結腸息肉病(adenomatous polyposis coli,APC)蛋白、酪蛋白激酶(casein kinase-1α,CK-1α)以及糖原合成酶激酶(glycogen synthase kinase-3β,GSK-3β)構成,CK-1α和GSK-3β將β-catenin的S33、S37、S45及T 41氨基酸位點磷酸化,使之能夠被β-轉導素重復序列包含蛋 白(β-transducin repeats-containing proteins,β-TrCP)識別并泛素化。泛素化β-catenin最終通過蛋白酶體介導的降解途徑降解。當Wnt信號通路處于激活狀態時,或當降解復合體因基因突變或其他因素導致其結構功能失常時,降解復合體與細胞膜胞內側磷酸化的低密度脂蛋白受體相關蛋白5/6(low-density lipoprotein receptor-related protein,LRP5/6)結合,此時β-catenin不能再被β-TrCP識別及進一步降解,從而在胞內不斷蓄積并最終向細胞核內轉移。進入細胞核內的β-catenin與T細胞因子/淋巴增強因子家族(T-cell factor/lymphoid enhancer factor,TCF/LEF)相關轉錄因子相結合,并在B細胞淋巴瘤因子9(B-cell CLL/lymphoma 9,BCL-9)、環磷酸腺苷反應元件結合蛋白(cyclic AMP response element binding protein,CREB)的結合蛋白(CREB-binding protein,CBP)以及Pygopus蛋白(Pygopus,Pygo)等蛋白的共同作用下,激活下游靶基因(如MYC和CCND 1等)的轉錄,促進細胞的增殖、分化、轉移以及基質金屬蛋白酶的分泌[1]。
該信號通路中的核心蛋白分子β-catenin相對分子質量(Mr)為92 000,由N末端的140個氨基酸殘基、C末端的反式激活結構域以及二者之間的由12個armadillo(arm)重復序列組成的中心結構域組成。中心的arm重復序列介導β-catenin與細胞骨架蛋白(含有IQ模體的三磷酸鳥苷酶激活蛋白1、αcatenin、E-鈣黏蛋白)、轉錄復合體(TCF、LEFs)以及降解復合體(Axin、APC、GSK-3β)相互作用。N末端和C末端結構域尚未完全解析,有研究表明它們帶有的陰性電荷使其能與arm重復序列產生靜電作用,并調節對arm結合蛋白的親和力[2]。正常情況下,β-catenin在細胞內各處的分布處于相對平衡的狀態,當Wnt通路激活時,細胞內β-catenin的分布將發生改變,β-catenin進入細胞核并在核內蓄積,招募RNA聚合酶Ⅱ介導轉錄所需要的中介復合物同時促進組蛋白乙酰轉移酶結合并打開染色體,從而募集更多的轉錄因子聚集到靶基因的啟動子上,最終激活Wnt通路靶基因的轉錄[3]。β-catenin進入細胞核內是其傳遞下游信號及激活Wnt靶基因轉錄的重要前提,但其出入細胞核的方式尚未完全解析,細胞膜上、細胞質內、細胞核內的某些分子也會影響其在細胞內的定位。β-catenin在細胞核內外的分布狀態是經典Wnt信號通路重要的調控位點以及該通路相關疾病的潛在治療靶點(圖1)。
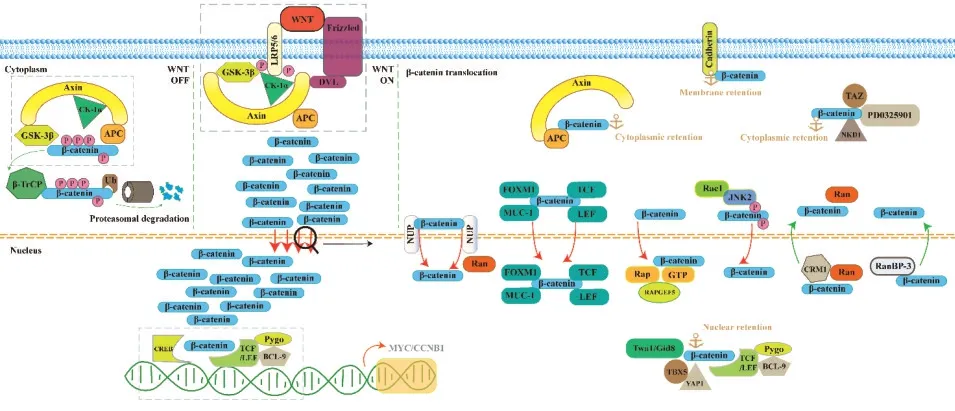
圖1 經典Wnt信號通路及β-catenin在細胞核內外分布的調控機制示意圖Fig1 Illustration for canonical Wnt signaling pathway and regulating mechanism of cellular sub-localization ofβ-catenin
β-catenin入核方式
利用經典入核途徑關鍵蛋白直接入核 正常情況下,Mr<30 000的蛋白能夠通過細胞核上的核孔通道直接穿梭于核內外,而Mr>50 000的蛋白需要通過核孔通道復合體(nuclear pore complex,NPC)主動轉運進入核內。NPC由30~50個不同的核孔蛋白(nucleoporin,Nup)組成,而通過NPC主動轉運的蛋白基本結構中都含有核定位或核外輸信號(nuclear localization or nuclear export signal,NLS/NES)。含有NLS序列的蛋白進入細胞核內通常是通過經典入核途徑(也被稱作依賴Ran和輸入蛋白的入核途徑)完成的:在胞質一側,由輸入蛋白α(importin-α)和輸入蛋白β(importin-β)組成的NLS序列受體與含有NLS序列的蛋白結合,組成一個輸入復合體;輸入蛋白α和β通過結合Nup,促使輸入復合體移動并穿過NPC;在細胞核內側,小分子GTP酶Ran與輸入蛋白β結合并提供能量,導致輸入復合體解離,核外的蛋白最終進入核內,而輸入蛋白則重新回到胞質中開始新的轉運[4]。
雖然β-catenin缺少NLS/NES序列,但許多研究表明β-catenin的入核仍然利用了上述經典入核途徑中一些重要分子,以一種類似輸入蛋白β卻無輸入蛋白α/β復合體參與的方式入核。β-catenin的中央arm結構域與輸入蛋白β中心結構域的串聯重復序列(HEAT模體)在結構上相似,這些螺旋形的重復序列使得蛋白更易被輸入輸出蛋白及核孔蛋白的FG重復序列結合,進而協助蛋白穿過NPC[4]。而作為NPC胞質的主要組成部分,Nup358能夠為蛋白入核募集并接收輸入蛋白β,當其表達被抑制時,β-catenin的 入 核 速 率 相 應 減慢[5-6]。因 此,βcatenin可能通過一系列與多個核孔蛋白瞬時且連續的相互作用進入細胞核內,而這一入核過程同樣需要依靠Ran提供能量[7]。但是也有研究發現,在非洲爪蟾卵胞質中可溶性β-catenin不能直接和核孔蛋白相互作用,這可能是因為蛋白在膜上的直接交互作用易受各種因素調控所致。β-catenin和NPC潛在的直接交互作用還需要進一步研究。
“分子伴侶”入核 由于β-catenin缺乏NLS序列,因此含有NLS序列的蛋白可以作為“分子伴侶”協助其入核。目前發現過表達叉頭框蛋白M 1(forkhead box protein M 1,FOXM 1)、黏 蛋 白1(mucin1,MUC-1)、胰 島 素 受 體 底 物1(insulin receptor sustrate1,IRS-1)、Smad蛋白3/4(Smad3/4)、BCL-9、雄激素受體(androgen receptor,AR)及含有硫氧還原蛋白結構域蛋白12(thioredoxin domain-containing protein 12,TXNDC12)等,都 會促進β-catenin向核內轉運[8-9]。Wnt通路下游的TCF/LEF轉錄因子被發現能夠作為β-catenin核內轉運的“分子伴侶”,然而目前尚不能確定此種轉運入核是依靠自身還是與其結合的蛋白,因此“βcatenin入核分子伴侶”這一說法的嚴謹性有待商榷[2,10]。
其他入核途徑 除了上述的“直接入核”及“分子伴侶”協助入核途徑以外,近年來還發現位于細胞核內的Rap鳥嘌呤核苷酸交換因子5(Rap guanine nucleotide exchange factor 5,RAPGEF5)能夠維持細胞核內Rap蛋白與GTP結合的激活狀態,激活狀態的Rap能夠和β-catenin直接結合,激活的Rap1a和Rap1b能夠促進β-catenin向核內轉運并具有將β-catenin滯留在核內的作用。這被認為是一種新的、不同于常規的依賴Ran和輸入蛋白β進入細胞核的新途徑[11]。還有研究發現,小分子GTP酶Rho家族成員Ras相關的C3肉毒素底物1(Rasrelated C3 botulinum toxin substrate 1,Rac1),在細胞質內激活c-Jun氨基末端激酶2(c-Jun N-terminal kinase 2,JNK2),激活的JNK2對β-catenin的S191和S605位點磷酸化,進而促進其進入細胞核[12]。驅動蛋白2(kinesin-2)和細胞纖毛內轉運蛋白A(intraflagellar transport-A,IFT-A)組成的復合體也被發現在β-catenin進入細胞核的過程中發揮必要作用[13]。β-catenin轉錄后的糖基化修飾也能夠促進其向核內轉運[14]。上述多種促β-catenin入核的具體機制以及是否存在相應的抑制劑有待進一步研究。
β-catenin出核方式β-catenin出核的過程同樣存在多種機制。與其入核過程類似,由于β-catenin缺少典型的NES序列,其出核過程需要在含有NES序列的分子蛋白協助下完成。此時需要染色體維持 區 域1(chromosome maintenance region 1,CRM 1)(也稱作輸出蛋白1)的參與,該區域與具有富含亮氨酸的NES序列的蛋白質相結合,以一種消耗能量的方式將蛋白通過核孔轉運出核[15]。在這個過程中,Ran負責將待轉運的蛋白結合到CRM 1受體上,并在穿核的過程中保持與復合體的結合,隨后在胞質內解離并回到核內參與新一輪轉運。目前已發現Axin、APC、Chibby、多發性內分泌癌蛋白(menin)、p21活化激酶4(p21-activated kinase 4,PAK4)、KN模體和錨蛋白重復結構域1(KN motif and ankyrin repeat domains 1,Kank1)以及亮氨酸拉鏈腫瘤抑制因子2(leucine zipper tumor suppressor 2,LZTS2)等蛋白的表達上調會導致β-catenin以這種依賴CRM 1和Ran的轉運方式從細胞核向細胞質內轉運,其中一些蛋白正是Wnt信號通路的負性調節因子[8]。這種依賴CRM 1的出核方式可以被細霉素B(leptomycin,LMB)阻斷,并且引起β-catenin在細胞內含量升高[16]。
β-catenin也可以通過不依賴CRM 1和Ran的途徑出核。此種非典型的出核方式依靠β-catenin蛋白N末端和C末端的序列完成,而這些序列與典型的NES序列或核外輸相關蛋白相比無相似性,因此可能存在特定的尚未解析的作用機制[17]。此外,Ran結合蛋白3(Ran binding protein 3,RanBP-3)也可以通過不依賴CRM 1和Ran的方式將β-catenin從核內轉移至胞內,其轉運機制可能類似于β-catenin直接核內轉運,即β-catenin自身直接與核膜相關分子相互作用完成轉運[18]。
細胞核內外滯留作用
細胞膜滯留 在細胞膜上,鈣黏蛋白與βcatenin相結合,在參與構成細胞間連接的同時,將β-catenin滯留于細胞膜上。如血管內皮鈣黏蛋白(vascular-endothelial-cadherin,VE-cadherin)和βcatenin結合并促進內皮細胞連接的穩定,這種作用可被弓形蟲破壞,并影響β-catenin在細胞內的定位[19]。N-鈣黏蛋白能夠和β-catenin結合,N-鈣黏蛋白表達上調會顯著增加核內外β-catenin及其與βcatenin復合體的數量[20];而當N-鈣黏蛋白被蛋白酶水解之后,水解下來的胞質內C末端片段與βcatenin結合形成復合體,該復合體可以進入細胞核內,使β-catenin激活相關靶基因轉錄[21]。E-鈣黏蛋白在細胞膜上與β-catenin結合并參與組成細胞間黏附復合體,通過滯留作用負性調節細胞核內βcatenin含量。在某些細菌感染或腫瘤患者體內,βcatenin受到細菌毒素的作用或在腫瘤微環境中發生酪氨酸磷酸化,從黏附復合體中解離,這不僅破壞了上皮組織的完整性,促進了上皮間質轉化的發生(epithelial-mesenchymal transition,EMT),還使更多游離的β-catenin進入細胞核內,異常激活Wnt通路下游靶基因的轉錄[22]。例如,脆弱擬桿菌毒素(Bacteroides fragilis toxin,BFT),作為一種不耐熱的金屬蛋白酶,可作用于E-鈣黏蛋白的細胞外結構并干擾上皮細胞之間的連接,促使β-catenin與E-鈣黏蛋白解離,解離的β-catenin在降解復合體功能受到抑制的情況下進入細胞核內激活下游轉錄[23]。此外,副豬嗜血桿菌(Haemophilus parasuis)能夠削弱E-鈣黏蛋白與β-catenin之間的作用[24];綠膿桿菌凝集素B(Lectin B,LecB)能夠破環β-catenin在細胞膜上與α1β3整合素的結合[25]。除此之外,有研究發現β-catenin在多種類型乳腺癌患者的癌組織中表達量升高,并且細胞內β-catenin含量升高與更高的腫瘤分期及更差的預后結局相關[26-27]。乳腺癌細胞內β-catenin含量增高主要來自于細胞膜上的解離,這在晚期以及高侵襲性乳腺癌細胞中更為常見[28]。在三陰性乳腺癌細胞中,人PDZ和LIM結構域蛋白1(PDZ and LIM domain protein 1,PDLIM 1)在胞質內的蓄積能夠增加核內具有活性的βcatenin,這正是通過促進β-catenin從細胞膜上解離,并將其在S675位點磷酸化,最終促進其入核蓄積而實現的[29]。
細胞質內滯留 在細胞質內,一些分子通過與β-catenin結合將其滯留于胞內。在對外胚層胚胎干細胞分化過程的研究中發現,細胞外信號調節蛋白激 酶(extracellular signal-regulated protein kinase,ERK)信號通路的小分子抑制劑PD0325901能夠促進β-catenin在胞質內滯留,增加胞質內β-catenin含量而減少其核內含量,同時上調E-鈣黏蛋白表達[30]。同樣,在胚胎干細胞胞質內,具有PDZ結合模體的轉錄共激活因子(transcriptional co-activator with PDZ-binding motif,TAZ)能夠與β-catenin相結合并促進干細胞自我更新。此過程不需要β-catenin進入細胞核內發揮轉錄激活作用,但需要二者在胞質內結合,同樣提示一定的胞質內滯留作用[31]。Wnt通路下游產物裸角質膜同源蛋白1(naked cuticle homolog 1,NKD1)能通過與β-catenin結合抑制其進入核內,提示其介導了一種通路負反饋調節機制以及對β-catenin的胞內滯留作用[32]。
β-catenin胞內降解復合體的主要組成成分Axin及APC也有滯留作用,內源性Axin和APC都能和核內TCF/LEF競爭性結合β-catenin,增加其出核及在胞質內的相對含量[33-34]。細胞內Axin含量受E3泛素連接酶RNF146(ring finger protein 146)調控,它可以將Axin泛素化并進一步被蛋白酶體降解[35];而RNF146又受到端粒酶的別構激活[36]。因此,端粒酶抑制劑(如端粒酶抑制劑XAV 939)能夠穩定Axin的表達,使其胞內濃度上升。此外,一種多酚類類黃酮天然化合物漆黃素(fisetin)也能夠增加內源性Axin表達[37]。Axin含量增加不僅能夠增加其細胞質內滯留β-catenin的作用,同時還會增加以其為主體的降解復合體的形成,從而使得βcatenin降解增多。多種端粒酶抑制劑正是通過這種增加Axin降解復合體的降解作用來抑制通路,而單純通過增加Axin核內滯留作用抑制β-catenin的入核及下游信號傳遞并不多見[38]。在慢性粒細胞白血病細胞中,BCR-ABL融合蛋白能使β-catenin的Y 86和Y 654位點酪氨酸磷酸化,與胞質內的Axin結合相比,β-catenin更易與核內的TCF4結合,從而減弱了Axin對β-catenin的滯留作用,增加了其入核及激活下游轉錄作用[39]。其他酪氨酸激酶,如FMS樣的酪氨酸激酶3(Fms-like tyrosine kinase,FLT 3)和KIT在造血細胞中也有類似作用[40-41]。
細胞核內滯留 在細胞核內,β-catenin通過與TCF/L、BCL-9、Pygo以及CBP等轉錄因子相作用激活下游靶基因的轉錄[42]。其中BCL-9以及Pygo不僅能夠與β-catenin結合,還具有將其留在細胞核內的作用,這種滯留作用進一步交由TCF4實現并限制其在核內的移動[33]。當BCL-9表達被抑制時,β-catenin滯留在核內的作用被削弱,而更易與E-鈣黏蛋白結合并滯留在細胞膜表面[43]。LEF1在Wnt信號的刺激下可直接和APC及E-鈣黏蛋白競爭結合β-catenin的arm重復結構域,減少β-catenin出核而增加其入核。當Wnt通路激活時,β-catenin在細胞質內含量增加,并進入細胞核內,在染色體區域與LEF1結合,并反式激活Wnt通路相關基因的表達,其中就包括LEF1,而LEF1的增加進一步使βcatenin在核內穩定積聚,使LEF1的表達及募集βcatenin入核的過程成為正反饋循環[44-45]。Wnt通路的下游靶基因MYC能夠與LEF1啟動子區域直接結合并且促進其轉錄,進一步增加β-catenin在核內聚集[16]。此外,β-catenin還能在多種腫瘤細胞中與Twa1/Gid8、Yes相關蛋白1(Yes-associated protein 1,YAP1)及T-box轉錄因子5(T-box transcription factor,TBX5)等蛋白在核內結合形成復合物,提示這些蛋白對β-catenin有一定的核內滯留作用[46-47]。在成骨細胞中,肽基脯氨酸順反異構酶1(peptidyl
prolyl cis-trans isomerase NIMA-interacting 1,Pin1)能夠在細胞核內直接和β-catenin結合并將其異構化,異構化后的β-catenin在核內不能與能夠驅使其出核的APC結合,最終β-catenin滯留于核內[48]。在結直腸癌患者中,β-catenin在細胞核內的含量顯著升高,并且核內β-catenin含量增高與患者較差的預后結局密切相關[49]。在化學藥物誘導的肝母細胞瘤小鼠模型中,也發現β-catenin在細胞核內含量顯著增高[50]。而在宮頸鱗狀細胞癌患者中,β-catenin在細胞核內的含量增高,不僅與患者不良預后相關,還與患者放化療耐藥密切相關[51]。
β-catenin細胞內亞定位相關治療靶點
通過β-catenin出入細胞核途徑減少核內含量對于β-catenin直接入核途經,目前已發現兩種多肽抑制劑(Bimax-1和Bimax-2)能夠和輸入蛋白β結合并抑制其在細胞核內側釋放待轉運的蛋白[52]。有研究鑒定出一種輸入蛋白β的小分子擬肽類抑制劑58H 5-6,結構類似于核孔蛋白的FG序列,能夠和NPC競爭結合輸入蛋白β;而同時β-catenin的arm重復序列和輸入蛋白β的HEAT模體結構相似,因此58H 5-6可以進一步影響β-catenin入核[53]。此外,還發現入核受體抑制劑(importazole,IPZ)干擾輸入蛋白β和Ran的結合[54-55];多克隆抗體Mab414(抗-Nup107抗體)和RL 2(抗-O-linked N-acetylglucosamine抗體)直接和核孔蛋白的FG序列結合,從而阻斷核孔蛋白介導的轉運;麥胚凝集素(wheat germ agglutinin,WGA)通過糖修飾的核孔蛋白直接與NPC結合并阻斷通道中心[56]。然而,上述物質抑制蛋白入核的作用缺乏特異性,針對某些特定的核孔蛋白阻斷β-catenin入核是更有價值的研究方向。對于前文提到的協助β-catenin進入細胞核內的各類“分子伴侶”、通過不依賴CRM 1和Ran的方式協助β-catenin出核的RanBP-3以及其他β-catenin出入核途徑關鍵蛋白等,雖然目前相關臨床研究較少,但將它們作為潛在的治療靶點有很好的應用前景,值得深入研究。
增加β-catenin的核外滯留并減少核內滯留 如前所述,E-鈣黏蛋白通過與β-catenin結合將其滯留在細胞膜上,已有研究發現活化的維生素D(即1,25-二羥維生素D3)能夠促進β-catenin與維生素D受體結合,同時增加E-鈣黏蛋白的表達,增加βcatenin在細胞膜上的滯留,細胞核內能夠與TCF/LEF轉錄因子結合的β-catenin含量減少[57]。有研究證實,結直腸癌患者體內血漿1,25-二羥維生素D3含量升高提示更低的患病風險以及更好的預后結果[58-59];而在進展期結直腸癌患者中,尤其是黑人和女性患者中,維生素D缺陷的存在更為普遍[60]。目前,一項隨機、多中心、雙盲、臨床三期試驗正在研究比較維生素D3結合XELOX/mFOLFOX化療方案與單獨XELOX/mFOLFOX方案,作為未接受過治療的進展期或已發生轉移的結直腸癌患者的一線化療方案誰更為有效,該項研究對于提高晚期結直腸癌患者治療療效有重要意義[61]。
某些天然化合物對于β-catenin的核內滯留作用有抑制效果。低濃度白藜蘆醇(resveratrol)在結腸細胞中能夠顯著減少β-catenin在細胞核內的含量,同時降低細胞核內兩個重要的β-catenin滯留因子 legless(lgs)和 pygo的 表 達[62]。姜 黃 素(curcumin)能夠顯著降低細胞核內β-catenin含量,而對胞質內的含量不產生明顯影響。這些天然化合物可能具有通過減少β-catenin核內滯留作用而抑制其介導的信號傳遞作用[63-64]。
一些酪氨酸或蘇氨酸激酶對β-catenin特定位點的磷酸化對其在細胞核內外的滯留狀態的改變有重要的調節作用。在細胞膜上,表皮生長因子(epidermal growth factor receptor,EGFR)對βcatenin的Y 654位點的磷酸化能夠抑制E-鈣黏蛋白與β-catenin之間的結合,使β-catenin更易與核內轉錄因子CBP、TCF4等結合。與此類似,β-catenin在細胞膜附近通過Y 142位點與α-catenin結合,當Y142位點被酪氨酸激酶Met(tyrosine-protein kinase Met,c-Met)磷酸化時,β-catenin與α-catenin之間的結合減弱,轉而更易與核內轉錄因子BCL-9結合[65]。在細胞質內無Wnt信號刺激時,β-catenin被CK-1α及GSK-3β磷酸化是其被β-TrCP及蛋白酶體降解的前提;當胞內CK-1α及GSK-3β磷酸化作用受到抑制時,β-catenin在胞內不能正常降解,進一步導致其在胞內蓄積以及向核內轉運。在細胞核內,蛋白激酶A(protein kinase A,PKA)和蛋白激酶B(protein kinase B,PKB)能 夠 將β-catenin的S552和S675位點磷酸化,增強β-catenin與TCF之間的作用,進而增強將其滯留于核內的作用[66-67]。在慢性粒細胞白血病、結直腸腫瘤、宮頸腫瘤等疾病中,上述關鍵酪氨酸/蘇氨酸磷酸化位點的突變或者酪氨酸/蘇氨酸激酶活性的改變能夠減少βcatenin入核,進而阻止β-catenin介導的信號轉遞功能,抑制腫瘤細胞增殖發展[51]。
結語 Wnt/β-catenin信號通路的異常激活存在于多種疾病中,對于阻斷該信號通路,目前研究主要聚焦于阻斷細胞膜上信號接收(配體與受體)、促進細胞質內β-catenin降解(降解復合體)和抑制細胞核內轉錄(轉錄復合體)[68]。由于β-catenin進入細胞核是激活下游信號通路促進靶基因轉錄的必要前提,而其在細胞核內外的分布受到核膜上及核內外多種因素的影響,因此除上述調控方式以外,在不改變細胞內總量的情況下,減少其入核及核內滯留作用、增加其出核及核外滯留作用,同樣能夠起到阻斷Wnt/β-catenin信號通路的效果,也是潛在的治療該通路相關疾病的有效途徑,值得更多關注。
作者貢獻聲明顧嘉偉 文獻調研和整理,論文構思、設計和撰寫,繪制圖片。牛耿明 可行性分析,論文指導和修訂。柯重偉 獲取資助,論文指導和修訂。
利益沖突聲明所有作者均聲明不存在利益沖突。

