海假交替單胞菌(Pseudoalteromonas marina)pilZ基因缺失抑制厚殼貽貝附著變態
張馳 ,王勁松 ,楊金龍 , ,張俊波 ,萬榮 , ,梁簫 *
( 1. 上海海洋大學 國家海洋生物科學國際聯合研究中心,上海 201306;2. 上海市水產動物良種創制與綠色養殖協同創新中心,上海 201306;3. 南方海洋科學與工程廣東省實驗室(廣州),廣東 廣州 511458;4. 上海海洋大學 海洋科學學院,上海201306;5. 國家遠洋漁業工程技術研究中心,上海 201306;6. 國家遠洋漁業工程技術研究中心舟山分中心,浙江 舟山316014)
1 引言
附著變態是厚殼貽貝(Mytilus coruscus)等海洋無脊椎動物幼蟲生長發育過程中必經的重要階段,一般受到自然環境中所存在的化學因子和動物自身的內源性因子所調控[1]。其中,生物被膜(Biofilm,BF)作為重要的化學誘因被廣泛研究。生物被膜是細菌在成長過程中為應對環境變化而呈現出的一種不同于游離生長形式的菌體,其為聚集黏附于基質表面的被膜狀生物群體[2]。環二鳥苷單磷酸(cyclic di-GMP或c-di-GMP)是細菌胞內普遍存在的一種重要的第二信使,可以通過結合多種不同類型的效應蛋白來調控細菌的諸多生物功能和行為,同時其胞內水平的變化會影響細菌生物被膜的形成[3]。在生物被膜形成的復雜過程中,細菌需要感知、轉導、傳遞來自細胞內外的化學信號,將多糖、蛋白、脂類等物質分泌到胞外形成 胞 外 產 物(Extracellular Polymeric Substances, EPS)包裹菌體。
海假交替單胞菌(Pseudoalteromonas marina),一株分離自海洋環境中所形成的生物被膜上的革蘭氏陰性菌,其自身形成的生物被膜及其分泌的多種具有生物學活性的胞外產物均能誘導厚殼貽貝幼蟲的附著變態[4-8]。例如,Peng等[5]在對P. marinaorf01912基因敲除后發現,細菌胞內c-di-GMP水平顯著增加,同時使生物被膜上可拉酸(Colanic Acid, CA)含量增多,從而促進了厚殼貽貝幼蟲的附著變態;同年,研究發現,當P. marina中fliP基因缺失后,突變菌形成的生物被膜誘導厚殼貽貝附著變態的能力顯著降低,而從野生菌中提取的鞭毛蛋白可以提高幼蟲的附著變態率[6];此外,研究表明,P. marina野生菌提取的鞭毛蛋白能夠促進生物被膜上胞外產物的產生[8];近期研究發現,P. marina中tesA基因缺失會導致胞內c-di-GMP水平升高,同時導致生物被膜中脂肪酸含量下降,從而抑制了厚殼貽貝幼蟲的附著變態[7]。以上研究表明,海假交替單胞菌中某一基因的缺失會影響細菌胞內c-di-GMP水平的變化,改變生物被膜胞外產物的含量,從而間接調控厚殼貽貝幼蟲的附著變態。
c-di-GMP已被證實的胞內效應蛋白或受體包括PilZ結構域蛋白、轉錄因子、退化的GGDEF、EAL或HD-GYP結構域蛋白、AAA ATPase結構域蛋白以及RNA核糖開關等[9-10]。PilZ結構域蛋白作為典型的cdi-GMP結合蛋白近年來被廣泛研究,兩者結合可調控細菌的運動性[11-12]、毒性[13]以及纖維素、藻酸鹽[14-15]等胞外多糖的合成和生物被膜形成[16]。但值得注意的是,并不是所有的PilZ結構域蛋白都具有與c-di-GMP結合的能力,有些PilZ結構域蛋白通過與具有GGDEF和EAL結構域的蛋白相互作用,參與到c-di-GMP調控某些生物因子如IV型菌毛(Type IV pili,T4P)的生物合成信號通路中[17]。
本研究通過P. marina基因組數據[18]篩選出同時被注釋為“PilZ結構域蛋白基因”和“IV型菌毛生物合成基因”的pilZ基因,并利用同源重組的方法構建了P. marinapilZ基因的缺失菌。通過比較野生菌與pilZ基因缺失菌的菌落表型、運動性、形成生物被膜的能力及其生物被膜對厚殼貽貝幼蟲附著變態的影響,為解析P. marina生物被膜的形成機制、生物被膜與厚殼貽貝附著變態的互作關系提供理論依據。
2 材料與方法
2.1 材料
厚殼貽貝眼點期幼蟲均取自浙江省舟山市嵊泗縣(30°73′N,122°44′E),幼蟲在實驗室條件下暫養1周后進行試驗。暫養在鹽度為30,經孔徑為0.45 μm的濾膜(Whatman)過濾后的自然海水中,每隔2 d更換2/3水體,每日按時投喂1次湛江等鞭金藻(5×104cells/mL),放置于18℃暗室內充氣培養。
文章所用菌株和質粒詳見表1。實驗使用的細菌菌株為P. marinaECSMB14103(保藏號:MCCC1K03511),其從形成于浙江省舟山市枸杞島海域(30°73′N,122°77′E)0.5~1.0 m水深的自然生物被膜上分離出來。P. marina野生菌和突變菌均在25℃條件下,于Zobell 2216E培養基(5‰蛋白胨、0.01‰檸檬酸鐵、1‰酵母提取物和15‰瓊脂)中進行培養,配制Zobell 2216E培養基的試劑均購買于Sigma公司。本文用到的Escherichia coliWM3064和pK18mobsacB-ery由中國科學院南海海洋研究所王曉雪研究員實驗室課題組饋贈,E.coliWM3064菌株于37℃下在含有0.3 mmol/L DAP(2,6-diamino-pimelic acid)(Sigma)的LB(Luria-Bertani)(Sangon)培養基上培養。在培養含有pK18mobsacB-ery質粒的菌株時,應加入終濃度為50 μg/mL的卡那霉素(Sangon)和25 μg/mL的紅霉素(Sangon)以維持抗性。其他情況下的菌株和質粒按照先前的研究進行培養[19]。

表1 本研究使用的細菌菌株和質粒Table 1 The strains and plasmids used in this study
2.2 方法
2.2.1pilZ基因突變菌株的構建
參考Zeng等[21]的同源重組方法構建ΔpilZ突變菌株。用帶有限制性酶切位點的引物對,通過PCR擴增出pilZ基因的上下游片段。然后通過雙酶切和連接,PCR產物連接到空載體pK18mobsacB-ery上,從而構建出重組載體。將重組載體導入到E. coliWM3064中,再將導入成功的WM3064菌株和P. marina野生菌株混合,滴加在1/2 SW-LB-DAP平板(正常配制LB固體培養基的情況下,加入1/2的過濾海水并在滅菌后加入0.3 mmol/L的DAP溶液)上進行接合轉移培養。25℃條件下培養2~5 d后,將菌苔按濃度梯度稀釋涂布于含有紅霉素的Zobell 2216E平板上篩選出單菌落,并用LF/SR和SF/LR引物對進行PCR驗證。將驗證正確的菌株涂布于20%蔗糖培養基上培養2 d,挑取單菌落用LF/LR和SF/SR引物對進行PCR驗證。ΔpilZ菌株利用SF/SR、LF/SR、SF/LR和LF/LR引物對進行最終驗證。文章所用引物詳見表2。
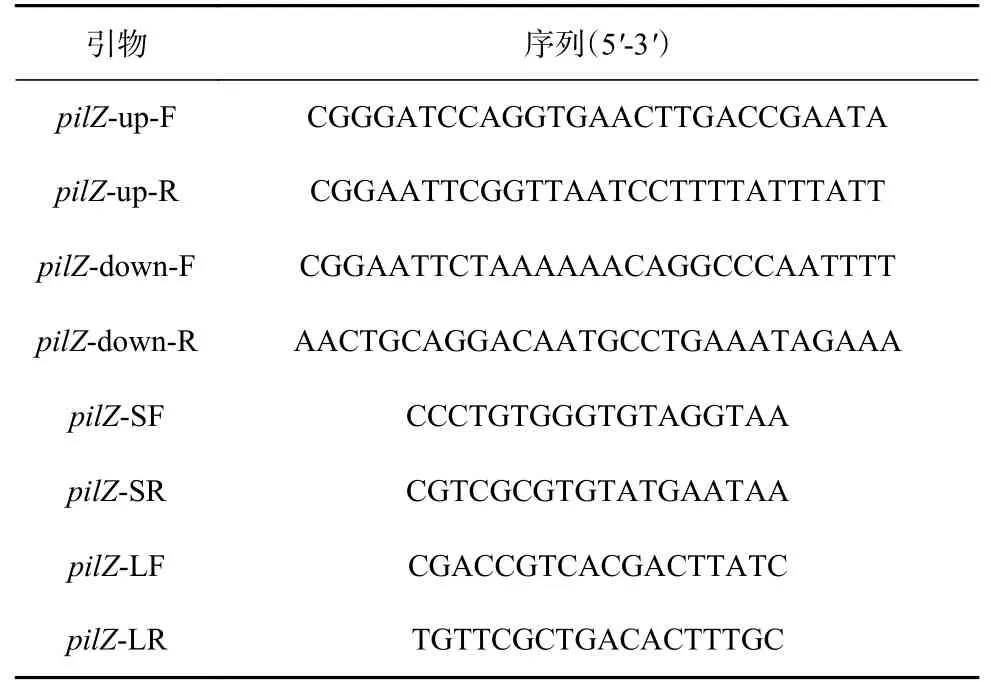
表2 構建ΔpilZ菌株所使用的引物及其序列Table 2 Primers used to construct ΔpilZ strain and its sequences
2.2.2 生物被膜培養
參考Yang等[22]的方法來培養生物被膜。挑取野生菌和ΔpilZ菌單菌落于2216E液體培養基中培養16~18 h(25℃,200 r/min)。用50 mL無菌離心管收集菌液,離心(3 500 r/min,15 min)、棄上清,保留細菌沉淀。加入50 mL滅菌過濾海水(Autoclaved Filtered Seawater, AFSW)吹打混勻,離心后棄上清,保留沉淀,上述步驟重復3次。最終使用AFSW充分混勻細菌沉淀,并定容至50 mL。吸取100 μL定容后的菌液加入到9 900 μL AFSW中稀釋混勻后吸取1 mL用孔徑為0.22 μm的濾膜過濾,然后使用0.1%吖啶橙對濾膜染色5 min(吖啶橙使用前需用孔徑為0.22 μm濾膜過濾),待濾膜風干后制片,使用熒光顯微鏡(Olympus BX51)觀察計數,在10×目鏡、100×油鏡下隨機選取10個均勻視野進行細菌計數,每組分別設置3個平行,最終通過計算確定1 mL稀釋菌液的細菌數量。根據所得細菌密度向裝有無菌載玻片(12.7 mm×38.1 mm)的無菌培養皿(64.0 mm(Φ)×19.0 mm(高))中加入相應量菌液,并使用AFSW補加定容至20 mL,一共設置了1×108cells/mL、3×108cells/mL、5×108cells/mL和1×109cells/mL 4種初始濃度。最后將培養皿放置于18℃條件下培養48 h。
2.2.3 生物被膜上細菌密度計數
取出制備好的生物被膜放入甲醛溶液(5%)中固定24 h后,再用AFSW輕輕潤洗載玻片3次后染色,染色及觀察方法同2.2.2節,有關計算公式參照文獻[22]。
2.2.4 幼蟲附著變態鑒定
按上述方法培養好野生菌和ΔpilZ菌的生物被膜,用AFSW輕輕潤洗3次生物被膜,然后將1片附有生物被膜的載玻片和20只活性良好的幼蟲放入盛有20 mL AFSW的無菌玻璃培養皿中。將其置于18℃下避光培養,使用體視顯微鏡在10×目鏡、5×物鏡下觀察幼蟲和附著變態幼蟲。與幼蟲相比,附著變態的幼蟲纖毛環消失、具有鰓和稚貝殼,幼蟲附著變態的個數可間接反映不同單一生物被膜對幼蟲附著變態影響的差異。無生物被膜的滅菌短玻片(12.7 mm×38.1 mm)作為陰性對照,10-4g/mL的腎上腺素(Epinephrine, EPI)作為陽性對照。不同菌株生物被膜每個濃度下做9個生物學重復。
2.2.5 細菌菌落形態
挑取單菌落于2216E液體培養基中培養16~18 h(25℃,200 r/min)后,按濃度梯度稀釋涂布于Zobell 2216E固體平板上,于25℃恒溫培養箱中培養2~5 d,選取大小均勻的單菌落進行表型拍攝。
2.2.6 細菌運動性
方法參照Zeng等[21]的描述。挑取野生菌和ΔpilZ菌株單菌落于5 mL的2216E液體培養基中,同時設置無菌的2216E培養基作為空白對照,置于25℃、200 r/min條件下震蕩培養至指數期(OD600約為1.0)。吸取1 μL培養后的菌液垂直懸浮滴加到0.3%瓊脂平板上,在25℃下培養2 d。本試驗設置了3個獨立的生物學重復。
2.2.7 生物被膜膜厚觀察
使用甲醛溶液(5%)將形成好的野生菌和ΔpilZ菌株生物被膜固定24 h,5 μg/mL的碘化丙啶(Propidium Iodide, PI)用來對生物被膜染色。避光染色15 min后,用AFSW輕輕洗掉生物被膜上多余的染料。每個載玻片隨機選擇3個顯微鏡視野觀察,使用徠卡TCS SP8共聚焦激光掃描顯微鏡(CLSM)觀察細菌分布和生物被膜膜厚。本試驗設置了3個獨立樣片。
2.2.8 生物被膜胞外產物染色
P. marina生物被膜染色方法參考González-Machado等 [23] 和Peng等[5]的方法,具體信息參考表3。使用150 mmol/L氯化鈉溶液潤洗附有生物被膜的載玻片,再避光染色20 min,然后用150 mmol/L氯化鈉溶液輕輕洗去多余染料,處理后的樣片使用共聚焦激光掃描顯微鏡和LAS X軟件采集共聚焦圖像。野生菌和ΔpilZ菌株生物被膜分別制備3個重復樣片,每個樣片隨機選取3個均勻視野進行拍攝。
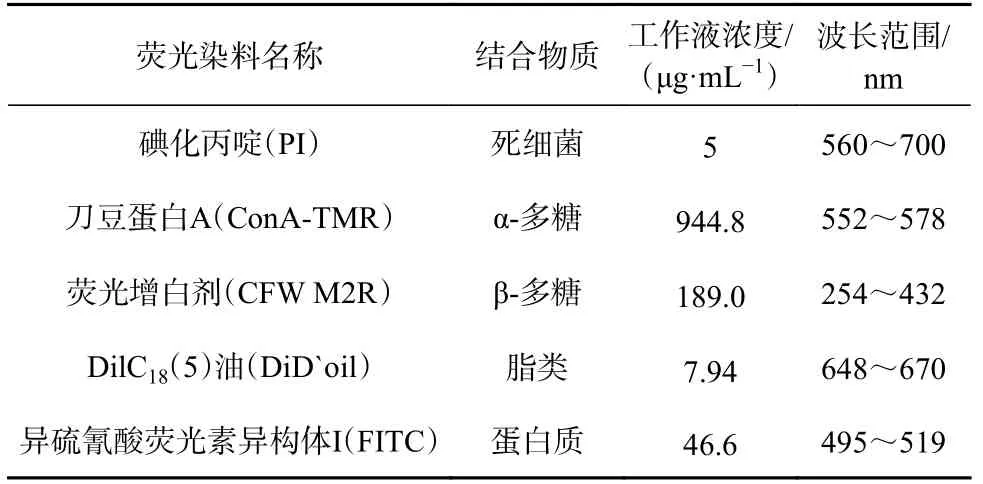
表3 激光共聚焦顯微鏡熒光染料信息Table 3 Laser confocal microscopy fluorescence dye information
2.2.9 胞內c-di-GMP定量
將野生型和ΔpilZ突變菌株用2216E液體培養基搖瓶在25℃、200 r/min條件下培養16~18 h,并用干凈無菌的2216E培養基稀釋至OD600值為0.3。取5 mL稀釋后的菌液于12 000×g下離心5 min,棄去上清,保留沉淀。將沉淀風干后,加入100 μL的c-di-GMP提取液(0.1%(V/V)甲酸、40%(V/V)乙腈、40%(V/V)甲醇和19.9%(V/V)水),吹打混勻后在冰上孵育15 min;然后于16 000 ×g下離心5 min。取上清液用于LC-MS/MS定量分析,方法參考文獻[24]。c-di-GMP標準品(Sigma)標準曲線用于計算上清液濃度,該實驗設置了9個生物學重復。
2.2.10 數據分析
附著變態的幼蟲所占的百分比要通過Arcsine轉換以提高數據正態性。在數據統計分析前,利用JMPTM軟件(10.0.0版)的Shapiro-Wilk’s W檢驗來檢驗數據的正態性。采用Kruskal-Wallis和Steel-Dwass All Pairs檢驗組間差異顯著性。相關性分析采用Spearman秩相關檢驗。p<0.05作為差異顯著性的臨界值。使用Image J軟件處理共聚焦圖像,計算生物被膜胞外產物中各個成分的含量(單位:μm3)。
3 結果與分析
3.1 PCR鑒定pilZ基因缺失
如圖1A所示,M表示DNA標記,自上而下條帶大小分別為4 500 bp、3 000 bp、2 000 bp、1 200 bp、800 bp、500 bp、200 bp。第1、3、5、7號條帶是用野生型菌株的總DNA為模板擴增的PCR產物,第2、4、6、8號條帶是用突變菌總DNA為模板擴增出的PCR產物。1號和2號條帶所用引物對為pilZ-SF/-SR,3號和4號條帶所用引物對為pilZ-LF/-SR,5號和6號條帶所用引物對為pilZ-SF/-LR,7號和8號條帶所用引物對為pilZ-LF/-LR。野生型菌株的PCR產物對應大小分別為1 991 bp(條帶1)、2 155 bp(條帶3)、2 849 bp(條帶5)和3 013 bp(條帶7);ΔpilZ的PCR產物對應大小則分別為1 664 bp(條帶2)、1 828 bp(條帶4)、2 522 bp(條帶6)和2 686 bp(條帶8)。圖1B為P. marina pilZ基因敲除前后的基因簇。
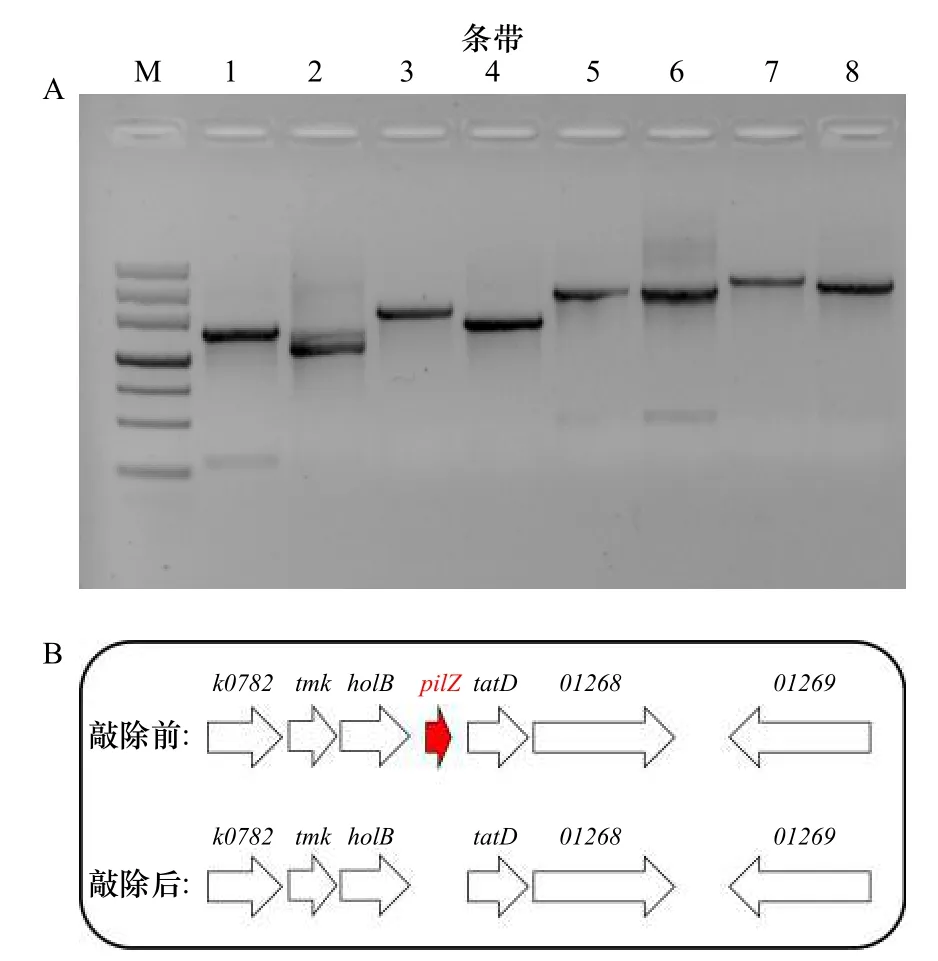
圖1 pilZ基因缺失驗證(A)和缺失前后基因簇(B)Fig. 1 The pilZ gene deletion verification (A) and gene cluster(B) before and after knockout
3.2 ΔpilZ生物被膜對厚殼貽貝幼蟲附著變態的影響
對野生型和ΔpilZ菌株生物被膜的幼蟲附著變態率進行分析比較顯示,ΔpilZ生物被膜的幼蟲附著變態率顯著低于野生菌生物被膜(p<0.05)(圖2A),抑制了厚殼貽貝幼蟲的附著變態。其中,初始細菌密度5×108cells/mL下,ΔpilZ附著變態率較野生菌下降極為顯著,相比較于野生型菌株33.88%的附著變態率,ΔpilZ菌株附著變態率僅為10.56%,附著變態率下降了68.87%(p<0.01)。此外,ΔpilZ生物被膜的細菌密度在不同初始細菌濃度下,均顯著高于野生菌生物被膜,初始細菌密度5×108cells/mL下,ΔpilZ生物被膜細菌密度較野生型增加了35.76%(p<0.05)(圖2B)。相關性分析結果表明,無論是野生菌還是ΔpilZ菌,生物被膜的細菌密度與其幼蟲附著變態率均無顯著關系(p>0.05)。
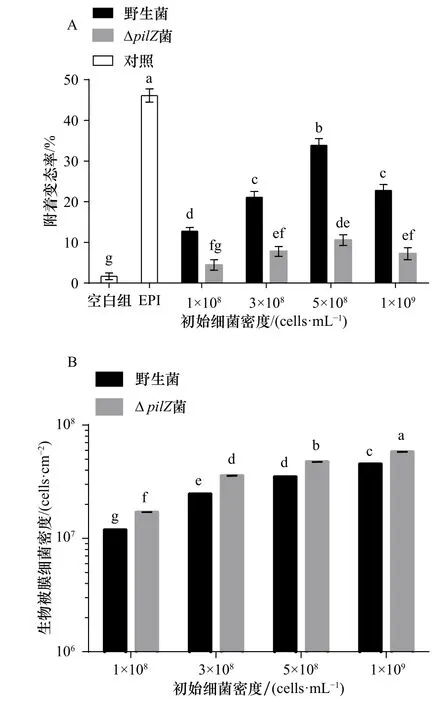
圖2 不同初始細菌密度下野生菌與ΔpilZ菌生物被膜對幼蟲附著變態的影響(A)及生物被膜細菌密度的分析(B)Fig. 2 Effect of wild-type and ΔpilZ biofilms formed with different initial bacterial density on larval settlement and metamorphosis (A) and the analysis of biofilm bacterial density (B)
3.3 pilZ基因缺失對菌體形態的影響
P. marina野生菌單一菌落表型為規則的圓形,表面光滑(圖3A),ΔpilZ菌株單個菌落表型與野生菌相比,未顯示出明顯不同的變化(圖3B)。
圖3 菌落形態Fig. 3 Colony morphology of bacteria
3.4 ΔpilZ菌運動性和生物被膜CLSM圖像分析
野生菌在半固體培養基上形成了明顯的趨化圈,但與野生型菌相比,ΔpilZ菌株的運動性降低(圖4A)。CLSM圖像顯示,ΔpilZ生物被膜上聚集的細菌比野生菌生物被膜多,二者數量明顯不同(圖4C,圖4D)。野生菌生物被膜的膜厚為(5.16±0.16)μm,而ΔpilZ菌生 物 被 膜 膜 厚 為(6.2±0.18)μm,較 野 生 菌 增 加 了20.16%,差異性分析顯示,二者之間存在顯著性差異(p<0.05)(圖4B)。
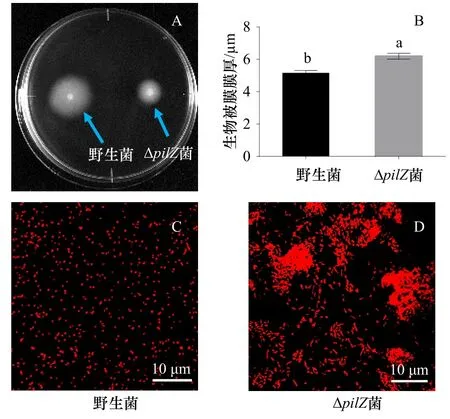
圖4 野生型菌株和ΔpilZ菌株運動性(A)、生物被膜(C、D)和膜厚(B)Fig. 4 Motility (A), biofilm (C, D) and biofilm thickness (B)of wild-type and ΔpilZ strains
3.5 ΔpilZ生物被膜胞外產物CLSM圖像分析
共聚焦圖像及生物量數據統計分析結果比較顯示,與野生型菌株相比,ΔpilZ菌株生物被膜胞外產物中β-多糖和蛋白含量變化不同(圖5A)。CLSM圖像處理結果表明,其中β-多糖含量降低了42.57%,蛋白含量下降了19.34%,而對于α-多糖和脂質未觀察到差異(p>0.05,圖5B)。
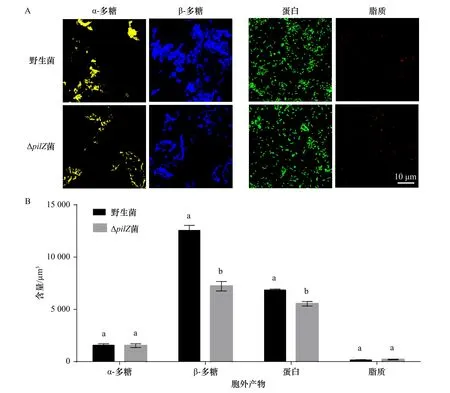
圖5 野生型菌株和ΔpilZ菌株生物被膜共聚焦掃描圖像(A)和統計結果(B)Fig. 5 Confocal scanning images (A) and statistical results (B) of biofilm of wild-type and ΔpilZ strains
3.6 細菌c-di-GMP水平
根據LC-MS/MS定量分析結果以及c-di-GMP標準曲線得出,ΔpilZ胞內c-di-GMP水平為(20.50±1.09)ng/mL,野生菌胞內c-di-GMP水平為(21.10±1.35)ng/mL,突變菌株與野生菌胞內c-di-GMP水平無顯著性差異(p>0.05)(圖6)。
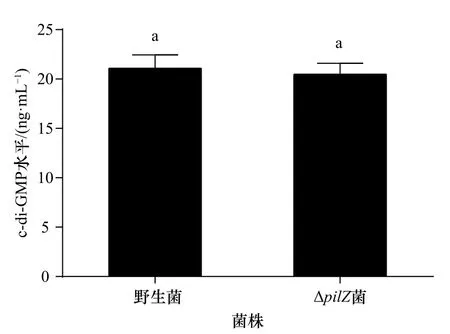
圖6 野生菌和ΔpilZ菌的胞內c-di-GMP水平Fig. 6 The c-di-GMP levels of wild-type and ΔpilZ strains
4 結論與討論
c-di-GMP作為細菌胞內第二信使早已在30多年前被首次報道過[14],且被證實與細菌運動、細菌聚集、胞外產物的生成和生物被膜形成有關[25-27]。在絕大多數細菌中,胞內c-di-GMP水平調控細菌由浮游生活向固著生物被膜生活方式的轉變[28-30]。Jenal等[3]研究表明,當細菌胞內c-di-GMP處于較高水平時會使細菌聚集靠攏,進而促進生物被膜的形成。同時,胞內c-di-GMP的水平與纖維素[31-32]、藻酸鹽[15]、Pel多糖[33]等細菌胞外多糖的產生也緊密相關;藻酸鹽和Pel多糖[34-35]等胞外多糖又可影響銅綠假單胞菌(Pseudomonasaeruginosa)生物被膜的形成。因此,細菌胞內c-di-GMP水平不僅可以直接影響生物被膜的形成,還可以通過調控胞外多糖的含量來影響生物被膜形成。在海假交替單胞菌以往的研究中,當菌體多糖合成相關基因orf01912、脂肪酸合成基因tesA和纖維素合成基因BcsQ缺失后,細菌胞內c-di-GMP水平發生變化,影響生物被膜胞外產物的含量,進而影響厚 殼 貽 貝 幼 蟲 的 附 著 變 態[5,7,36]。其 中,胞 外 多 糖 合 成相關基因01912表達蛋白的結構域中含有可與c-di-GMP結合的AAA ATPase結構域,當c-di-GMP的靶基因01912缺失后,菌體胞內c-di-GMP水平升高[5],表明菌體某些結合蛋白基因的缺失會影響到胞內cdi-GMP水平的改變,從而引起生物被膜胞外產物的變化。在本研究中,pilZ基因缺失后形成的生物被膜胞外β-多糖和蛋白的含量、誘導厚殼貽貝幼蟲附著變態的能力均顯著降低(p<0.05)。然而,野生菌與ΔpilZ菌株胞內c-di-GMP水平的定量結果顯示,兩株菌胞內c-di-GMP水平并無顯著性變化(p>0.05),與此前的研究呈現出相反的結果。通過對pilZ基因表達產物的結構預測發現其具有PilZ結構域,表明該表達產物是c-di-GMP結合蛋白。然而當P. marina pilZ基因缺失后并未像此前的研究結果那樣可以通過影響菌體胞內c-di-GMP的水平來改變胞外產物的含量,從而影響厚殼貽貝附著變態。因此,推測該基因可能通過其他途徑調控生物被膜形成及厚殼貽貝幼蟲附著變態。
pilZ基因最初發現是作為IV型菌毛生物合成和抽搐運動所必需的調控基因[18]。Welker等[37]研究表明,T4P運動馬達的活性可調節細菌微菌落的局部結構和黏度,微菌落作為生物被膜的前體結構直接影響生物被膜的成熟與否。在腦膜炎奈瑟菌(Neisseria meningitidis)中,T4P的收縮可以增強菌落的流動性,從而有利于生物被膜的擴散、成熟[38]。在銅綠假單胞菌(P. aeruginosa)和黃色黏球菌(Myxococcus xanthus)中,抽搐運動作為菌體的另一種特殊運動方式影響生物被膜形成[39-41]。在本研究中,相較于野生菌,pilZ基因缺失后菌體運動能力下降,生物被膜上細菌密度、膜厚明顯增加(p<0.05),這可能是因為pilZ基因缺失影響T4P的抽搐運動,進而導致細菌附著在載玻片上時運動性減弱,使細菌更容易聚集在一起形成生物被膜。
同時,在對黃色黏球菌的研究中發現[42],菌體S運動過程中,細菌胞外多糖可以調節T4P的反應,且二者之間存在相互作用,T4P的缺失會影響到胞外多糖的含量。而多糖作為生物被膜胞外產物的主要成分[2],可誘導海洋無脊椎動物幼蟲的附著變態。如纖維素的過量產生、莢膜多糖的減少均可以抑制厚殼貽貝幼蟲的附著變態[21,43];可拉酸含量增加,會促進厚殼貽貝幼蟲的附著變態[5]。本研究中,與野生型菌株相比,ΔpilZ菌株所形成的生物被膜顯著抑制了厚殼貽貝幼蟲的附著變態;通過共聚焦圖像分析結果可以看出,ΔpilZ菌株較野生型菌株而言,胞外產物中β-多糖和胞外蛋白含量顯著下降,相關性分析結果表明,幼蟲附著變態率與二者顯著相關(p<0.05)。由此可見,pilZ基因缺失后菌體可能因無法正常組裝T4P而引起菌體運動性下降、生物被膜上的胞外多糖含量及蛋白減少,進而抑制了厚殼貽貝幼蟲的附著變態。另外,pilZ基因缺失后菌體表面的T4P變化以及該基因的表達產物與c-di-GMP之間的相互作用仍需進一步探究。
綜上所述,本研究利用同源重組方法構建P. marina pilZ基因缺失菌,菌體pilZ基因的缺失會影響T4P的正常組裝和抽搐運動,細菌運動性減弱,形成的生物被膜膜厚增加、細菌密度增加,胞外產物中β-多糖和蛋白含量減少,進而降低了對厚殼貽貝幼蟲附著變態的誘導能力。本研究為進一步了解海洋細菌生物被膜形成的分子機制及其對厚殼貽貝幼蟲附著變態的誘導機制提供了理論依據。

