山東某鵝場細小病毒、圓環病毒和多瘤病毒感染情況調查
邵 震 , 蘇敬良
(中國農業大學動物醫學院 農業農村部人畜共患病重點開放實驗室 , 北京 海淀 100193)
鵝細小病毒(Goose parvovirus,GPV)、鵝圓環病毒(Goose circovirus,GoCV)和鵝多瘤病毒(Goose polyomavirus,GHPV)均是商品鵝群中常見的傳染性病毒。雛鵝GPV感染自1956年發現以來在我國持續存在,因其傳播迅速,死亡率高而嚴重威脅著商品鵝生產[1-2]。GoCV和GHPV感染早期由歐洲學者發現和確診,近年來,我國陸續也有鵝群感染的報道。GoCV主要侵染動物的淋巴網狀內皮組織,進而損傷動物機體的免疫力,使動物更易感染條件致病性病原體[3],發病鵝生長緩慢,體重下降,尤其對肉用鵝養殖業危害巨大[4]。GHPV感染可引起死亡率極高的全身性致死性疾病,雖然我國尚未暴發過GHPV感染,但是從部分水禽源樣品中也檢出該病毒的存在,隨著多地從國外頻繁的引種,GHPV感染的可能性越來越高,一旦暴發將給我國養鵝業造成重大損失。
我國是世界上商品鵝養殖數量最多的國家,隨著養殖規模的擴大和養殖方式的多樣化,疾病的發生也更為頻繁和復雜,在很大程度上嚴重威脅我國養鵝業的健康發展。目前大部分鵝病防控報道主要集中于雛鵝和產蛋鵝,對青年鵝的健康狀況了解極少。在實際生產中,這3種病毒經常發生混合感染的情況,危害嚴重。因此,調查鵝養殖場這3種病毒的感染情況是非常必要的。本試驗選擇山東某鵝場作為研究對象,收集屠宰后的青年鵝脾臟1 474份,采用PCR技術對樣品中GPV、GoCV和GHPV的基因片段進行檢測,初步了解和掌握了該鵝場青年鵝群3種病毒的感染情況,以期為進一步開展疾病的預防和控制研究提供可借鑒的資料。
1 材料與方法
1.1 病料 山東某鵝場2019年4—11月屠宰的110~120日齡鵝的脾臟。
1.2 主要試劑 E.Z.N.A.TMViral DNA Kit,購自北京奧美德諾基因科技公司;2×TaqPCR StarMix,購自GenStar公司;Biowest,購自北京康潤誠業生物科技有限公司;核酸染料,購自北京中創宏達科技有限公司。
1.3 主要儀器 離心機,Thermo Electron Corporation產品;組織勻漿機,寧波新芝生物股份科技有限公司產品;PCR儀L9600,北京萊普特科學儀器有限公司產品;電泳儀DYY-6C型,北京六一儀器公司產品;紫外投射分析儀,北京智源通技術公司產品。
1.4 試驗方法
1.4.1 病料的處理 用滅菌剪刀小心將脾臟的外部去除,取內部組織裝入1.5 mL凍存管中,加入滅菌的PBS和鋼珠,對稱放入高通量組織研磨機中磨碎(50 Hz 30 s,每次間隔10 min,運行4次),待組織充分磨碎后,以13 000 g離心5 min,吸取上清液。
1.4.2 病毒DNA的提取 參照E.Z.N.A.TMViral DNA Kit試劑盒操作說明書進行。
1.4.3 GPV的PCR檢測 本試驗針對GPV基因組中編碼高度保守VP1蛋白的基因序列,以發表的GPV基因組序列(GenBank登錄號:EU583391.1)為參考設計1對引物:GPV-F(5′-CCTGGCTATAAGTATCTTGG-3′),GPV-R(5′-GTAGATGTGGTTGTTGTAGC-3′)。預期擴增片段長度為593 bp。50 μL反應體系:2×TaqPCR StarMix 25 μL,上下游引物各2 μL,ddH2O 16 μL,待檢DNA模板5 μL。反應程序:94 ℃預變性120 s;94 ℃變性30 s,58 ℃退火30 s,72 ℃延伸50 s,共35個循環;72 ℃終末延伸10 min。PCR產物經瓊脂糖凝膠電泳后觀察結果,記錄數據。
1.4.4 GoCV的PCR檢測 本試驗針對GoCV基因組中編碼保守結構蛋白的基因序列,以發表的GoCV基因組序列為參考設計1對引物:GoCV-F(5′-TAAATGCGAGTTTGATGTGTCT-3′),GoCV-R(5′-CATTTAACCCCTTCCAAAGAGT-3′)。預期擴增片段長度為564 bp。50 μL反應體系:2×TaqPCR StarMix 25 μL,上下游引物各2 μL,ddH2O 16 μL,待檢DNA模板5 μL。反應程序:94 ℃預變性240 s;94 ℃變性30 s,55 ℃退火30 s,72 ℃延伸40 s,共32個循環;72 ℃終末延伸8 min。PCR產物經瓊脂糖凝膠電泳后觀察結果,記錄數據。
1.4.5 GHPV的PCR檢測 本試驗針對GHPV基因組中編碼高度保守VP1蛋白的基因序列,以GHPV基因組序列(GenBank登錄號:MG673522.1)為參考設計1對引物:GHPV-F(5′-CAGGCAGTGACTGTTGCAACA-3′),GHPV-R(5′-TGTGTTTTCAT
TCCGGGATGGG-3′)。預期擴增片段長度為459 bp。50 μL反應體系:2×TaqPCR StarMix 25 μL,上下游引物各2 μL,ddH2O 16 μL,待檢DNA模板5 μL。反應程序:94 ℃預變性120 s;94 ℃變性30 s,58 ℃退火30 s,72 ℃延伸50 s,共35個循環;72 ℃終末延伸10 min。PCR產物經瓊脂糖凝膠電泳后觀察結果,記錄數據。
2 結果
2.1 病料背景 該鵝場種鵝從國外引進,雛鵝為自繁自養,分別在1日齡和7日齡注射1次小鵝瘟抗體,10日齡和30日齡各免疫1次禽流感疫苗(H5+H7),50日齡前后免疫1次鵝副黏病毒滅活疫苗。
2.2 本試驗采用的PCR檢測方法的驗證 為了證明本試驗所采用的方法及所設計的引物的確可以檢測出這3種病毒的感染,本試驗以前期獲得的3種病毒陽性樣本為檢測對象,采用設計的引物按照上述反應條件可成功地檢測到病毒相應的目的條帶(圖1)。PCR擴增產物測序結果與預期一致,證明了本試驗所采取的PCR檢測方法真實有效。

圖1 PCR擴增GHPV(A)、GoCV(B)和GPV(C)基因片段Fig.1 PCR amplification of GHPV(A), GoCV(B) and GPV(C) gene fragmentsM:DL-2 000 plus DNA相對分子質量標準; 1:陰性對照; 2:本實驗室前期獲得的病毒陽性樣本M:DL-2 000 plus DNA marker; 1:Negative control; 2:Positive virus samples kept in the laboratory
2.3 病料中3種病毒的檢測 采用所建立的PCR方法對從山東地區鵝場收集的1 474份鵝脾臟病料進行GPV、GoCV和GHPV檢測,結果顯示該鵝場有不同程度的感染(表1)。檢出的陽性樣本總數為909份,總陽性率為61.67%(909/1 474)。單一病毒感染陽性率為38.74%(571/1 474),其中GPV單一感染率為15.13%(223/1 474);GoCV單一感染率為20.15%(297/1 474);GHPV單一感染率為3.46%(51/1 474)。雙重感染陽性率為16.01%(236/1 474),其中GPV和GoCV雙重感染率為7.67%(113/1 474);GHPV和GPV雙重感染率為4.68%(69/1 474);GHPV和GoCV雙重感染率為3.66%(54/1 474)。檢測到GPV、GoCV和GHPV三重感染樣本102份,陽性率為6.92%(102/1 474)。
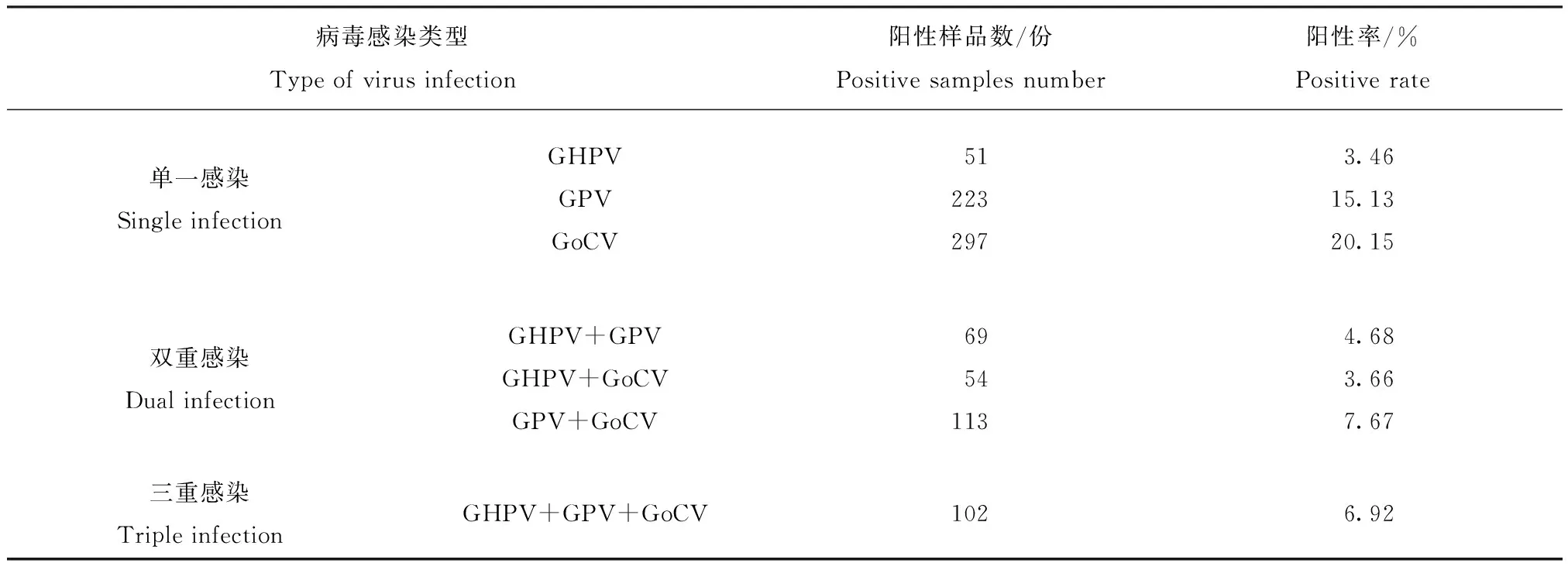
表1 鵝脾臟樣品中GPV、GoCV和GHPV感染情況Table 1 GPV,GoCV and GHPV infections in goose spleen samples
3 討論
GPV、GoCV和GHPV是危害鵝養殖業的3種DNA病毒。由于GoCV和GHPV無法分離,目前除了剖檢觀察病變外,最常用的檢測方法是PCR檢測法。眼觀病變受主觀影響較大,且GoCV通常無明顯病變,大日齡鵝感染GPV后通常無明顯癥狀,GHPV癥狀較易與其他病毒混淆。綜合考慮之下,PCR檢測法相對快速、簡單、準確。
本試驗對該鵝場GPV、GoCV和GHPV感染情況進行調查,發現3種病毒的檢出率較高且存在不同程度的混合感染。其中GPV檢出率(34.40%)和GoCV檢出率(38.40%)均顯著高于GHPV檢出率(18.72%),這較為符合GHPV尚未在我國暴發的實際情況。同時對比其他學者的研究可以發現,本調查中GPV單一檢出率(15.13%)低于殷奇峰[5]報道的張家口市部分地區GPV檢出率(28.30%),王傳鈞等[6]報道的安徽地區GPV檢出率(86.11%),龔鐸[7]報道的山東地區GPV檢出率(82.30%),曹志全等[8]報道的儀征市GPV檢出率(48.13%),葛凱等[9]報道的六安市GPV檢出率(33.09%),關靜[10]報道的綏濱縣GPV檢出率(33.86%),武世珍[11]報道的濰坊地區GPV檢出率(41.60%)和桂德旺等[12]報道的鳳臺縣GPV檢出率(34.85%)。出現這種情況的原因可能是該鵝場曾經對鵝群進行過大范圍的免疫接種;而且雛鵝為自繁自養,這可能在一定程度上降低了GPV的感染率。但是從調查結果可以看出,青年鵝群仍然存在較高的GPV感染和傳播風險,所以在引種時一定要把好檢疫檢測關,防止GPV從外輸入;應該加強對青年鵝群GPV抗體水平的監測,掌握鵝群的健康狀況,一旦發現問題可以及時處理。
本試驗中GoCV單一檢出率(20.15%)低于陳濟鐺等[13]報道的GoCV檢出率(44.40%),Shehata等[14]報道的匈牙利GoCV檢出率(88.60%)和余旭平等[15]報道的浙江GoCV檢出率(35.40%)。由于GoCV的體外分離培養存在較大困難,所以不同日齡鵝對該病毒的易感性及該病毒的致病作用尚需進一步研究和評估。
本試驗中GHPV單一檢出率(3.46%)低于Miksch等[16]報道的GHPV檢出率(43.00%),Palya等[17]報道的匈牙利GHPV檢出率(23.17%),Gawe等[18]報道的GHPV檢出率(32.00%),Kaszab等[19]報道的匈牙利GHPV檢出率(34.56%)和Garmyn等[20]報道的比利時GHPV檢出率(40.00%),結果符合GHPV在我國尚未大范圍暴發這一事實,但是同時也應該注意到正是因為我國尚未暴發過GHPV大流行,所以GHPV在我國的真實流行情況,是否存在大范圍的隱性感染等一系列問題還需要進行更加深入的研究。姜甜甜等[21]曾經從鴨病料中檢測出GHPV,這說明鴨源GHPV具有感染鵝群的潛在危險,鴨群可以成為GHPV的貯藏器,所以應該嚴防家鵝與鴨、野生水禽發生直接或間接的接觸。我國水禽資源豐富,分布廣泛,各地都有特色的品種,但是我國大部分水禽飼養場的養殖方式較為粗獷,養殖環境較為惡劣,飼養方式較為多樣,大部分為鴨、鵝混養混飼,這無疑增加了鵝感染鴨源GHPV的風險。在鴨源GHPV流行的地區,也應加強對鵝群GHPV流行病學的調查及預防,以防造成無法挽回的損失。加強飼養管理,有計劃的徹底消毒可以在一定程度上防控該病。

