手控注射萃取-光譜多元校正同時測定多組分金屬離子
齊國敏
(福州大學化學學院,福建 福州 350108)
0 引言
重金屬離子具有較強的生物毒害作用,對生態環境和人類具有嚴重潛在危害,開展重金屬離子檢測是水質監測中的重要要求[1]. 目前重金屬測定方法主要包括原子吸收[2]、電化學[3]、電感耦合等離子體-質譜[4]、分光光度[5-6]等. 其中分光光度法操作簡單快速、儀器設備要求低、重現性好,普遍用于基層實驗室的金屬離子定量分析; 然而,多種金屬離子共存時,不同金屬反應物的光譜會發生重疊而難以直接分辨識別[7-8],往往需要引入大型色譜分離或其他儀器進行組分分離,常規分光光度法的直接應用難以同時測定多組分金屬離子.
化學計量學技術采用數學方法分辨光譜,無需化學或物理分離可以直接測定混合多組分[9]. 研究人員采用偏最小二乘-紫外可見光度法、或將正交信號校正、小波包變換法和偏最小二乘法相結合,同時測定了Fe (III)等金屬多組分, 或基于NMF-PLS實現了對土壤重金屬含量反演模型[10-12]. 化學計量學-可見光譜聯用技術已廣泛應用于多組分同時測定. 但是紫外可見光譜法測定金屬離子的靈敏度不高,如何高靈敏地同時檢出多組分,有待進一步完善.
本研究提出一種簡易的快速萃取和光譜同時識別模式. 將手控注射式固相柱萃取、可見光譜和計量分析相結合,以Pb(II)、Cd(II)和Cu(II) 離子為例,開展巰基葡聚糖凝膠微柱手控注射萃取; 以4-(2-吡啶偶氮)間苯二酚(PAR)為指示劑測量金屬的吸收光譜,結合偏最小二乘方法進行多組分計量分析和同時測定. 實驗進行柱萃取參數優化,研究不同組分的相關系數、模型主成分數優化和準確性預測,實現水中Pb(II)、Cd(II)和Cu(II)多組分同時測定,并與經典的原子吸收法比較. 本研究有助于為痕量重金屬離子的多組分同時測定提供技術支持.
1 實驗部分
1.1 儀器和試劑
紫外-可見分光光度計(UV-2450型,日本島津公司); 精密酸度計(PHS-3C型,上海大普儀器有限公司); 原子吸收分光光度計(TAS-986型,北京普析通用有限公司); 注射式萃取柱為實驗室自制.
硝酸鉛(分析純(AR))購自上海化學試劑公司; 硫酸銅(AR)、氯化鎘(AR)購自上海勤工化工廠; 甲醛溶液(質量分數37%)、冰醋酸(AR)、4-(2-吡啶偶氮)間苯二酚(質量分數90%)購自天津市福晨化學試劑廠; 葡聚糖凝膠Sephadex G-15(AR)購自上海澤葉生物科技有限公司); 實驗用水為二次蒸餾水.
1.2 吸附劑合成及手控萃取裝置制備
參照文獻[13]合成巰基葡聚糖凝膠(SDG): 在圓底燒瓶中分別加入10 mL硫代乙醇酸和四氫呋喃,調節為弱酸性; 加入10.0 g 葡聚糖凝膠Sephadex G-15,40 ℃下反應48 h,產物用二次蒸餾水多次洗滌、無水乙醇抽濾; 所得產物35 ℃干燥備用.
注射式萃取裝置由3個部分組成: 一次性注射器、接口和萃取柱. 將上述合成的巰基葡聚糖凝膠(SDG)裝入4 mm×75 mm 長度聚乙烯微柱,通過接口與注射器連接,兩端各裝上中央多孔篩板的墊片,以15 mL·min-1速度進行樣品的萃取富集.
1.3 光譜相關系數R和預報殘差平方和(PRESS)計算
根據文獻[14],不同組分光譜相關系數R和預報殘差平方和(predicted residual sum of squares, PRESS)計算公式如下:
C(i,j)=E{[X(i, :)-E(X(i, :))]×[X(j, :)-E(X(j, :))]}
其中:C是一個[i,j]的協方差矩陣,i,j都是列向量;E是期望值;X(i,:),X(j,:)為i,j組分的光譜值.
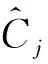
1.4 樣品分析
待測樣品采用手控注射萃取方法進行富集. 調整待測液的pH值,采用一次性注射器吸取待測液,15 mL·min-1流速進行注射,重復上述操作進行富集(視樣品溶液體積而定). 采用少量二次水洗滌沒有被吸附的金屬離子,以相同流速用5 mL 2.0 mol·L-1硝酸溶液洗脫,適當濃度的NaOH溶液調節pH值并定容至6 mL. 將標準金屬離子溶液、PAR指示劑和硼酸緩沖溶液混合顯色,在460~700 nm區間進行譜圖掃描,將數據導入所建的數學模型中, 采用Matlab分析軟件(R2008a型,美國MathWorks公司)計算分析,實現混合物中各組分特征譜學分辨和含量同時測定.
2 實驗結果與分析
2.1 手控注射萃取參數
在金屬離子(Pb(II)、Cd(II) 和Cu(II)) 質量濃度均為0.40 μg·mL-1,洗脫溶液為 5.0 mL 2.0 mol·L-1硝酸溶液的條件下,采用裝有SDG吸附劑的萃取柱對Pb、Cd和Cu進行手控注射萃取,如圖1(a)所示,在溶液pH>3.50時,Pb(II)、Cd(II)和Cu(II)離子有效吸附在SDG上(三者回收率均可以達到90%以上); 考察Pb(II)、Cd(II)和Cu(II)在固相萃取柱的洗脫條件,如圖1(b)所示,保持Pb(II)、Cd(II)和Cu(II)質量濃度為0.40 μg·mL-1,進樣溶液體積200~800 mL時,Pb(II)、Cd(II)和Cu(II)均能得到有效的吸附,當進樣體積大于800 mL時,Cd離子回收率發生下降,主要是由于Cd離子水溶性較大,較低濃度樣品大體積富集處理時可能發生Cd離子流失,導致萃取效率降低; 圖1(c)、(d)表明,隨著硝酸溶液濃度的增大,H+與SDG柱上金屬離子的離子交換作用增強,洗脫作用增強,當采用5.0 mL 2.0 mol·L-1硝酸溶液,Pb(II)、Cd(II)和Cu(II)離子可以被有效地洗脫,三者回收率分別為97.5%、95.0%和96.1%. 通過以上參數優化,手控注射SDG柱可以實現Pb(II)、Cd(II)和Cu(II)的快速萃取和富集.
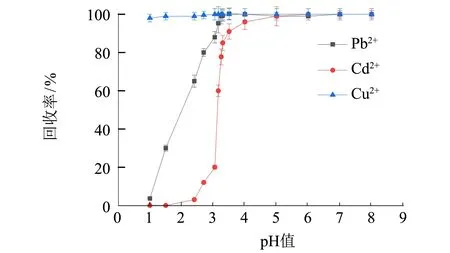
(a) 樣品溶液pH值的影響
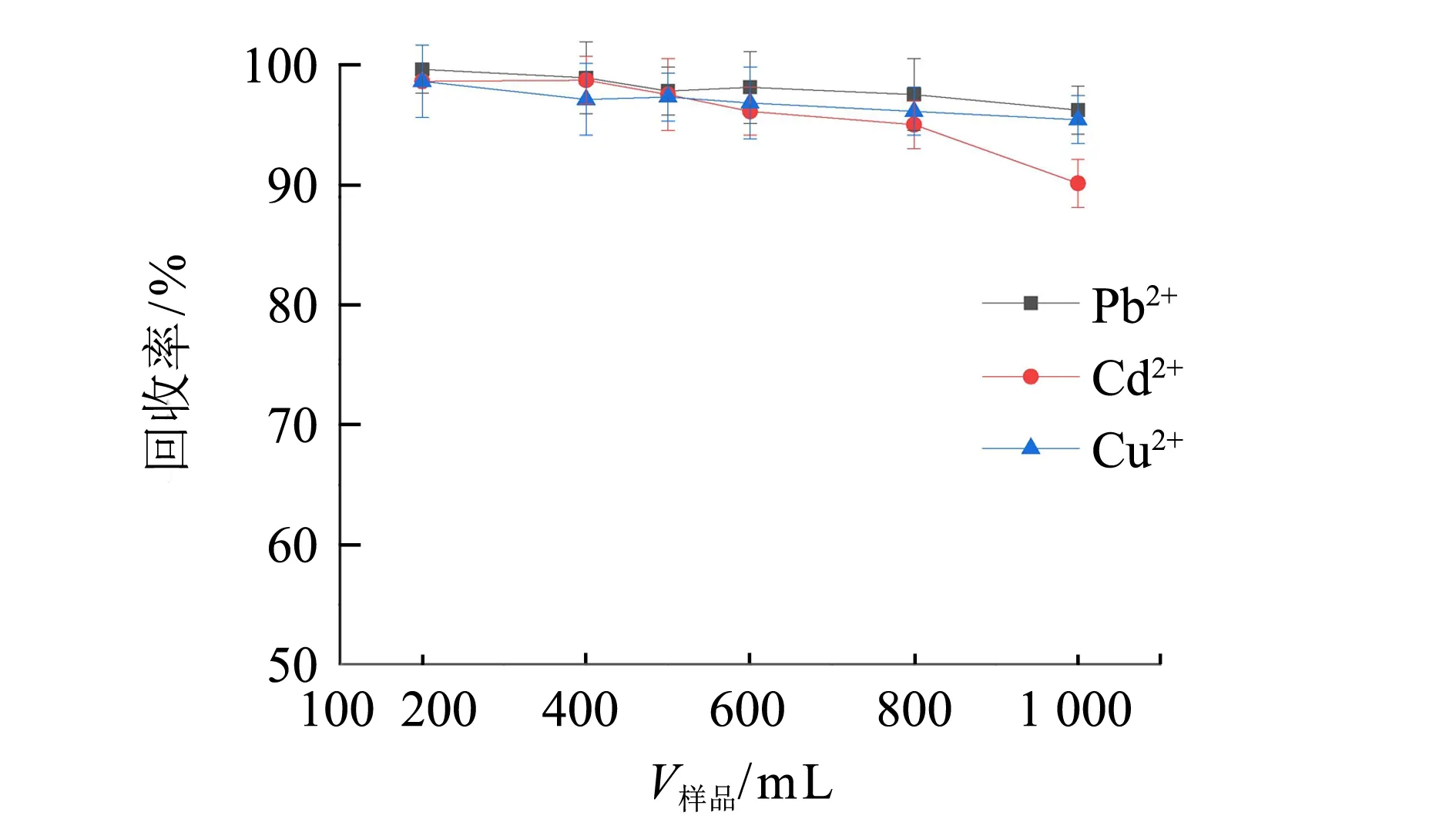
(b) 樣品溶液體積的影響
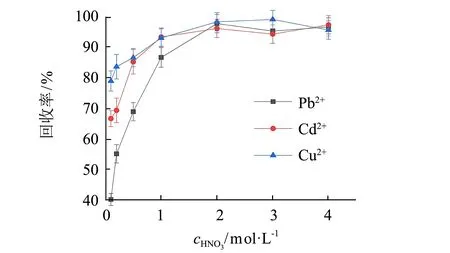
(c) HNO3濃度的影響

(d) HNO3體積的影響
2.2 光譜多元校正分析2.2.1 可見光譜加和性
多金屬離子體系與PAR反應后的吸收光譜是由多個單一金屬離子-PAR絡合物的吸收光譜疊加而成,混合光譜代數和理論上A′ =A1+A2+…+An. 如圖2(a)所示,Cd(II)、Cu(II)和Pb(II)離子與PAR顯色反應,生成物的可見光吸收特征峰分別為490、508和527 nm(曲線1~3),三組分光譜的加和值A′與混合光譜(曲線4)吸光度A的差值在450~565 nm區間隨著吸收光譜波長的增大而降低(見圖2(b)),并在565 nm波長處兩者數值最為接近; 在560~680 nm以后兩者偏差急劇增大. 當(A-A′)/A<±10%,混合光譜測定值和代數和差值在10%范圍內,混合光譜在波長480~600 nm之間的吸光度與代數加和值一致性良好.
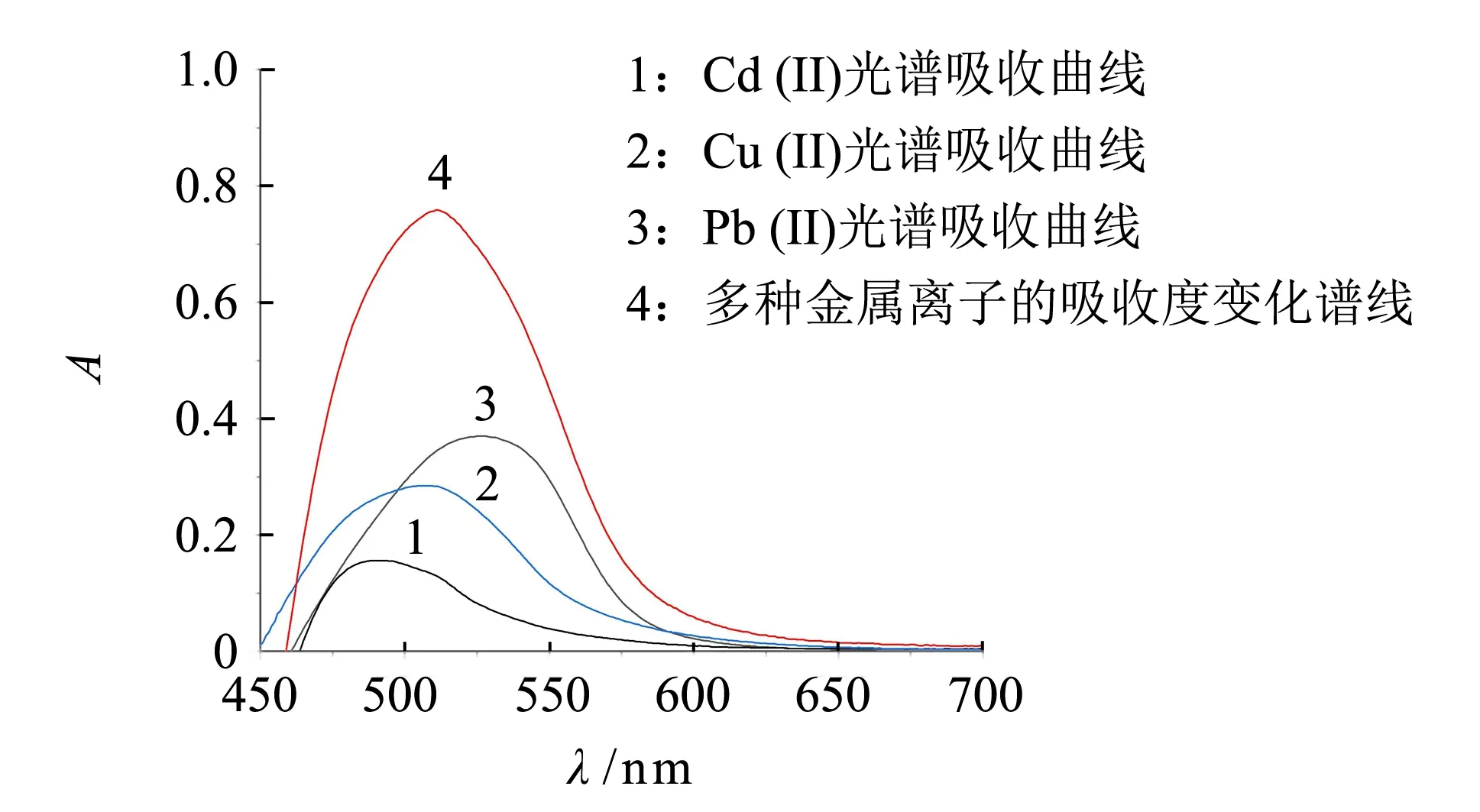
(a) 金屬離子吸收光譜
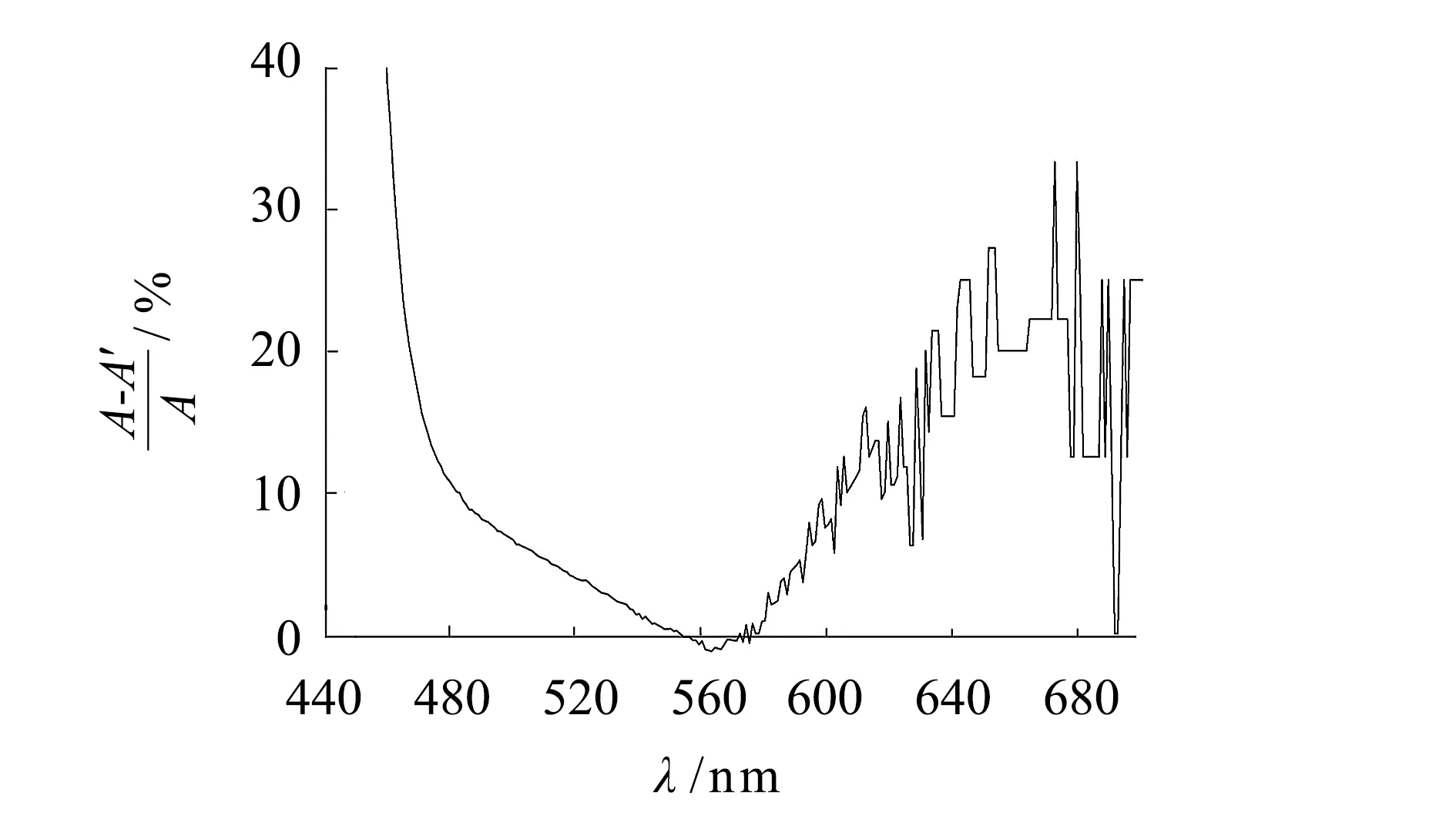
(b) 不同波長區間吸光度加和性變化曲線
2.2.2組分相關性分析
為減小混合體系中不同組分間的干擾,考察溶液pH值為3.5~9.0時不同組分在480~600 nm波段的吸收光譜,進行相關系數測算和相似度評價. 如圖3所示,在pH=8.0條件下,混合體系中任意兩組分之間的相關系數R(A, B)、R(A, C)和R(B, C)達到理想值,該條件下Cd(II)、Cu(II)和Pb(II)三者之間任意兩組分間的相關系數小,光譜吸收峰差異性大、特征性明顯,有利于預測模型的建立和準確識別.
2.2.3PLS模型建立及主成分數優化
基于偏最小二乘法PLS,采用正交表L25(53) 建立Pb(II)、Cd(II)和Cu(II)離子三組分分析模型,Pb(II)、Cd(II) 和Cu(II)3個組分分別在0.5~2.0、0.1~1.0和0.1~0.8 μg·mL-1區間選取5個質量濃度水平,在480~600 nm波長段對25組混合樣進行光譜掃描和數據采集,進行PLS計算. 采用預報殘差平方和PRESS對主成分數進行優化,如圖4所示. 當主成分數為3時,Pb(II)、Cd(II) 和Cu(II)組分的PRESS趨于平穩,多金屬混合物PLS分析模型的主成分數選擇為3.
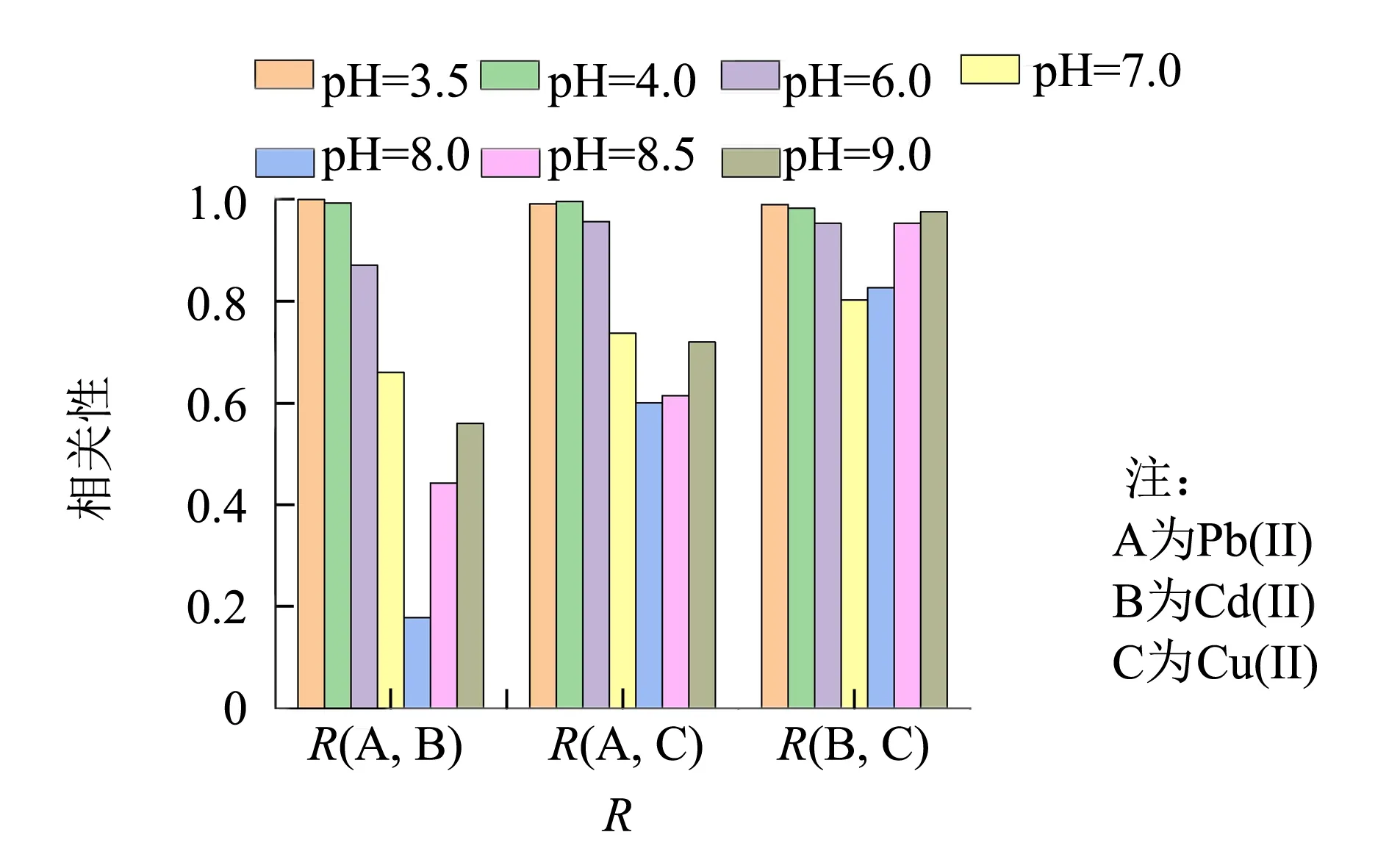
圖3 不同pH條件下的各組分之間的相關性系數Fig.3 Correlation coefficients between two components under different pH conditions
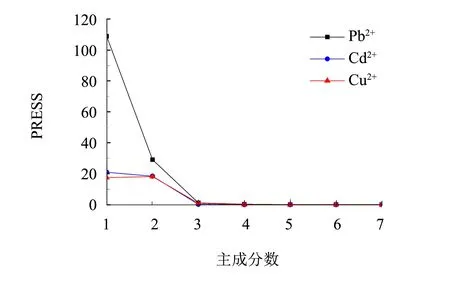
圖4 預報殘差平方和PRESS隨主成分數的變化曲線Fig.4 Variation curve for PRESS with principal component numbers
2.2.4模型預測性能和穩定性
應用所建立的PLS模型對Pb(II)、Cd(II) 和Cu(II)混合樣品進行運算,實際測算值與預測值之間的相對誤差RE,結果列于表1. Pb(II)、Cd(II)和Cu(II)的濃度預測誤差范圍分別為: -3.1%~7.1%、-7.8%~3.6%、-2.4%~11.2%,PLS模型預測性能良好.
為檢驗Pb(II)、Cd(II)和Cu(II)的PLS模型穩定性,實驗對預測數據進行連續100次的模擬計算運算,所建立的模型對Pb、Cd和Cu三組分預測穩定性良好,Pb(II)、Cd(II)和Cu(II)的質量濃度預測誤差范圍在-4.2%~3.1%、-7.7%~5.1%和-5.1%~14.3%.
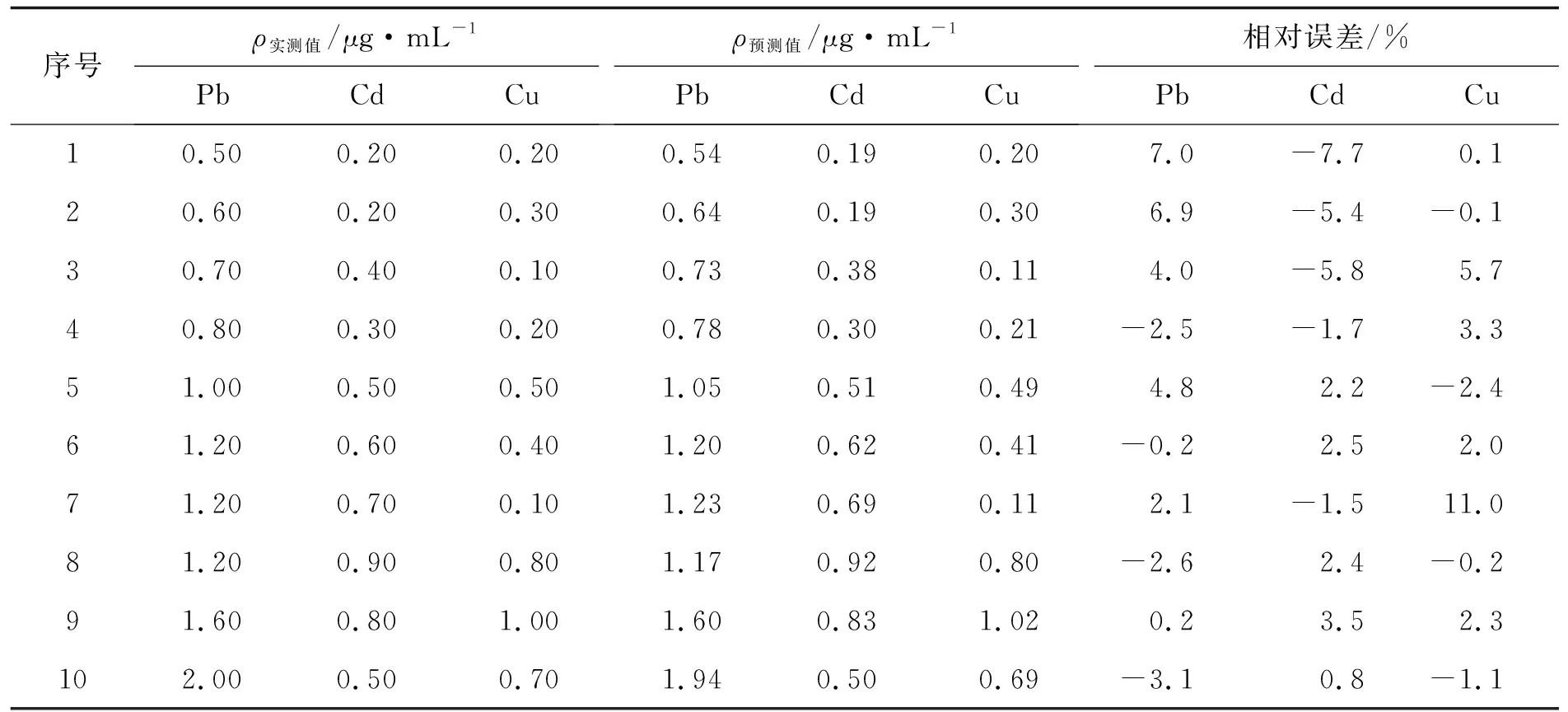
表1 模型預測性能的一次運算分析
2.2.4離子干擾分析
2.3 分析應用
在最優條件下,通過手控注射柱萃取、酸溶液進行洗脫和PLS分析測定,Pb、Cd、Cu的線性質量濃度范圍分別為0.50~20.00、0.10~5.00和0.10~3.00 μg·mL-1,線性系數R2分別為0.999 2、0.999 2及0.997 5,Pb、Cd和Cu的理論最低檢測限LOD (3倍的空白溶液測試標準偏差除以校正曲線斜率, 即3σ/k,再除以溶液的富集因子133) 分別達到0.6、0.2、0.2 ng·mL-1.
實驗開展樣品分析,通過在空白溶液中加入Pb、Cd和Cu金屬離子制備模擬樣品,Pb、Cd和Cu的質量濃度25~55、15~25和30~40 ng·mL-1,經手控注射萃取富集后,分別采用PLS與經典的火焰原子吸收FAAS方法進行分析,結果列于表2. 與FAAS技術比較,Pb、Cd和Cu的PLS測定結果相對誤差(RE)在-8.2%~1.8%,-2.0%~-12.9%和-1.5%~8.4%. 為進一步驗證該模型的適用性,采用PLS測定方法對兩種排水口水樣進行檢測分析,結果列于表3. 富集后水樣中Pb、Cd和Cu組分均能得到良好的檢測,檢測回收率為82.5%~112.5%,結果良好.
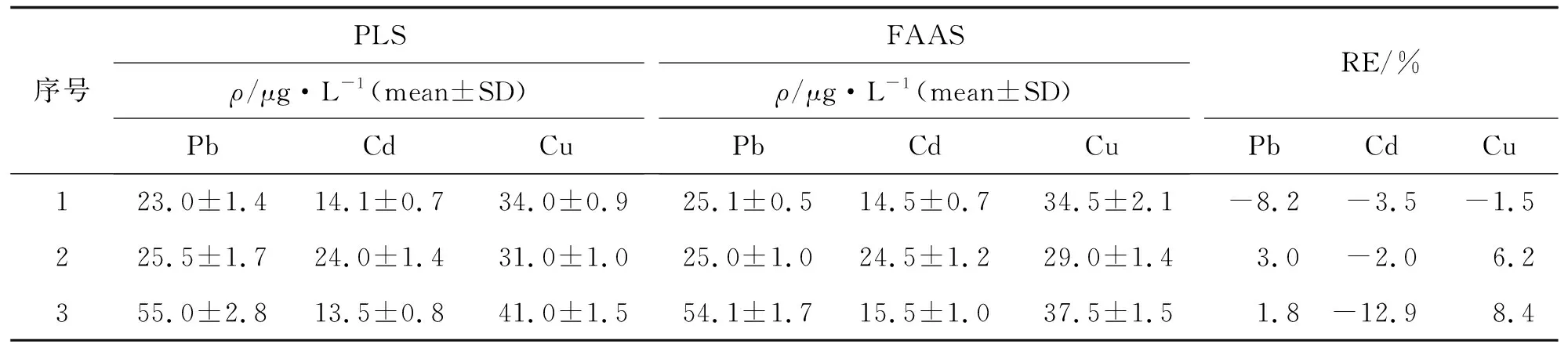
表2 模擬水樣中Pb、Cd和Cu組分的PLS與FAAS方法分析對比
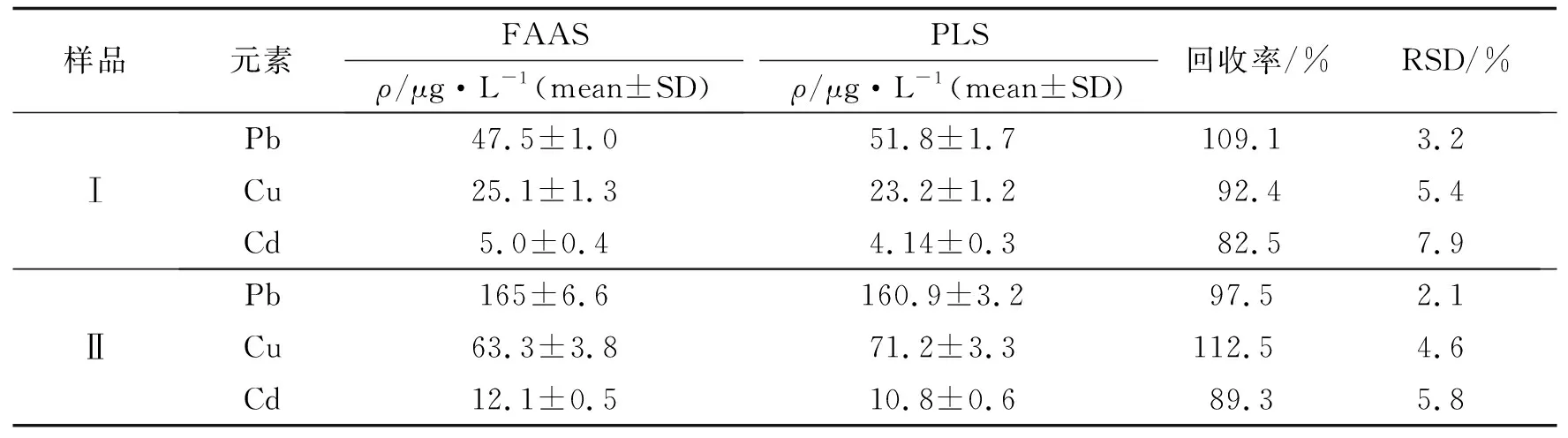
表3 水樣中Pb、Cd和Cu的測定分析
3 結語
針對水中痕量重金屬多組分快速同時測定的需求,本研究基于簡易的手控注射萃取和偏最小二乘方法PLS光譜分辨技術,建立快速萃取-可見光譜多元校正分析,實現痕量Pb(II)、Cd(II)和Cu(II)離子的同時測定. 在最佳條件下,Pb(II)、Cd(II)和Cu(II)離子可以實現同時測定,理論最低檢出限分別可達0.6、0.2和0.2 ng·mL-1; 水樣中痕量Pb、Cd和Cu富集后可以采用所建立的PLS模型有效識別,與FAAS法比較,測定結果偏差在-8.2%~1.8%,-2.0%~-12.9%和-1.5%~8.4%,水樣富集后Pb、Cd和Cu組分檢測回收率為82.5%~112.5%,結果良好.

