非肌層浸潤膀胱癌二次電切的臨床意義及腫瘤復發的危險因素分析
程柏松, 陳錦華, 陳劍暉, 周凱, 羅煒, 鄭松
膀胱癌是泌尿系統常見的惡性腫瘤之一,其發病率居全身惡性腫瘤的第10位,在男性居第6位,而死亡率居男性第9位[1]。2015年,我國膀胱癌發病率位居全身惡性腫瘤第13位,其中男性發病率8.83/100 000,位居第7位[2],嚴重威脅人類的生命和健康。非肌層浸潤膀胱癌(non-muscle invasive bladder cancer, NMIBC)是指腫瘤局限于黏膜(Ta、Tis)或黏膜下層(T1),約占膀胱癌的75%[3]。經尿道膀胱腫瘤電切術(transurethral resection of bladder tumor, TURBT)聯合術后膀胱灌注化療或免疫治療是NMIBC的主要治療方法,而TURBT存在腫瘤切除不徹底、病理分級和分期低估以及復發率高等不足。近年來,國內外相關指南推薦,針對部分NMIBC患者進行二次電切,以求徹底切除腫瘤并進行準確分期,從而降低復發率。本研究回顧性分析2013年5月—2020年3月接受二次電切的103例NMIBC患者的臨床資料以及術后初次復發時間,探討二次電切的臨床意義以及影響腫瘤復發的危險因素。
1 對象與方法
1.1 對象 103例中,男性81例,女性22例,年齡(61.9±11.5)歲(31~77歲),隨訪資料均完整。單發40例,多發63例;腫瘤大小(27.2±17.8) mm,直徑≥3 cm 50例,<3 cm 53例。根據國際抗癌聯盟(UICC)關于膀胱癌的TNM分期第8版進行分期,Ta期26例,T1期77例;病理分級采用WHO 2004分級標準,低級別19例,高級別84例。患者均行彩超、增強CT或MR檢查,均無上尿路積水及占位。
二次電切的適應證參考2014年《中國泌尿外科疾病診斷治療指南》:(1)首次電切不充分;(2)首次電切標本無肌層;(3)T1腫瘤;(4)G3(高級別)腫瘤,單純原位癌除外。
1.2 治療方法 患者均在全麻下取膀胱截石位,術前全面檢查膀胱,了解腫瘤的位置、數目、大小、是否有蒂、是否侵犯輸尿管口。如腫瘤靠近輸尿管口,則提前留置雙J管,以防術中輸尿管口損傷。切除范圍距腫瘤2 cm,深達肌層。腫瘤切除完畢,均于創面基底做多點活檢后電凝止血。術后均常規行即刻膀胱灌注化療及維持灌注化療(剔除采用卡介苗行膀胱灌注的病例),灌注藥物為吉西他濱或吡柔比星(均為指南推薦用藥)。二次電切時間(40.9±17.5)d(20~102 d);方法:先全面檢查膀胱各壁,再切除首次電切創面瘢痕至肌層。術后均行膀胱灌注化療,方法同首次電切術后。
1.3 統計學處理 數據采用Excel 2016錄入整理,采用SAS 9.1和SPSS 26.0軟件進行統計分析。患者按復發與否進行分組,兩組計量資料比較采用t檢驗,計數資料比較采用χ2檢驗和校正χ2檢驗,等級資料采用Ridit分析;對生存數據先進行Log-rank檢驗,后對相關指標進行COX逐步回歸分析,查找影響生存的相關因素。P<0.05為差別有統計學意義。
2 結 果
2.1 一般資料 手術均順利完成,未發生膀胱穿孔、嚴重出血等并發癥。首次電切標本不含肌層43例,含肌層60例;腫瘤切除后基底活檢陰性97例,陽性6例。二次電切無腫瘤殘留74例,腫瘤殘留29例,陽性率28.2%(29/103),其中Ta期陽性率23.1%(6/26),T1期29.9%(23/77);單發腫瘤陽性率30.2%(13/43),多發腫瘤26.7%(16/60)。29例殘留腫瘤病例均未發現肌層浸潤,其中Tis期1例,Ta期19例,T1期9例(其中2例首次電切為Ta期)。術后均予膀胱灌注化療,并定期行膀胱鏡檢查及彩超或CT檢查,直到腫瘤復發。截至2021年1月,共有18例復發,3例進展為肌層浸潤膀胱癌(行膀胱癌根治手術),15例仍為NMIBC(行TURBT手術)。
2.2 影響腫瘤復發的計數和計量指標 復發組與未復發組比較,在二次電切陽性與否、性別、分期、分級、肌層、基底活檢陽性與否、二次分級和二次分期分布均一致,差別無統計學意義(表1)。兩組患者的年齡、腫瘤大小、腫瘤數目和二次電切時間均相當,差別無統計學意義(表2)。
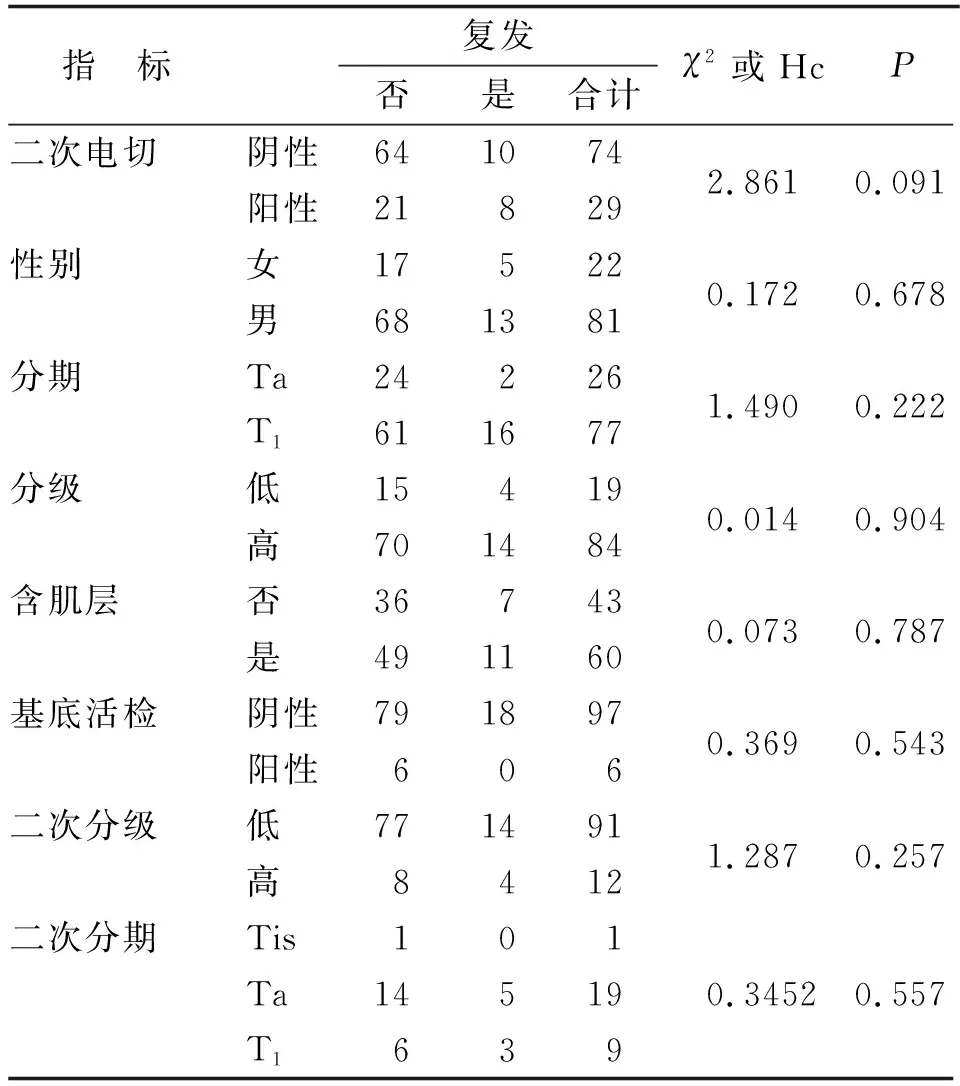
表1 各計數指標統計結果Tab.1 Statistical results of counting data
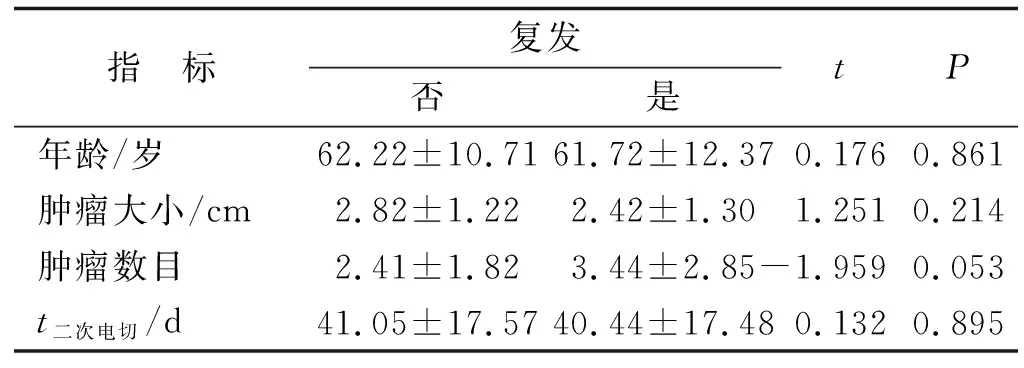
表2 各計量指標統計結果Tab.2 Statistical results of measurement data
2.3 影響腫瘤復發的多因素分析 在單因素分析的基礎上,對二次電切陽性與否、性別、分期、分級、肌層、基底活檢陽性與否、年齡、腫瘤大小、腫瘤數目和復發與否、復發時間等因素采用COX風險比例回歸模型的多因素分析。結果顯示,腫瘤數目與術后是否復發相關,提示腫瘤數目可能是復發的影響因素(表3)。將納入標準定為0.10,排除標準定為0.05,采用前進似然比法進行COX回歸分析,結果顯示,腫瘤數目是術后復發與否的獨立預后因素(RR=1.178)。
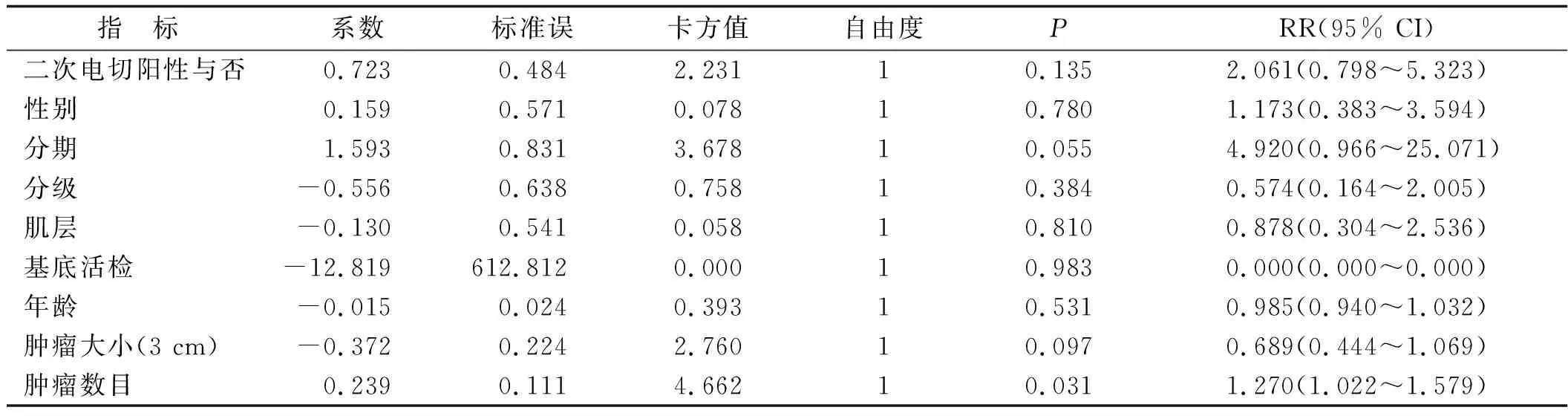
表3 自變量單變量分析的COX回歸分析結果Tab.3 Results of COX regression analysis of independent variable univariate analysis
二次電切陽性患者的病理分期屬于等級資料,采用Ridit分析,其余指標采用χ2檢驗或校正χ2檢驗。
3 討 論
TURBT聯合術后膀胱灌注化療是治療NMIBC 的重要方法,可切除肉眼可見的全部腫瘤,從而進行腫瘤浸潤深度和細胞分化程度等病理分析,具有創傷小、手術時間短以及術后恢復快等特點,但術后腫瘤殘留、易復發的缺陷,仍長期困擾著泌尿外科醫生和患者。部分患者初次電切術后3個月復查膀胱鏡即發現新發腫瘤,原因主要是TURBT手術時,膀胱頂壁、前壁及頸部等盲區容易漏檢腫瘤,另外,手術時需要切碎腫瘤導致扁平的原位癌檢出率降低,而切碎腫瘤過程中出血造成視野模糊也會影響術者對腫瘤邊緣和基底的判斷[4]。
文獻報道,首次電切術后腫瘤殘留率為4%~78%,與腫瘤的分期和數目相關[5-6]。1999年,HERR[7]首次報道了對150例NMIBC患者行二次電切手術,發現76%患者有腫瘤殘留。KAMIYA 等[8]對198例高級別NMIBC患者進行二次電切手術,發現87例(44%)腫瘤殘留,且T1期腫瘤術后殘留率比Ta期高;另外,5例(3%)初次電切為T1期的患者,二次電切術后病理升為T2期并接受了膀胱癌根治手術。在另一個前瞻性研究中,DIVRIK等[9]發現,腫瘤殘留率與腫瘤數目、大小相關,單發腫瘤殘留率為22.6%,多發腫瘤則高達44.2%;直徑<3 cm的腫瘤殘留率為18.9%,>3 cm的為42%。本組病例二次電切陽性率28.2%,其中Ta期 23.1%,T1期29.9%;單發腫瘤30.2%,多發腫瘤26.7%;2例初次電切為Ta期的病例,二次電切后升為T1期;未發現肌層浸潤的腫瘤。可見二次電切可及時切除首次電切后殘留的腫瘤,有效降低因腫瘤殘留造成的復發。
目前,二次電切的手術時機尚未統一。KIM等[10]認為,符合適應證的患者術后立即行二次電切手術,有助于確認腫瘤是否侵犯肌層,并能減少腫瘤的復發率。而BISHR等[11]則認為,二次電切的時間可延長至術后3個月。一般認為,初次電切術后過早進行二次電切術,膀胱內創面的壞死組織及黏膜炎癥水腫常常會影響術者對可疑病灶的判斷;間隔時間過長則會影響后期的膀胱灌注治療,腫瘤的復發率和進展率也會升高[12-13]。因此,國內外指南均建議,在初次電切術后2~6周內施行二次電切。本組病例二次電切的平均時間為6~7周,統計學分析顯示二次電切的時間與術后是否復發無關。
多數研究認為,腫瘤數目以及病理分期、分級與腫瘤的復發和進展相關,二次電切可以最大限度清除腫瘤殘留,降低腫瘤復發和進展。ALLARD等[14]對333例NMIBC患者的臨床病理特征進行分析并建立預后模型,結果提示,不良病理因素(腫瘤多發、直徑>3 cm、T1期以及高分級)與腫瘤的預后相關,不良病理因素≥3個的患者24個月無復發生存率僅為19%,而無不良病理因素的患者則高達69%。DIVRIK等[9]報道,NMIBC患者單次電切組的復發率高達70%,而二次電切組則為40%,認為二次電切通過有效切除殘留的腫瘤,顯著降低了腫瘤復發率。多因素分析提示,多發腫瘤和高分級是影響腫瘤復發的危險因素,而腫瘤的大小不影響復發。GRIMM等[15]報道,NMIBC患者行二次電切,術后5 a無復發生存率為63%,而未行二次電切的患者僅為40%,認為二次電切有助于提高NMIBC患者的無復發生存時間,降低復發率。楊誠等[16]報道,二次電切組的無復發生存期及無進展生存期均優于單次電切組,認為二次電切是影響NMIBC復發和進展的獨立危險因素。陳冠球等[17]發現,二次電切病理陽性者的無復發生存時間較陰性者短,認為二次電切陽性是腫瘤復發的危險因素。本組病例復發率為17.5%,統計學分析顯示,腫瘤的數目是影響腫瘤復發的唯一危險因素,而二次電切結果、腫瘤的分級、分期及大小對復發無影響。可能與回顧性資料納入的病例存在偏倚、樣本量小有關;另外,本組病例收集時間跨度7 a,手術醫生比較多,可能也是一個影響因素。
綜上所述,對于首次電切腫瘤分期為T1、高級別腫瘤、腫瘤直徑≥3 cm或多發的NMIBC患者,在術后一段時間內實施二次電切手術,有助于及時清除殘留的腫瘤,從而降低腫瘤的復發率。統計學分析提示,膀胱多發腫瘤是影響NMIBC復發的危險因素,對臨床診療及判斷預后有一定指導意義。本研究為小樣本的回顧性資料,納入研究的患者局限于單中心且隨訪數據完整的患者,有待將來開展設計合理的前瞻性、多中心的隨機對照研究以減少偏倚,進一步驗證研究結果。

