紅棗多糖涂膜協同冰溫貯藏對杏果實采后品質的影響
布麗根·加冷別克,馬愛霞,任建業,范利君,胡曉東,李學文,王偉
(新疆農業大學 食品科學與藥學學院,新疆 烏魯木齊,830052)
吊干杏在我國主要分布于新疆、甘肅、河北等地[1]。其中新疆是我國乃至世界吊干杏的主產區,吊干杏作為新疆的特色品種杏,其風味獨特,營養豐富,深受廣大消費者的喜愛[2-3]。但是由于吊干杏屬于呼吸躍變型果實,其采收期主要集中在6月中旬至7月中旬,易出現快速腐爛、貯藏期短等問題[1],嚴重制約了新疆鮮食吊干杏的產業發展。因此,如何延長吊干杏果實貯藏期、已成為吊干杏貯藏保鮮領域亟待解決的問題。
冰溫貯藏是指將果蔬貯藏在0 ℃以下至接近冰點的溫度范圍內,屬于非凍結保存,是繼普通冷藏、氣調貯藏后發展起來的第三代保鮮技術[4],其優點在于可抑制細胞的呼吸代謝,延緩組織的衰老速度,抑制微生物的生長繁殖,進而達到提高果蔬耐貯性的目的[5]。目前該技術已在櫻桃[6],杏[7],西蘭花[8],蘋果[9],香梨[10]等果蔬的貯藏保鮮上得到了應用。
植物多糖綠色無毒,成膜性良好,具有廣譜抑菌性等生物活性,現已成為國內外保鮮領域的研究熱點[11-13]。冀曉龍等[14]研究發現紅棗多糖不僅易溶于水,而且具有良好的抑菌活性,但其在果蔬貯藏保鮮當中的應用研究未見報道。因此,本試驗以吊干杏為原料,首先測定其冰點溫度,然后分別在冷藏(4~6 ℃)、紅棗多糖涂膜(4~6 ℃)、冰溫(-1.5~-1 ℃)及紅棗多糖涂膜結合冰溫(-1.5~-1 ℃)條件下貯藏,每隔7 d取樣,測定吊干杏果實腐爛率、失重率、硬度、可溶性固形物(soluble solids content,SSC)、可滴定酸(titratable acid,TA)、維生素C含量、丙二醛(malondialdehyde,MDA)含量和細胞膜透性的變化,研究紅棗多糖協同冰溫貯藏吊干杏的可行性,為探討紅棗多糖協同冰溫貯藏在吊干杏采后貯藏保鮮中的應用提供一定參考依據。
1 材料與方法
1.1 材料與試劑
吊干杏于2020年7月21日采購于新疆烏魯木齊市九鼎農貿市場,選取成熟度中熟果實[硬度為20.13 N,SSC質量分數為(18.1±0.2)%],挑選大小色澤均勻,無病害,無機械損傷的果實進行試驗。
紅棗多糖,實驗室自制;氫氧化鈉、鄰苯二甲酸氫鉀、碳酸氫鈉、草酸,天津市致遠化學試劑有限公司;抗壞血酸,上海山蒲化工有限公司;2,6-二氯酚靛酚鈉鹽,上海源葉生物科技有限公司:三氯乙酸、硫代巴比妥酸,上海科豐實業有限公司;以上試劑均為分析純。
1.2 儀器與設備
RC-4溫度記錄儀,江蘇精創電氣股份有限公司;GY-4果實硬度計,樂清市艾德堡儀器有限公司;PAL-1數字式糖度計,日本Atago(愛拓)公司;賽多利斯BSA分析天平,賽多利斯科學儀器(北京)有限公司;MAPADA PV4紫外風光光度計,上海美普達儀器有限公司;DDS-307型電導率儀,杭州齊威儀器有限公司。
1.3 實驗方法
1.3.1 紅棗多糖的制備
參考曹澤虹等[15]的方法。稱取1 g干燥去核紅棗粉樣品,采用液料比40 mL/g,提取溫度90 ℃、提取時間4 h及提取次數1次在恒溫水浴鍋進行熱水浸提,浸提液在4 000 r/min,離心10 min取上清液,50 ℃減壓濃縮至1/8原體積,加入4倍體積95%(體積分數)乙醇后置于4 ℃冰箱過夜,5 000 r/min,離心15 min取沉淀冷凍干燥即為紅棗多糖。
1.3.2 樣品預處理方法
將挑選好的吊干杏果實5 kg為1筐,放入(4~6) ℃、相對濕度90%~95%的冷庫中預冷24 h,以散去潛熱。預冷后的果實用1 g/L次氯酸鈉溶液浸泡清洗1 min 進行表面消毒,室溫條件下晾干。消毒后的吊干杏果實隨機分為4組,每組設3個重復,每個處理20 kg。1組為冷藏組(蒸餾水浸泡3 min),貯藏溫度為4~6 ℃;2組為紅棗多糖冷藏組(1.5 g/L紅棗多糖浸泡3 min),貯藏溫度為4~6 ℃;3組為冰溫組(蒸餾水浸泡3 min),貯藏溫度為-1~-1.5 ℃;4組為紅棗多糖協同冰溫組(1.5 g/L紅棗多糖浸泡3 min),貯藏溫度為-1~-1.5 ℃。貯藏期間,每隔7 d測定各指標,當杏果實腐爛率超過40%后終止實驗。
1.3.3 吊干杏果實冰點測定
參考李亞玲等[16]的方法,采用精創RC-4溫度記錄儀測定吊干杏的冰點。
1.3.4 腐爛率測定
腐爛率的測定參考白國榮等[1]的方法,單位:%.
1.3.5 失重率測定
采用稱重法測定失重率,單位:%。
1.3.6 硬度測定
硬度的測定采用李亞玲等[17]的方法,單位:N。
1.3.7 SSC含量測定
每個處理組隨機選取15枚果實,去核研磨呈勻漿,用濾紙過濾,取濾液滴于PAL-1數顯糖度計上讀數,重復3次,單位:%。
1.3.8 TA含量測定
參考曹建康等[18]的方法測定,采用酸堿中和法,單位:%。
1.3.9 維生素C含量測定
參考曹建康等[18]的方法測定,采用2,6-二氯酚靛酚滴定法,單位:mg/100g。
1.3.10 MDA含量的測定
MDA含量參考ZHANG等[19]的方法測定,單位:nmol/g。
1.3.11 細胞膜透性的測定
細胞膜膜透性的測定參照ZHANG等[20]的方法測定,單位:%。
1.4 數據處理
采用Origin 9.1繪圖軟件作圖;采用SPPS 19.0軟件對數據進行方差分析,P<0.05表示差異顯著,P<0.01表示差異極顯著。
2 結果與分析
2.1 吊干杏冰點溫度測定
由圖1可知,吊干杏果實的溫度先隨著時間的延長而不斷下降,下降至-6.7 ℃后迅速回升至-2 ℃,并維持一段時間,造成該現象的原因是吊干杏果實在凍結前釋放出潛熱,回升后的溫度即為吊干杏的生物結冰點。由于在實際貯藏中冷庫存在0.5 ℃的溫度波動差,為避免發生凍害現象,故在本實驗中將吊干杏的冰溫貯藏溫度選為-1.5~-1 ℃。
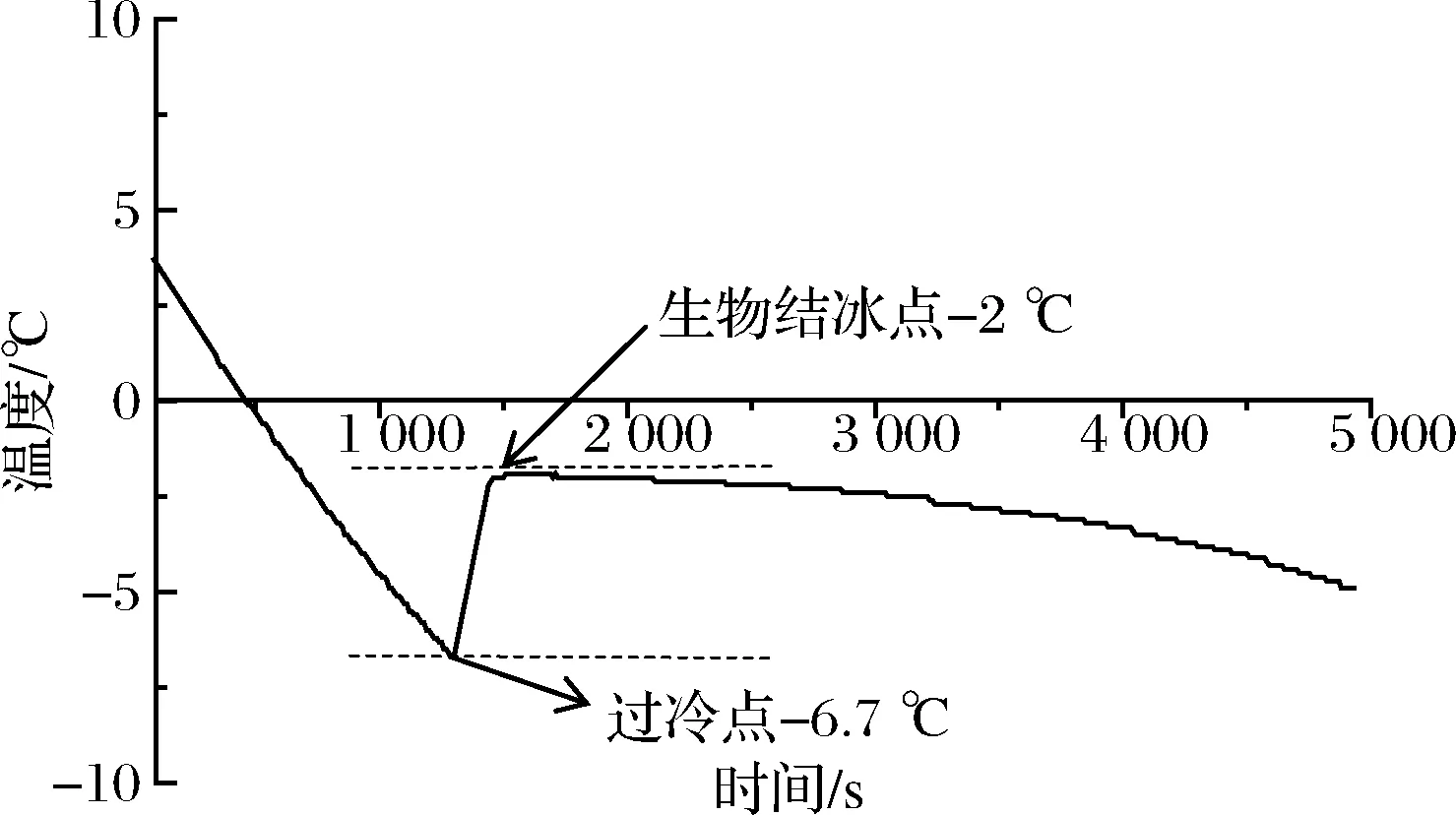
圖1 吊干杏冰點曲線Fig.1 Freezing point curve of Diaogan apricot fruit
2.2 紅棗多糖協同冰溫貯藏對吊干杏腐爛率的影響
腐爛率是評價杏果貯藏品質的關鍵指標之一。由圖2可知,各處理組吊干杏果實的腐爛率隨著貯藏時間的延長呈上升趨勢。其中冷藏組和紅棗多糖冷藏組杏果的腐爛率從第21天開始迅速上升,在貯藏49 d時分別達到了49.33%和42%。冰溫組和紅棗多糖協同冰溫組則在第28天才開始出現腐爛,比4~6 ℃下貯藏的2組推遲了21 d。貯藏49 d時,冰溫組和紅棗多糖協同冰溫組的腐爛率分別為10.33%和6%,比冷藏組分別低79.06%和87.84%(P<0.01)。說明冰溫和紅棗多糖協同冰溫貯藏均可明顯抑制吊干杏果實腐爛率的上升,并能延遲果實腐爛時間,其中紅棗多糖協同冰溫貯藏效果相比于冰溫組更佳(P<0.05)。

圖2 不同處理對吊干杏腐爛率的影響Fig.2 Effect of different treatments on the decay incidence of Diaogan apricots
2.3 紅棗多糖協同冰溫貯藏對吊干杏失重率的影響
由圖3可知,各組吊干杏果實的失重率隨貯藏時間的延長而呈上升趨勢。在-1.5~-1 ℃條件下貯藏的2組杏果實在前21 d失重率差異不顯著(P>0.05),但與冷藏組相比差異均極為顯著(P<0.01)。在貯藏21 d后,4~6 ℃下貯藏的2組果實失重率迅速增加,而-1.5~-1 ℃下貯藏的2組果實則緩慢上升,失重率顯著低于4~6 ℃下的2個處理組(P<0.01)。在貯藏35 d時,冷藏組的失重率達到了13.31%,而冰溫組和紅棗多糖協同冰溫組則在貯藏70 d時才分別達到13.24%和11.06%。由此可說明冰溫貯藏和紅棗多糖協同冰溫貯藏相比于普通冷藏均能延緩吊干杏果實失重率的上升,其中紅棗多糖協同冰溫貯藏效果最佳。
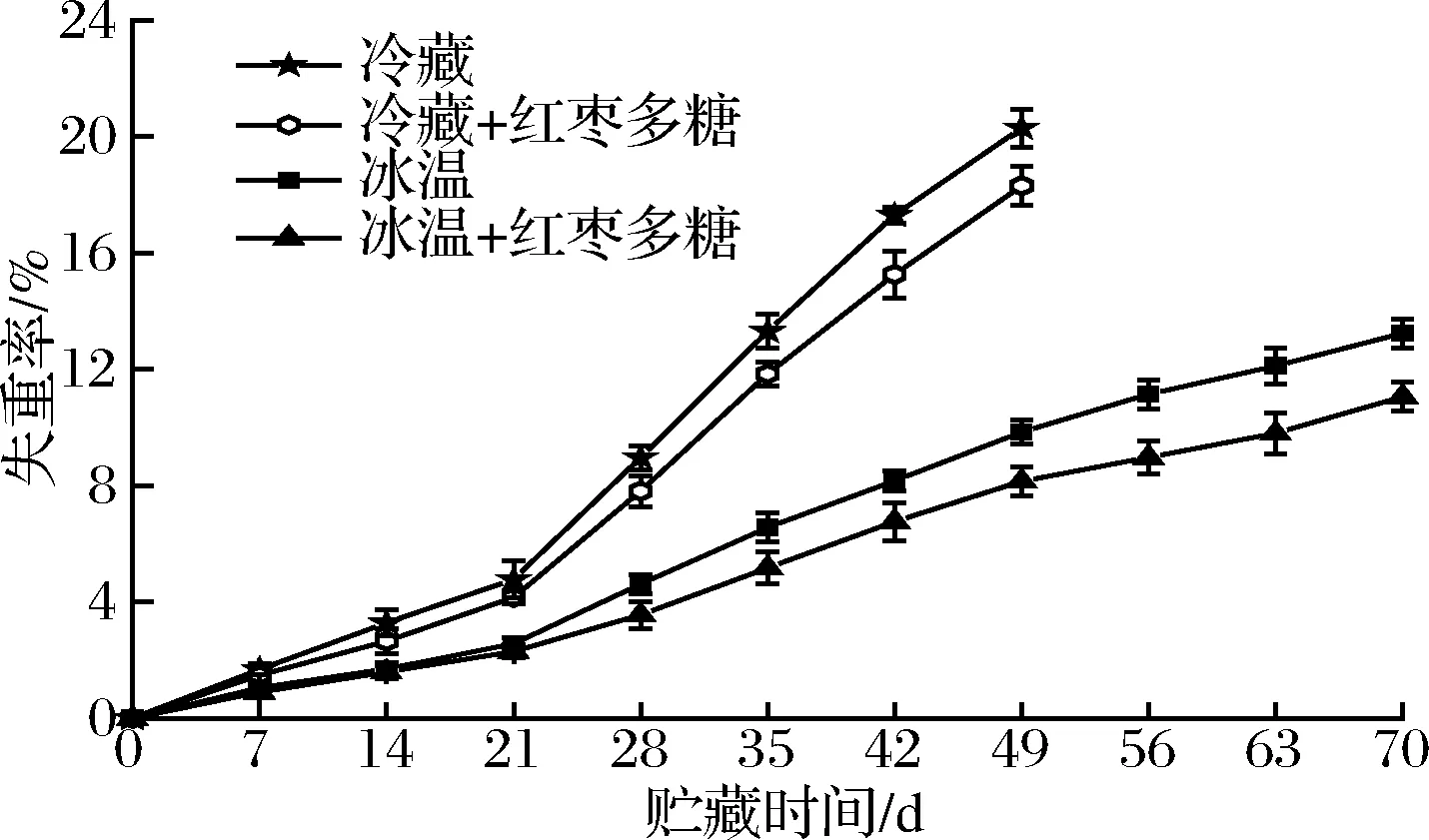
圖3 不同處理對吊干杏失重率的影響Fig.3 Effect of different treatments on weight loss of Diaogan apricots
2.4 紅棗多糖協同冰溫貯藏對吊干杏硬度的影響
硬度是評價果實貯藏品質的重要指標之一。由圖4可知,各處理組吊干杏果實的硬度在貯藏期總體呈下降趨勢,但是紅棗多糖協同冰溫組和冰溫組果實的硬度始終顯著高于4~6 ℃下貯藏的2樣品組(P<0.05)。在貯藏49 d時,冷藏組的果實硬度下降至8.82 N,而冰溫組和紅棗多糖協同冰溫組貯藏的果實硬度分別為15.31 N和16.47 N,分別比冷藏組高42.39%和46.45%(P<0.01)。由此可以說明,紅棗多糖協同冰溫貯藏的吊干杏果實硬度下降最為緩慢,能夠更好地保持果實較好的質地。

圖4 不同處理對吊干杏硬度的影響Fig.4 Effect of different treatments on hardness of Diaogan apricots
2.5 紅棗多糖協同近冰溫貯藏對吊干杏SSC含量的影響
SSC含量的高低是評價杏果貯藏品質和耐冷、耐貯性的重要指標之一。由圖5可知,各組吊干杏果實的SSC含量呈先上升后下降趨勢,在貯藏前14 d各處理組之間SSC含量差異不顯著(P>0.05)。在貯藏21 d時4~6 ℃下貯藏的2組果實SSC含量達到了峰值,隨后呈下降趨勢;而冰溫下貯藏的2組果實則推遲至28 d才達到峰值,并且在貯藏后期其SSC含量也顯著高于4~6 ℃下貯藏的2組果實。在貯藏49 d時,冷藏組SSC含量為17.57%,而冰溫和紅棗多糖協同冰溫貯藏的吊干杏果實的SSC含量分別為19.40%和20.37%,分別比冷藏組高9.43%和13.74%(P<0.01),說明冰溫和紅棗多糖協同冰溫貯藏均可減緩吊干杏果實SSC的消耗,推遲SSC高峰的出現時間,其中紅棗多糖協同冰溫貯藏效果最佳。

圖5 不同處理對吊干杏可溶性固形物含量的影響Fig.5 Effect of different treatments on soluble solid content of Diaogan apricots
2.6 紅棗多糖協同冰溫貯藏對吊干杏TA含量的影響
TA作為果實呼吸作用重要的底物之一,是衡量果實采后成熟衰老程度的重要指標。由圖6可知,隨著貯藏時間的延長,各組吊干杏果實中的TA含量呈下降趨勢。在貯藏14 d后各組之間的差異顯著(P<0.05)。其中冷藏組的TA含量下降最快,在貯藏49 d時其含量為0.35%,比貯藏開始時下降63.83%。而紅棗多糖冷藏組、冰溫組和紅棗多糖協同冰溫組的TA含量分別比貯藏開始時下降了53.19%、42.55%和36.17%。說明冰溫和紅棗多糖協同冰溫貯藏均可有效延緩吊干杏果實TA含量的下降,但是紅棗多糖協同冰溫貯藏相比于冰溫組效果更為顯著(P<0.05)。
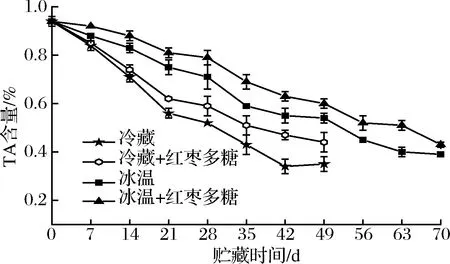
圖6 不同處理對吊干杏TA含量的影響Fig.6 Effect of different treatments on titratable acid content of Diaogan apricots
2.7 紅棗多糖協同冰溫貯藏對吊干杏維生素C含量的影響
維生素C不僅是果實中的重要營養物質,還具有抗氧化等生物活性,因此其含量的高低可作為評價果蔬采后貯藏品質的重要依據。由圖7可知,在整個貯藏期各處理組維生素C含量呈下降趨勢。紅棗多糖協同冰溫組和冰溫組維生素C含量的下降速率顯著(P<0.05)低于冷藏組和紅棗多糖冷藏組。與第0天相比,在貯藏28 d時冷藏組的維生素C含量下降了28.53%,而冰溫組和紅棗多糖協同冰溫組則在貯藏49 d時維生素C含量才分別下降了29.58%和23.56%。在貯藏70 d時,冰溫組與紅棗多糖協同冰溫組的維生素C含量分別為13.24和14.61 mg/100g(P<0.05),由此可說明紅棗多糖協同冰溫貯藏對抑制吊干杏果實維生素C含量的下降效果最為顯著,能夠更好地保持吊干杏果實的營養物質的損失。

圖7 不同處理對吊干杏維生素C含量的影響Fig.7 Effect of different treatments on vitamin C content of Diaogan apricots
2.8 紅棗多糖協同冰溫貯藏對吊干杏MDA含量的影響
MDA作為細胞膜脂質過氧化的主要產物之一,其含量越多,意味著細胞氧化程度越深,可用來評價貯藏期果實的氧化程度[21]。由圖8可知,各處理組果實的MDA含量隨著貯藏時間的延長而不斷積累。在貯藏前7 d各處理組的MDA含量差異不顯著(P>0.05)。在貯藏7 d后紅棗多糖協同冰溫組和冰溫組的MDA含量始終低于冷藏組和紅棗多糖冷藏組,而且紅棗多糖協同冰溫貯藏對抑制MDA含量的積累,降低脂質過氧化反應效果更優(P<0.05)。

圖8 不同處理對吊干杏MDA含量的影響Fig.8 Effect of different treatments on MDA content of Diaogan apricots
2.9 紅棗多糖協同冰溫貯藏對吊干杏細胞膜透性的影響
細胞膜由于可維持果實微環境的穩定性,進而對果實內各生化反應的正常進行起關鍵作用[22]。細胞膜透性能反映植物細胞膜受破壞和果蔬成熟軟化程度。由圖9可知,各處理組吊干杏果實的細胞膜透性隨著貯藏時間的延長而不斷上升。冰溫組和紅棗多糖協同冰溫組在貯藏70 d時細胞膜透性分別為65.72%和63.62%,而冷藏組在貯藏35 d時就達到了65.78%,紅棗多糖冷藏組細胞膜透性則在42 d時達到了65.62%,由此說明紅棗多糖協同冰溫貯藏對延緩吊干杏果實細胞膜透性的增加,保持細胞膜透性的完整性具有較好的效果(P<0.05)。
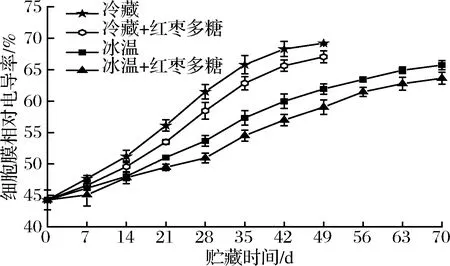
圖9 不同處理對吊干杏細胞膜的影響Fig.9 Effects of different treatments on cell membrane of Diaogan apricots
3 討論與結論
果蔬采后仍然是具有生命活性的有機體,在采后貯藏階段仍進行著一系列的新陳代謝活動,以維持自身的生命體征[23],冰溫貯藏技術能夠最大程度地抑制果蔬的呼吸作用、微生物的生長以及各種代謝進程[24]。植物多糖含有羥基、羰基、氨基等親水性基團,其中分子間氫鍵和分子內氫鍵起到了重要的作用,它們將會使天然高分子協同作用增強,形成具有多孔網絡結構的薄膜[25]。這種穩定的網狀結構通過改變果蔬表面形態和降低透氧率、水蒸氣透過率、減少其呼吸作用、延緩內部營養物質的消耗,抑制微生物的繁殖等方式來提高果蔬采后貯藏品質、延長耐貯性和貨架期。本研究表明,與冷藏組相比,紅棗多糖冷藏組、冰溫組及紅棗多糖協同冰溫組均有效延緩了吊干杏果實腐爛率、失重率、MDA含量以及細胞膜透性的增加,有效抑制了硬度、SSC、TA、維生素C含量的下降,其中紅棗多糖協同冰溫組在貯藏70 d后仍能夠保持吊干杏果實較好的品質,其貯藏效果最優。
洪理杰等[26]的結果表明,苦蕎粗多糖涂膜可有效抑制櫻桃果實采后失重率的升高,延緩硬度、SSC、TA含量以及維生素C含量的下降,同時抑制霉菌等微生物的繁殖。本研究結果亦表明,1.5 g/L的紅棗多糖協同冰溫貯藏處理可明顯抑制吊干杏果實貯藏期硬度、SSC、TA、維生素C含量的下降,延緩腐爛率和失重率的增加、抑制MDA的積累。紅棗多糖制取工藝簡單,綠色無毒,可以作為一種較好的杏果保鮮劑。

