桃糖轉運蛋白基因PpTST2的功能初探
王寧,孟祥光,文濱濱,和華杰,陳修德*,李玲*
桃糖轉運蛋白基因的功能初探
王寧1,2,3,孟祥光1,2,3,文濱濱1,2,3,和華杰1,2,3,陳修德1,2,3*,李玲1,2,3*
1. 山東農業大學園藝科學與工程學院, 山東 泰安 271018 2. 作物生物學國家重點實驗室, 山東 泰安 271018 3. 山東省果蔬優質高效協同創新中心, 山東 泰安 271018
桃糖轉運蛋白基因在液泡膜糖轉運過程中具有重要作用。本文以桃品種 ‘2014-9-34’ 為材料,克隆,并對其進行生物信息學分析及轉基因蘋果愈傷功能鑒定。結果顯示,的cDNA序列總長為2 220 bp,編碼740個氨基酸,預測其編碼蛋白質分子量為78.91 kDa,等電點為4.8,啟動子序列分析發現其具有干旱脅迫、激素響應、光反應和糖響應等多種順式作用元件,基因的表達明顯受ABA的誘導,在‘王林’愈傷組織中過表達可以提高可溶性糖含量。酵母單雜實驗表明轉錄因子PpABRE1能夠激活的表達。
桃; 轉運蛋白; 基因表達
糖在植物生長發育過程中起著重要作用。風味是影響果實品質的關鍵因素之一,其主要取決于可溶性糖和有機酸含量[1,2]。糖還參與調節多種信號途徑轉導和基因表達等[3,4]。
液泡糖轉運蛋白(TSTs)最初叫液泡單糖轉運蛋白(TMTs),AtTMT1、AtTMT2是擬南芥中最早被發現,具有葡萄糖、果糖轉運能力的轉運蛋白,且基因在鹽、干旱和寒冷等環境脅迫下顯著上調[5]。在甜菜中第一次發現可以將蔗糖轉運到液泡內[6]。因此將TMTs更名為TSTs[6]。
TSTs在多種植物的糖積累中都有研究。在擬南芥中單糖轉運蛋白AtTST1活性的增加改變了擬南芥中細胞糖的分配、糖信號轉導和種子產量[7]。梨轉入酵母EBY.VW4 000后,可以在低濃度的果糖、蔗糖、山梨醇培養基中生長,在轉基因番茄中果糖和葡萄糖含量顯著提高,蔗糖含量無明顯變化,使轉基因番茄比野生型提早開花、成熟[8]。、可以轉運果糖和蔗糖[9]。沉默后葡萄糖的含量顯著降低,在ABA處理下,抵消了ABA誘導的葡萄糖含量增加[10]。介導了突變體酵母細胞在葡萄糖和果糖以及半乳糖和木糖培養基中的生長[11,12]。黃瓜在酵母中的功能分析表明,它能夠轉運半乳糖、甘露糖和蔗糖[13]。在水稻液泡葡萄糖儲存中發揮了作用,但和在寒冷、鹽或干旱情況下表達無變化[14]。在草莓和黃瓜中過表達增加了葡萄糖、果糖、蔗糖的含量,且在高糖甜瓜品種果實中的表達量顯著高于低糖品種[15]。在調控西瓜葡萄糖、果糖、蔗糖含量發揮重要作用[16]。在甜高粱中,和的表達量顯著高于谷物高粱[17]。在柑橘中在果實成熟期顯著上調[18]。
最近在桃中發現了一個基因家族中和糖含量相關的基因,位于控制水果蔗糖含量的QTL區域,且位于果實酸度定位區間[19-21]。基因的第三個外顯子存在一個非同義的G/T單核苷酸多態性(SNP),的G和T等位基因分別命名為和[19]。我們將基因轉入蘋果愈傷中,對基因的功能進一步挖掘。
1 材料和方法
1.1 實驗材料
試驗材料為山桃()蘋果‘王林’的愈傷組織。桃幼苗由山桃種子成熟以后,于30株生長良好的桃樹中隨機采集400個果實,去除果肉,收集種子,最后用尼龍袋與沙子混合,層積于山東農業大學科技創新園。來年春天播種在穴盤中,放置于光照培養箱,23 ℃,16 h/8 h光暗周期下培養1周,選取長勢一致的幼苗使用。蘋果‘王林’愈傷組織平均兩周繼代1次,平鋪于加入1.6 mg/L 2,4-D和0.4 mg/L 6-BA的MS固態培養基中,放置在25 ℃的恒溫培養箱中暗培養。
1.2 ‘王林’蘋果愈傷組織的轉化
以‘2014-9-34’油桃cDNA為材料擴增,構建過表達載體pRI101- PpTST2。將構建的過表達載體導入GV3101農桿菌感受態,得到重組農桿菌侵染‘王林’蘋果愈傷。
轉基因蘋果愈傷鑒定:
(1)PCR擴增鑒定轉基因植株以待驗證植株的DNA為模板,使用Taq酶進行PCR擴增實驗,1%瓊脂糖凝膠電泳實驗檢測擴增片段與目的基因大小是否一致。
(2)qRT-PCR鑒定轉基因植株
提取待檢測植株的RNA,反轉錄為cDNA,qRT-PCR檢測目的基因在各株系與野生型中的表達量。
1.3 總RNA的提取與熒光定量
用RNA提取試劑盒(天根,DP432)提取RNA后,然后用反轉錄試劑盒(KR106)得cDNA,按照SYBR?Green PCR Master Mix說明書配制熒光定量PCR反應體系,采用2–ΔΔCT方法對數據分析。
1.4 生物信息學分析
ExPASy網站ProtParam在線軟件(http://web.expasy.org/protparam/)預測PpTST2蛋白大小,利用(http://bioinformatics.psb.ugent.be/webtooLs/pLantcare/htmL/)網址分析啟動子的順式作用元件。
1.5 蘋果愈傷糖含量的測定
蘋果愈傷還原性糖和可溶性總糖測定方法,參考李合生[22]實驗植物生理生化實驗原理和技術。

表1 本實驗所用引物序列
1.6 酵母單雜實驗
將目的基因啟動子片段連接pAbAi表達載體,構建pBait-AbAi質粒,使用1191限制性內切酶線性化pBait-AbAi,將線性化的質粒轉入Y1H Gold酵母感受態細胞,涂布SD/-Ura培養基。選取陽性克隆的菌株,用無菌的ddH2O將酵母濃度調整為OD600約為0.002,將稀釋后的菌液涂布于含有不同AbA濃度的SD/-Ura固體培養基,確定誘餌菌株的AbA最小抑制濃度。構建PpABREs-pGADT7載體質粒,和已構建pBait-AbAi質粒共同轉入Y1H Gold酵母感受態,涂布SD/-Leu-Ura培養基和含有最小抑制濃度的SD/-Leu-Ura培養基,30 ℃倒置培養3~5 d。
1.7 雙熒光素酶成像試驗
將下游基因的啟動子序列連接到pGreenⅡ 0800-LUC載體,將的編碼序列連接到pGreenⅡ0029 62-SK載體,將重組質粒分別轉入GV3101(pSoup-p19)農桿菌感受態細胞。將農桿菌活化混合后注射煙草葉片,注射完的煙草暗培養1 d后轉入光照培養,2~3 d后,在煙草葉片背面涂抹D-蟲熒光素鈉鹽溶液,使用活體成像系統(美國,精諾真)觀察拍照。
1.8 數據分析
熒光定量數據用Excel 2019軟件數據處理,用GraphPad 6軟件進行作圖;用SPSS 26軟件進行顯著性相關分析。
2 實驗結果
2.1 PpTST2_G基因的克隆
如圖1所示獲得了一條2 000 bp長度的條帶,基因測序結果顯示:基因編碼區長度為2 220 bp。蛋白預測大小為78.91 kDa左右,氨基酸等電點pI:4.8。

圖 1 PpTST2_G基因擴增結果
2.2 PpTST2_G的進化樹分析及蛋白序列比對
圖2顯示和在同一個分支上,但圖3氨基酸相似度分析,和的相似度為70.39%,大于和的相似度63.70%,因此()在擬南芥中的同源基因是。
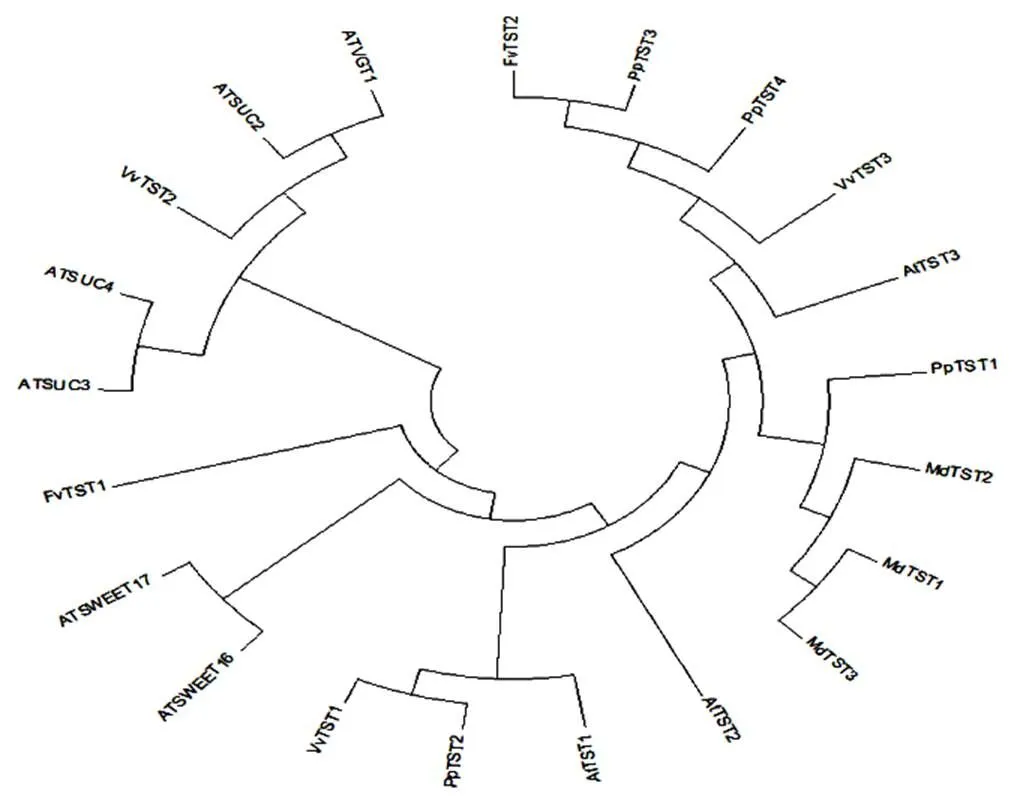
圖2 PpTST2_G基因進化樹分析
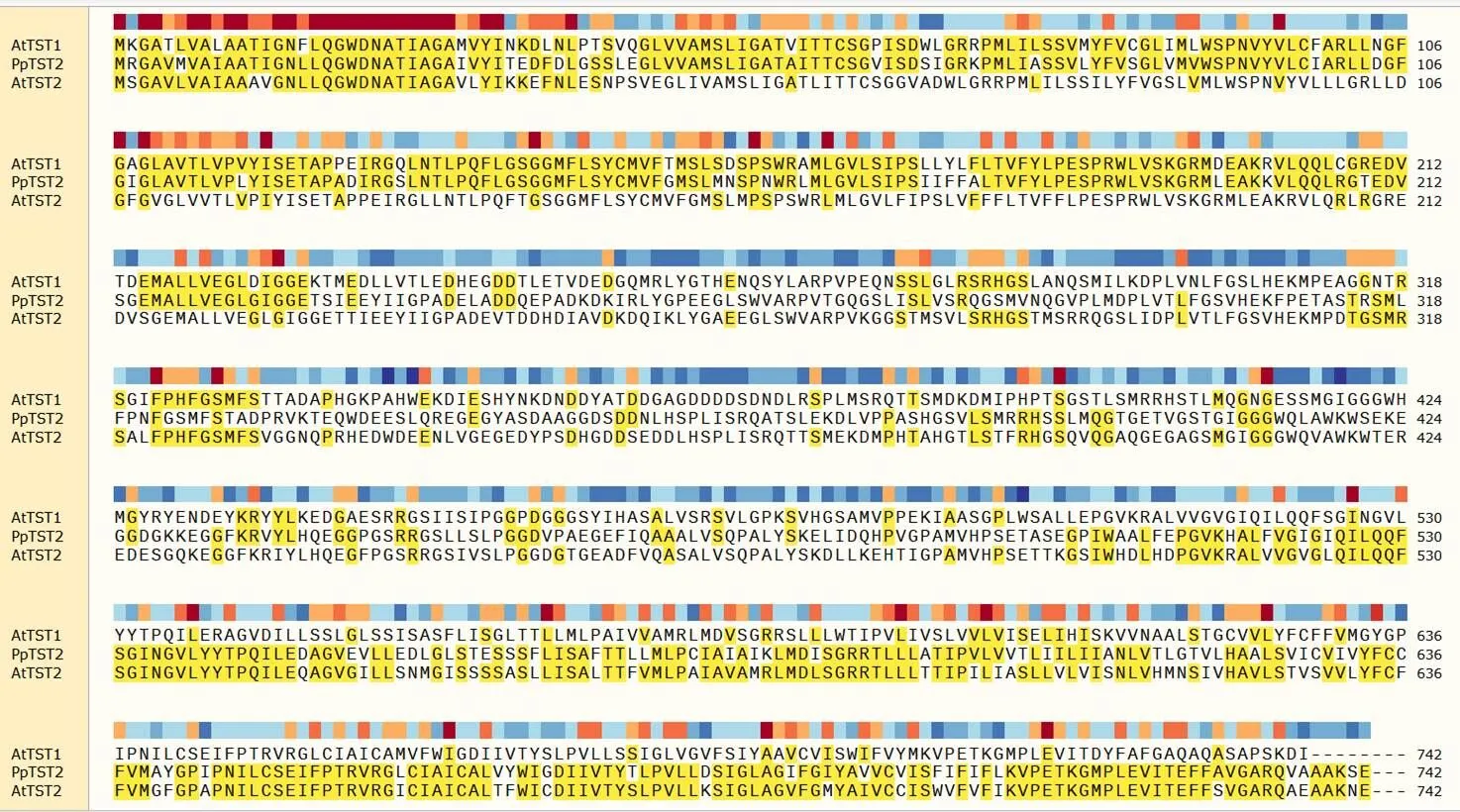
圖 3 PpTST2_G與AtTST1、AtTST2氨基酸序列比對
2.3 啟動子序列分析及非生物脅迫分析
用PlantCARE在線軟件進行分析發現了一些順式作用元件[23]:CPBCSPOR是細胞分裂素響應元件[24];SREATMSD是與糖信號相關的元件[25]。

表 2 PpTST2基因啟動子序列順式作用元件分析
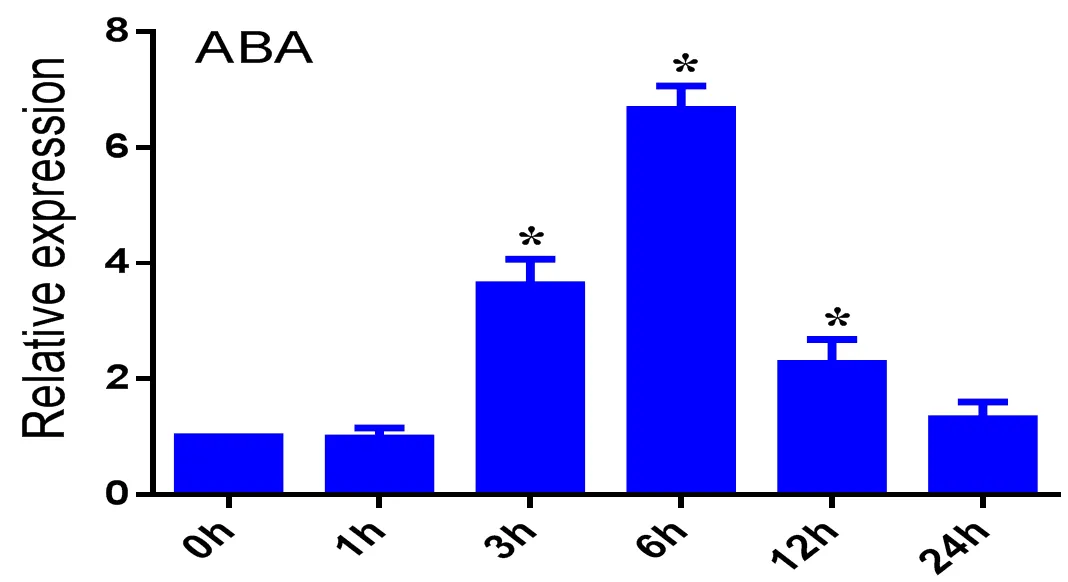
圖 4 PpTST2響應ABA信號
注:誤差條代表三個生物學重復的標準誤差(SE),*:< 0.05,下同。
Note: The error bar represents the standard error (SE) of the three biological replications, *:< 0.05, similarly below
2.4 PpTST2_G在‘王林’愈傷組織中過表達分析
我們擴增了基因,并將其轉化進蘋果愈傷,還原性糖和和可溶性糖含量都顯著提高。還原性糖含量由8.24 mg·g-1上升為12.79 mg·g-1、14.45 mg·g-1,可溶性糖由17.42 mg·g-1上升為20.06 mg·g-1,23.45 mg·g-1。
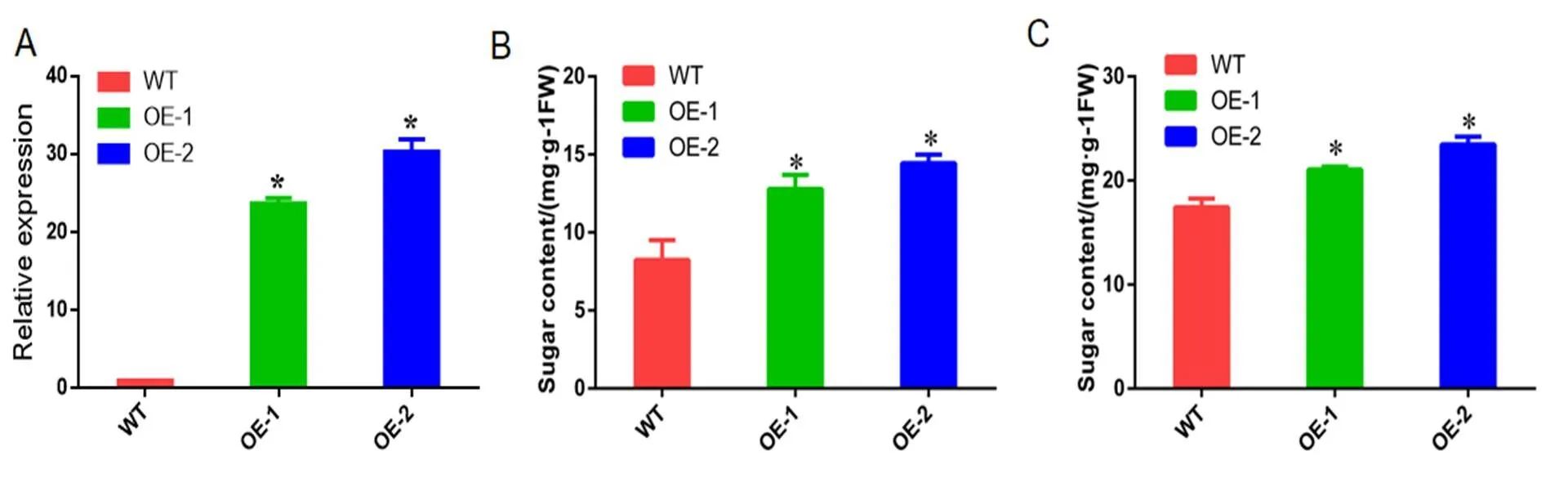
圖 5 轉基因蘋果愈傷和野生型糖含量比較
(A)轉基因蘋果愈傷表達量分析(B)還原性糖含量 (C)可溶性總糖含量
(A) Analysis ofexpression in transgenic apple callus (B) Reducing sugar content. (C) Total soluble sugar content
2.5 PpABRE1激活基因PpTST2的表達
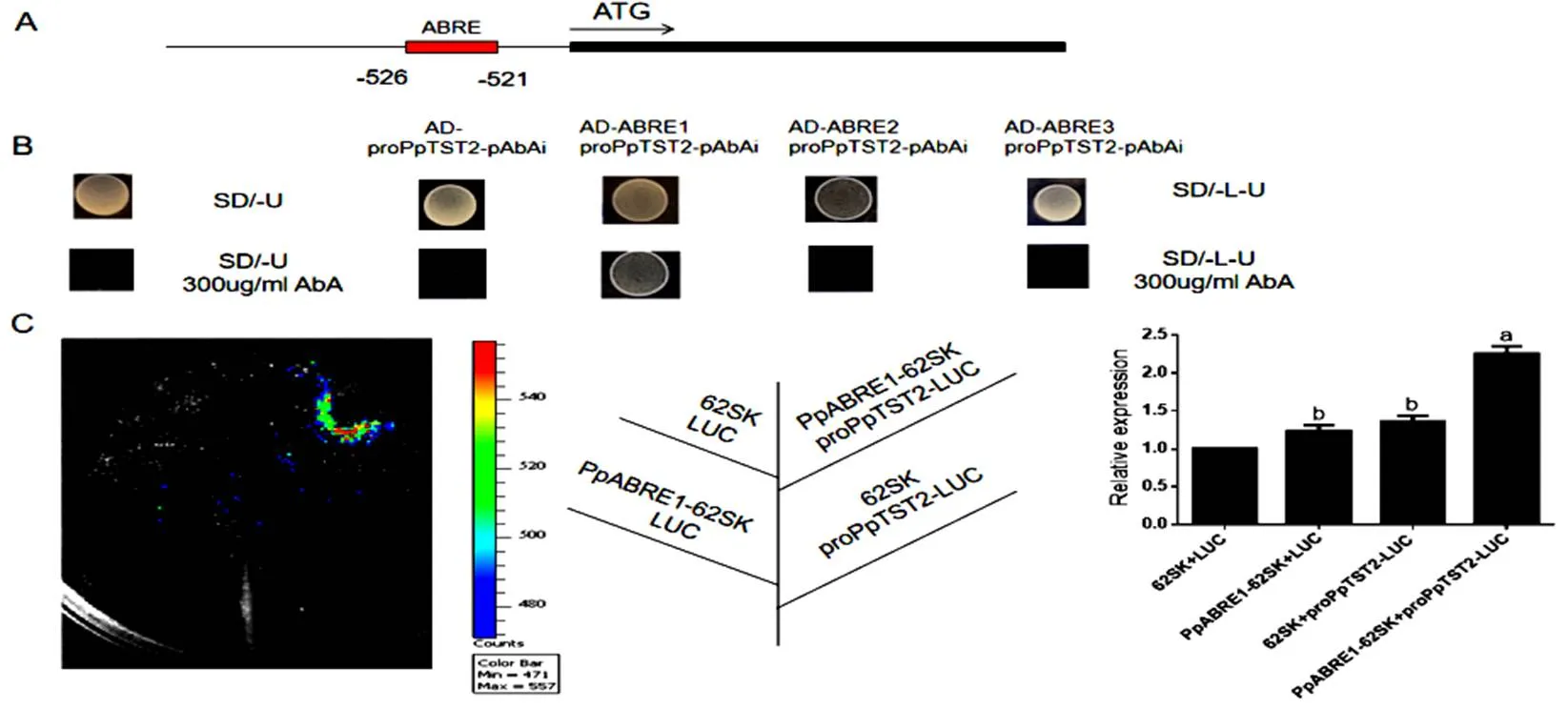
圖 6 PpABRE1激活PpTST2的表達
(A) CGTG元件在基因序列中的位置(B)酵母單雜驗證PpABRE1可以結合的啟動子(C)PpABRE1激活的表達
(A) The position of the CGTG element in thegene sequence; (B) Yeast single hybrid verification that PpABRE1 can bind to the promoter of; (C) PpABRE1 activates the expression of
圖4表達分析表明受ABA誘導,此外通過啟動子分析,含有ABA響應元件ABRE。因此我們擴增了包含CTGCAC總長為50 bp的啟動子序列,隨后又擴增了序列號為、、三個基因家族的序列,分別命名為、、,只有AD-- proPpTST2-pAbAi在-L-U+300AbA的培養基上生長,而AD-- proPpTST2-pAbAi、AD-- proPpTST2-pAbAi在SD/L-U+300 AbA的培養基上被抑制不能生長(圖6 B)。雙熒光素實驗證明PpABRE1能夠激活的表達(圖6 C)。
3 討 論
通常情況下,液泡積累大量的還原糖,大約占到植物游離己糖的90%,僅有少量的己糖存在于細胞質中,植物液泡占據了細胞體積的90%,并通過膜屏障與周圍的細胞成分分離。液泡中的組分通常包括各種糖、多醇、有機酸、氨基酸以及離子[7,26-28]。糖類作為能量物質和信號分子對植物的生長發育和非生物脅迫都有影響[29-32],糖還具有提高植物的抗病能力[33,34]。
和是第一批在擬南芥中發現的具有葡萄糖轉運能力的基因[35],這兩個基因都屬于協助擴散超家族(MFS),所有的TST蛋白都具有一個獨特的大約320個氨基酸的中心結構域[5,6,36]。在擬南芥中,和均以三種亞型存在,基因功能的缺失會導致開花延遲;和在大多數植物組織中都有發現,而基因很少表達,可能不參與AtTSTs介導的液泡糖轉運,AtTSTs活性缺失影響植物在低溫下葡萄糖和果糖的積累[5,36]。活性決定著擬南芥種子的產量,在tDNA插入突變體中,種子脂質和蛋白質含量比野生型少10%左右,過表達種子脂質含量稍高[7]。活性與種子產量呈正相關很可能是由于過表達植株中細胞糖信號響應的改變[37]。由于過表達株系在細胞質中表現出更少的葡萄糖,導致光合作用基因的表達量更高[38]。此外,除了二氧化碳固定活性的增加外,過表達株系表現出呼吸速率降低和蔗糖轉運基因表達上調。這些變化使過表達株系能夠從葉片中輸出更多的光合產物,從而提高種子產量[38]。本實驗中我們得到的轉基因蘋果愈傷與前人研究結果相似,提高了轉基因植株的可溶性糖含量。
在互作因子激活AtTST1實驗中,前人發現蛋白激酶AtVIK1與AtTST1與互作,并磷酸化AtTST1,促進葡萄糖向液泡中轉運[38]。此外,溫度改變促進和的磷酸化[28]。前人通過酵母雙雜交實驗發現膜蛋白MdVGT1與MdTMT1互作[9],下一步可以使用膜系統雙雜技術手段進行篩庫,尋找PpTST2互作蛋白。
開花是植物從營養生長到生殖生長轉換的重要現象,在這一轉換期間, 蔗糖含量往往出現短期增加[39]。蔗糖是人們研究最多的與成花過程有關的可溶性糖,葡萄糖對植物生長的影響一般不同于蔗糖,葡萄糖主要影響幼苗的生長、光合作用、淀粉降解和衰老,而蔗糖與成熟的關系更為密切,如開花過程和貯藏器官的發育[40]。種子的發育也由蔗糖控制[8]。提高內源性蔗糖水平也能提高番茄的開花效果[41]。梨的在番茄中過表達后,轉基因番茄比WT番茄提早開花2-3周[8,42]。
前人研究發現和的啟動子序列中都含有CACGTC核心序列,實驗證明MdABRE2特異性結合和的啟動子,但MdABRE1不特異性結合和[10],本實驗中基因結構與相似,也包含4個外顯子和3個內含子。此外,位于果實酸度定位區間[19-21],我們推測此基因和果實酸度有關。
4 結 論
(1)本實驗證明了促進蘋果愈傷中糖的積累;
(2)轉錄因子PpABRE1可以激活的表達。
[1] Predieri S, Ragazzini P, Rondelli R. Sensory evaluation and peach fruit quality [J]. Acta Horticulture, 2006,713:429-434
[2] Stadler R, Truernit E, Gahrtz M,. The AtSUC1 sucrose carrier may represent the osmotic driving force for anther dehiscence and pollen tube growth in Arabidopsis [J]. The Plant Journal, 1999,19(3):269-278
[3] Koch KE Carbohydrate-modulated gene expression in plants [J]. Annu Rev Plant Physiol Plant Mol Biol, 1996,47(1):509-540
[4] Smeekens S, Rook SF. Sugar sensing and sugar-mediated signal transduction in plants [J]. Plant Physiology and Biochemistry, 1997,115(1):7-13
[5] Wormit A, Trentmann O, Feifer I,. Molecular identification and physiological characterization of a novel monosaccharide transporter from Arabidopsis involved in vacuolar sugar transport [J]. Plant Cell, 2006,18(12):3476-3490
[6] Jung B, Ludewig F, Schulz A,. Identification of the transporter responsible for sucrose accumulation in sugar beet taproots [J]. Nat Plants, 2015,1(1):14001
[7] Wingenter K, Schulz A, Wormit A,. Increased activity of the vacuolar monosaccharide transporter TMT1 alters cellular sugar partitioning, sugar signaling, and seed yield in Arabidopsis [J]. Plant Physiol, 2010,154(2):665-677
[8] Cheng R, Cheng Y, Lu J,. The gene PbTMT4 from pear () mediates vacuolar sugar transport and strongly affects sugar accumulation in fruit [J]. Physiol Plant, 2018,164(3):307-319
[9] Ma XL, Qin Y, Wei XY,. Sequence and expression analysis of apple tonoplast monosaccharide transporter TMT genes and their relationship with sugar accumulation in fruit [J]. Acta Horticulturae Sinica, 2014,41(7):1317-1325
[10] Ma QJ, Sun MH, Lu J,Transcription factor AREB2 is involved in soluble sugar accumulation by activating sugar transporter and amylase genes [J]. Plant Physiol, 2017,174(4):2348-2362
[11] Zeng L, Wang Z, Vainstein A,. Cloning, localization, and expression analysis of a new tonoplast monosaccharide transporter fromL. [J]. Journal of Plant Growth Regulation, 2010,30(2):199-212
[12] Afoufa-Bastien D, Medici A, Jeauffre J,. The Vitis vinifera sugar transporter gene family: phylogenetic overview and macroarray expression profiling [J]. BMC Plant Biol, 2010,10(1):245
[13] Huang W, Hu B, Liu J,. Identification and characterization of tonoplast sugar transporter (tst) gene family in cucumber [J]. Horticultural Plant Journal, 2020,6(3):145-157
[14] Cho JI, Burla B, Lee DW,. Expression analysis and functional characterization of the monosaccharide transporters, OsTMTs, involving vacuolar sugar transport in rice () [J]. New Phytol, 2010,186(3):657-68
[15] Cheng J, Wen S, Xiao S,. Overexpression of the tonoplast sugar transporter CmTST2 in melon fruit increases sugar accumulation [J]. J Exp Bot, 2018,69(3):511-523
[16] Ren Y, Guo S, Zhang J,. A tonoplast sugar transporter underlies a sugar accumulation QTL in Watermelon [J]. Plant Physiol, 2018,176(1):836-850
[17] Bihmidine S, Julius BT, Dweikat I,. Tonoplast Sugar Transporters (SbTSTs) putatively control sucrose accumulation in sweet sorghum stems [J]. Plant Signal Behav, 2016,11(1):e1117721
[18] Zheng QM, Tang Z, Xu Q,. Isolation, phylogenetic relationship and expression profiling of sugar transporter genes in sweet orange () [J]. Plant Cell, Tissue and Organ Culture, 2014,119(3):609-624
[19] Peng Q, Wang L, Ogutu C,. Functional analysis reveals the regulatory role of PpTST1 encoding tonoplast sugar transporter in sugar accumulation of peach fruit [J]. Int J Mol Sci, 2020,21(3):1112
[20] Dirlewanger E, Moing A, Rothan C,. Mapping QTLs controlling fruit quality in peach ((L.) Batsch) [J]. Theoretical and Applied Genetics, 1999,98(1):18-31
[21] Etienne C, Rothan C, Moing A,. Candidate genes and QTLs for sugar and organic acid content in peach [(L.) [J]. Batsch], Theor Appl Genet, 2002,105(1):145-159
[22] 李合生.植物生理生化實驗原理和技術[M].北京:高等教育出版社,2000
[23] Lescot M, Déhais P, Thijs G,. PlantCARE, a database of plant cis-acting regulatory elements and a portal to tools for in silico analysis of promoter sequences [J]. Nucleic Acids Research, 2002,30(1):325-327
[24] Fusada N, Masuda T, Kuroda H,. Identification of a novel cis-element exhibiting cytokinin-dependent protein binding in vitro in the 5'-region of NADPH-protochlorophyllide oxidoreductase gene in cucumber [J]. Plant Mol Biol, 2005,59(4):631-645
[25] Tatematsu K, Ward S, Leyser O,. Identification of cis-elements that regulate gene expression during initiation of axillary bud outgrowth in Arabidopsis [J]. Plant Physiol, 2005,138(2):757-766
[26] Whiteman SA, Serazetdinova L, Jones AM,. Identification of novel proteins and phosphorylation sites in a tonoplast enriched membrane fraction of Arabidopsis thaliana [J]. Proteomics, 2008,8(17):3536-3547
[27] Carter C, Pan S, Zouhar J,. The vegetative vacuole proteome of Arabidopsis thaliana reveals predicted and unexpected proteins [J]. Plant Cell, 2004,16(12):3285-3303
[28] Schulze WX, Schneider T, Starck S,. Cold acclimation induces changes in Arabidopsis tonoplast protein abundance and activity and alters phosphorylation of tonoplast monosaccharide transporters [J]. Plant Journal, 2012,69(3):529-541
[29] Ohto MA, Onai K, Furukawa Y,. Effects of sugar on vegetative development and floral transition in Arabidopsis [J]. Plant Physiology, 2001,127(1):252-261
[30] Eveland AL, Jackson DP. Sugars, signalling, and plant development [J]. J Exp Bot, 2012,63(9):3367-3377
[31] Lastdrager J, Hanson J, Smeekens S. Sugar signals and the control of plant growth and development [J]. J Exp Bot, 2014,65(3):799-807
[32] Sheen J. Master regulators in plant glucose signaling networks [J]. J Plant Biol, 2014,57(2):67-79
[33] Otazu V. Soft rot susceptibility of potatoes with high seducing Sugar Content [J]. Phytopathology, 1981,71(3):290-295
[34] Conrath U, Linke C, Jeblick W,. Enhanced resistance to Phytophthora infestans and Alternaria solani in leaves and tubers, respectively, of potato plants with decreased activity of the plastidic ATP/ADP transporter [J]. Planta, 2003,217(1):75-83
[35] Aluri S, Büttner M. Identification and functional expression of the Arabidopsis thaliana vacuolar glucose transporter 1 and its role in seed germination and flowering [J]. Plant J, 2007,104(7):2537-2542
[36] Hedrich R, Sauer N, Neuhaus HE. Sugar transport across the plant vacuolar membrane: nature and regulation of carrier proteins [J]. Curr Opin Plant Biol, 2015,25(1):63-70
[37] Wingenter K, Trentmann O, Winschuh I,A member of the mitogen-activated protein 3-kinase family is involved in the regulation of plant vacuolar glucose uptake [J]. Plant J, 2011,68(5):890-900
[38] Cho LH, Pasriga R, Yoon J,. Roles of Sugars in Controlling Flowering Time [J]. Journal of Plant Biology, 2018,61(3):121-130
[39] Tognetti JA, Pontis HG. Martinez-Noel GM Sucrose signaling in plants: a world yet to be explored [J]. Plant Signal Behav, 2013,8(3):e23316
[40] Micallef BJ, Haskins KA, Vanderveer PJ,. Altered photosynthesis, flowering, and fruiting in transgenic tomato plants that have an increased capacity for sucrose synthesis [J]. Planta, 1995,196(2):327-334
[41] Cheng R, Zhang H, Cheng Y,. Bioinformatics analysis of tonoplast monosaccharide transporter (TMT) gene family in fruit trees of rosaceae [J]. Journal of Nanjing Agricultural University, 2017(4):601-610
Preliminary Study on the Function of Peach Sugar Transporter Gene
WANG Ning1,2,3, MENG Xiang-guang1,2,3, WEN Bin-bin1,2,3, HE Hua-jie1,2,3, CHEN Xiu-de1,2,3*, LI Ling1,2,3*
1.271018,2.271018,3.271018,
The sugar transporter gene() played an important role in tonoplast sugar transport in peach (). We clonedgene from the peach variety ‘2014-9-34’ and performed the bio-information analyses of the, and verified the functions ofby transforming 'Orin' calli (). The results showed that the full length of the cDNA sequence ofwas 2 220 bp, encoding 740 amino acids. The predicted molecular weight and isoelectric point of thewas 78.91 kDa and 4.8, respectively. Analysis of thepromoter sequence showed that it contained drought stress, hormone, light, and sugar response-elements. Additionally, experiment results showed that hormone ABA could significantly induce expression of thegene. Overexpression ofin 'Orin' calli increased the content of soluble sugar. Yeast single-hybrid experiments showed that the transcription factor PpABRE1 could activate the expression of.
peach; transporter; gene expression
S662.1
A
1000-2324(2022)02-0180-08
10.3969/j.issn.1000-2324.2022.02.002
2021-11-14
2022-01-28
國家重點研發計劃(2018YFD1000104);國家自然基金面上項目(31872041);山東省農業良種工程項目(2020LZGC007);山東省果品產業技術體系-栽培與土肥崗(SDAIT-06-04)
王寧(1997-),男,碩士在讀,主要從事果樹分子生物學及生理研究. E-mail:tonyparkerw@163.com
Author for correspondence. E-mail:chenxiude@163.com; lilingsdau@163.com

