過表達花生ABA途徑抗逆基因AhLOS5提高轉基因煙草的耐鹽性研究
武曉亮,焦娟,張連,張利民,張艷艷,趙瑞仝,李文金
(泰安市農業科學院,山東 泰安 271000)
目前我國土壤次生鹽漬化現象日趨嚴重,鹽堿地總面積3600萬hm2,其中鹽堿耕地920萬hm2[1]。選育耐鹽作物品種能夠有效開發并利用鹽堿地,提高資源利用率。
花生(Arachis hypogaeaL.)是我國單產、總產和出口創匯額最高的油料作物,對保障我國食用油供給安全、改善和提高我國城鄉居民營養水平具有重要意義。花生屬中等耐鹽作物,以其扎根深、能夠充分利用所吸收的少量水分、適應性強成為適應鹽堿旱薄地的優勢農作物[2]。在全球范圍內,70%的花生作物種植于相對鹽堿旱薄地區[3,4]。因此加強花生耐鹽性研究,發展鹽堿地花生生產,在提高鹽堿地區資源利用率方面具有重要作用。
脫落酸(abscisic acid,簡稱ABA)是高等植物中普遍存在的一種植物調節激素,具有促進葉片和果實脫落,促進芽休眠和抑制萌發,抑制生長、促進衰老等作用。Bueno等[5]最早在煙草中發現過氧化物酶(POD)的活性在ABA處理后明顯升高,緩解了過氧化氫對煙草植株的傷害。鹽脅迫下,ABA處理可通過減少玉米活性氧(ROS)的產生提高抗逆性[6]。2002年,研究人員發現ABA處理可通過提高植物體內抗氧化酶[超氧化物歧化酶(SOD)、谷胱甘肽還原酶(GR)和抗壞血酸過氧化物酶(APX)]的活性提高抗逆性[7]。目前ABA被公認為能夠誘導植物產生對不良環境的抗性,是植物的“抗逆誘導因子”。
ABA生物合成途徑的關鍵基因包括編碼玉米黃質環氧化酶的ZEP基因、編碼9-順式環氧類胡蘿卜素雙加氧酶的NCED基因和編碼鉬輔因子硫酸化酶的LOS5基因等[8-11]。Park等[8]在擬南芥中過表達AtZEP基因,鹽脅迫條件下轉基因植株生長更旺盛。Aswath等[12]將豇豆VuNCED1基因轉化匍匐剪股穎,鹽脅迫時可增加內源ABA的含量,提高轉基因植株的存活率。Zhang等[13]將擬南芥LOS5基因轉入玉米后,改善了根細胞離子通道和葉片含水量,耐鹽性得以提高;將LOS5基因分別轉入甘薯和黃瓜后,轉基因植株醛氧化酶活性顯著提高,ABA積累增多,耐鹽性增強[14,15];LOS5基因轉入水稻和大豆后,轉基因植株均表現出良好的抗逆性[16,17]。因此,ABA生物合成相關基因在植物逆境脅迫中起著重要的調控作用,可能具有重要的育種應用價值。
為了探究花生ABA途徑抗逆基因AhLOS5的耐鹽性功能,本研究以野生型(WT)三生煙、T1代AhLOS5過表達以及RNAi轉基因煙草株系為研究對象,進行了耐鹽性生物學功能分析,以期為進一步研究AhLOS5基因的功能,并指導花生耐鹽育種奠定基礎。
1 材料與方法
1.1 試驗材料
試驗于2020年4月在泰安市農業科學院生物工程研究所進行。三生煙(Nicotiana tabacumL.cv.Samsun)溫室常規管理。轉基因煙草株系為本實驗室前期獲得:AhLOS5基因過表達株系和RNAi株系分別通過攜帶AhLOS5基因相關片段的pBI121正義表達載體和反義表達載體,農桿菌介導法轉化三生煙葉片獲得。其中正義表達載體攜帶AhLOS5基因全長cDNA;反義表達載體攜帶與煙草中LOS5基因同源性達84.07%的269 bp片段,該片段位于1288~1557 bp,最長的完全一致序列長度為28 bp,符合RNAi要求。本試驗所用轉基因株系為T1代正義轉基因株系LOS5-9和反義轉基因株系LOS5-R-7。
1.2 RNA提取
采用RNA simple總RNA提取試劑盒(QIAGEN公司)提取,用1.2%瓊脂糖凝膠電泳檢測RNA的完整性。
1.3 Northern blot檢測
將經6%聚丙烯酰胺凝膠電泳分離的RNA轉移至尼龍膜上,65℃雜交箱預雜交12 h;以α-32P-dCTP標記的目標基因片段為探針,65℃過夜雜交;雜交后的膜于2×SSC(含0.1%SDS)及0.2×SSC(含0.1%SDS)洗液中清洗2次;將尼龍膜與X-光片緊密貼合,置于X射線曝光暗盒中,放置在-80℃冰箱中放射自顯影48 h。在暗室中經顯影、停影和定影,觀測Northern blot檢測結果。
1.4 轉基因煙草耐鹽性測定
幼苗根長測定:將野生型與正義和反義轉基因植株的T1代種子分別播種于1/2MS培養基上,置于25℃光照培養箱(16 h光照/8 h黑暗)。萌發后,選擇生長一致的煙草苗各20株,分別置于含有100 mmol/L NaCl的1/2MS液體培養基(NaCl)和正常1/2MS液體培養基(CK),7 d后測量根長。
葉片萎蔫癥狀檢測:將生長至6葉期的野生型和正義以及反義轉基因煙草各20株帶根部取出,自來水洗凈土壤,浸入含100 mmol/L NaCl溶液的1/2MS液體培養基。以正常1/2MS液體培養基處理為對照(CK)。鹽脅迫處理4 d后觀察植株葉片萎蔫程度。
1.5 轉基因煙草理化指標的測定
將種子用75%乙醇清洗3 min,用含50 mL Tween-20、有效氯2.6%的NaClO消毒10 min,無菌ddH2O(含100 mL Tween-20)清洗2次。將消毒后的煙草種子播于篩選培養基(1/2MS培養基,含卡那霉素100 mg/L,羧芐青霉素250 mg/L)上,4℃培養3 d,轉到28℃培養7 d。7 d后選擇根系發達、葉色濃綠的幼苗進行移栽,室溫生長7 d后進行理化指標測定。葉綠素含量、丙二醛含量(MDA)、相對電導率、抗氧化酶活性(APX、POD、SOD、CAT)、抗氧化物質含量(GSH和ASA)、脯氨酸(proline)及內源ABA含量測定方法參照《植物生理生化實驗原理和技術》[18],重復3次。
1.6 數據處理
采用Sigma Plot進行數據處理,用SPSS 21.0進行差異顯著性分析(P<0.05)。
2 結果與分析
2.1 轉煙草植株AhLOS5基因的表達量
Northern blot檢測結果(圖1)顯示,轉正義AhLOS5基因的煙草植株中AhLOS5基因過量表達,轉反義AhLOS5基因的煙草植株成功抑制了AhLOS5基因的表達。
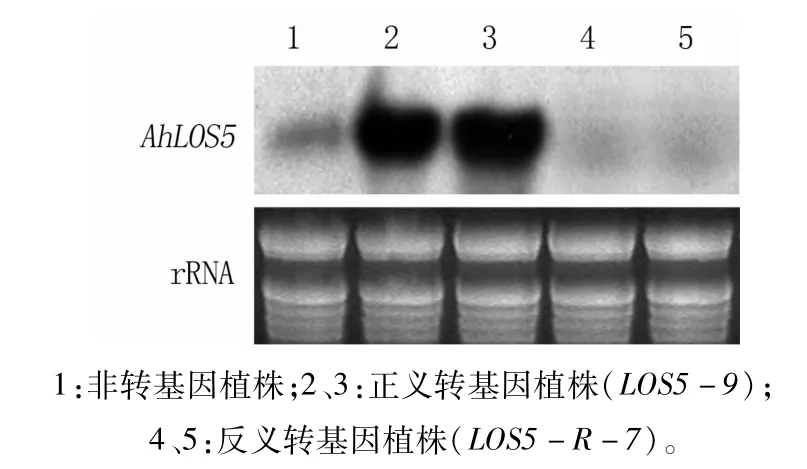
圖1 煙草植株Northern blot檢測結果
2.2 轉基因煙草植株耐鹽性
正常條件下,WT、LOS5-9與LOS5-R-7煙草幼苗平均根長分別為4.0、3.8、3.9 cm,差異不顯著。鹽脅迫條件下,WT和轉基因煙草幼苗根長都較正常條件下的短,其中LOS5-9平均根長為2.9 cm,顯著大于WT的1.7 cm和LOS5-R-7的1.4 cm(圖2)。
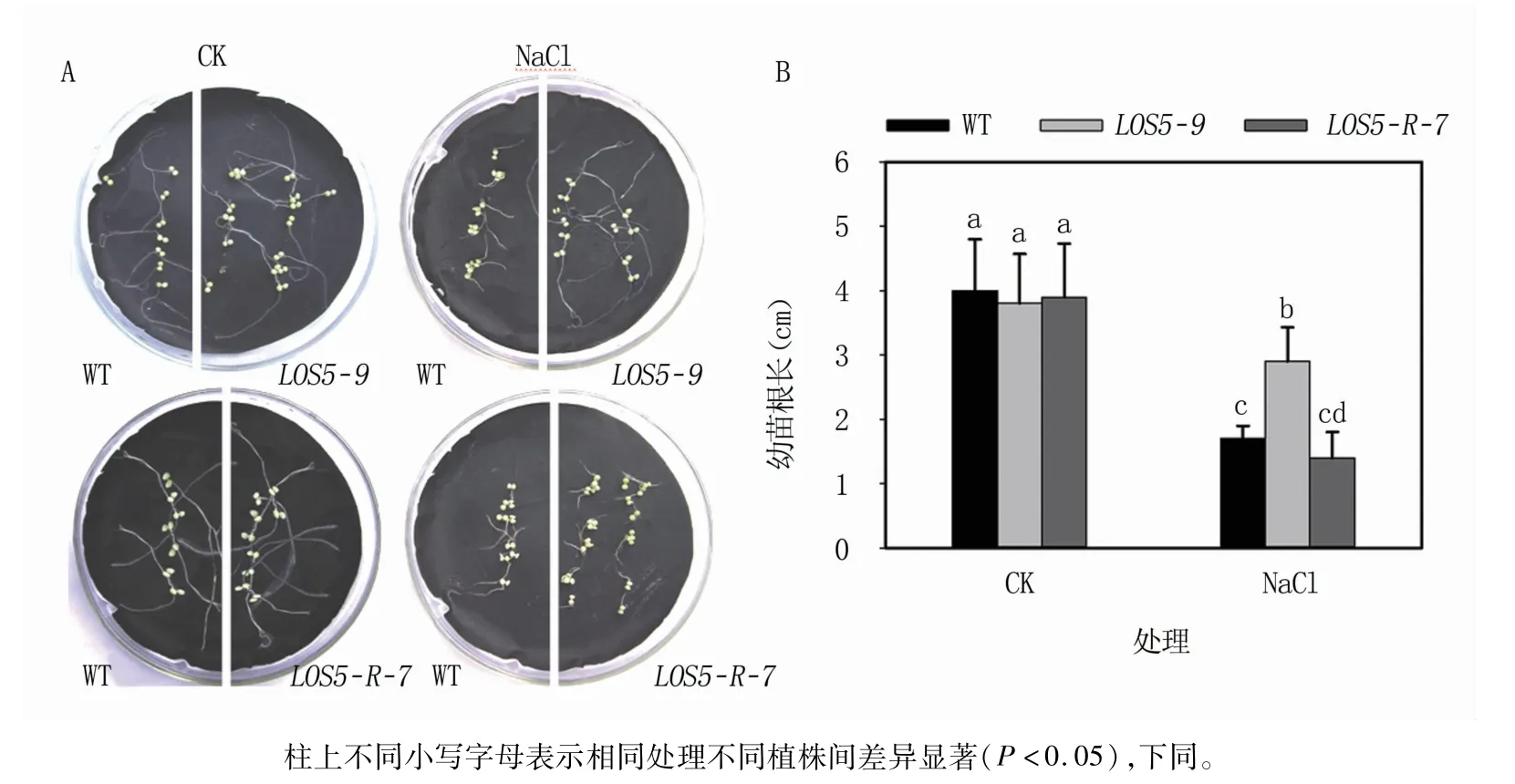
圖2 不同處理煙草幼苗根長
結果(圖3)顯示,鹽脅迫下,轉基因和WT煙草植株葉片均出現不同程度的萎蔫。LOS5-9轉基因植株萎蔫癥狀輕微,WT和LOS5-R-7煙草植株均出現明顯的萎蔫癥狀。

圖3 植株葉片萎蔫程度檢測
2.3 過表達AhLOS5轉基因植株耐鹽機制
2.3.1 鹽脅迫下煙草植株的細胞膜完整性 鹽脅迫下,植物會受到過氧化傷害,導致葉綠素生物合成降低、分解加速,表現為MDA含量和相對電導率上升,葉綠素含量下降。結果(圖4)表明,正常生長條件下,轉基因與WT煙草植株MDA含量、相對電導率和葉綠素含量無顯著差異。鹽脅迫下轉基因和WT煙草植株的MDA含量、相對電導率均顯著升高,葉綠素含量顯著降低。LOS5-9轉基因植株MDA含量和電導率升幅最小,WT煙草植株次之,LOS5-R-7轉基因植株升幅最大。LOS5-9轉基因植株葉綠素含量降幅最小,WT煙草植株次之,LOS5-R-7轉基因植株降幅最大。表明過表達AhLOS5轉基因植株細胞膜受鹽脅迫的傷害較小。
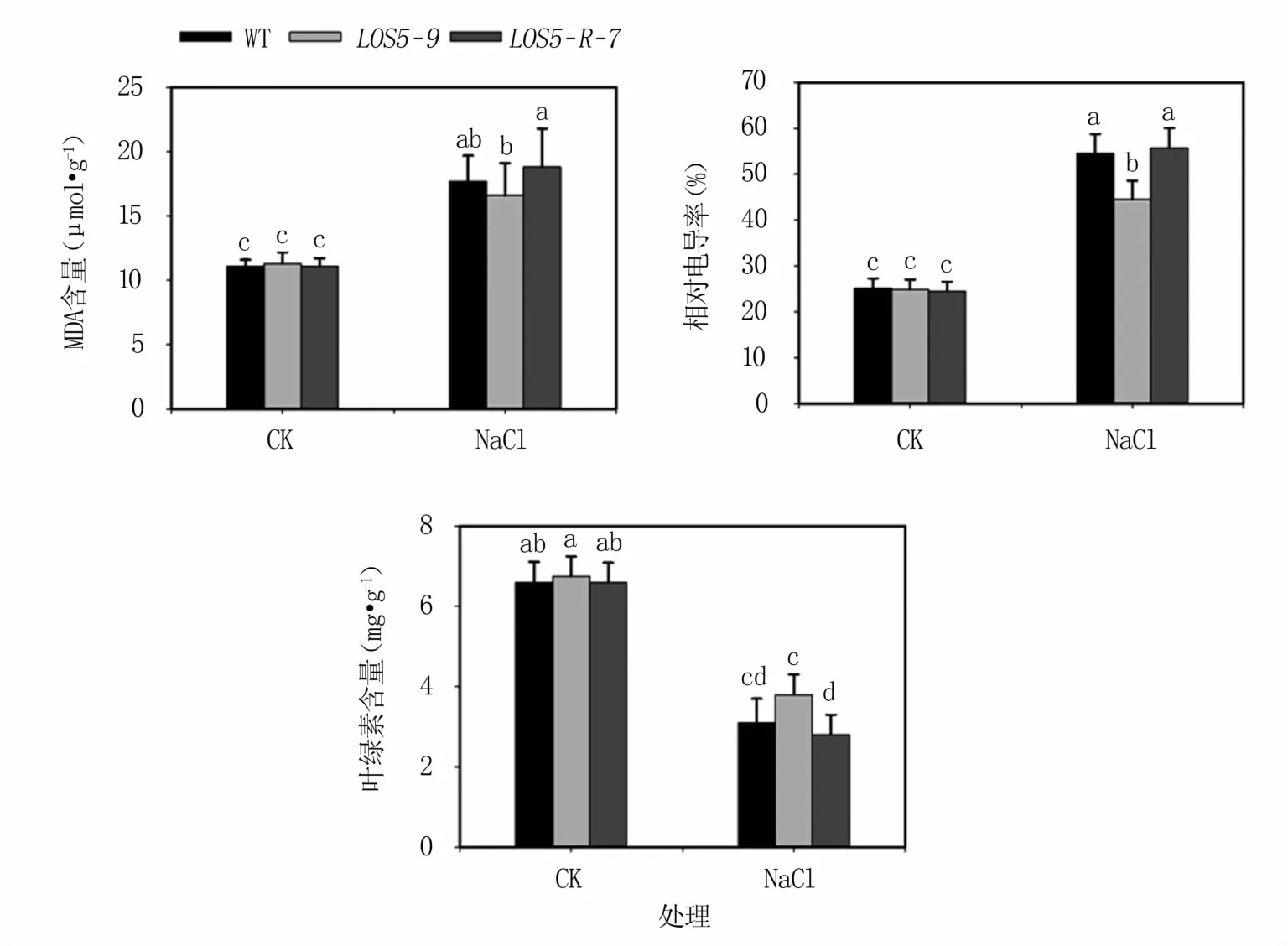
圖4 鹽脅迫下轉基因煙草植株電導率、MDA和葉綠素含量變化
2.3.2 鹽脅迫下煙草植株抗氧化酶活性和抗氧化物質含量 SOD、POD、APX和CAT是植物體內4種重要的抗氧化酶。SOD是活性氧清除系統中第一個發揮作用的抗氧化酶,在活性氧大量生成的部位催化超氧離子的歧化反應;POD、APX和CAT也是清除植物活性氧的關鍵酶。GSH和ASA可以清除由鹽脅迫誘導的過量活性氧;ASA還是維持APX活性的重要物質[19]。
結果(圖5)表明,正常生長條件下,轉基因與WT煙草植株4種抗氧化酶活性以及兩種抗氧化物質含量均無顯著差異。鹽脅迫下轉基因和WT煙草植株的抗氧化酶活性和抗氧化物質含量均顯著升高,其中LOS5-9轉基因植株抗氧化酶活性和抗氧化物質含量升幅最大,WT煙草植株次之,LOS5-R-7轉基因植株升幅最小。
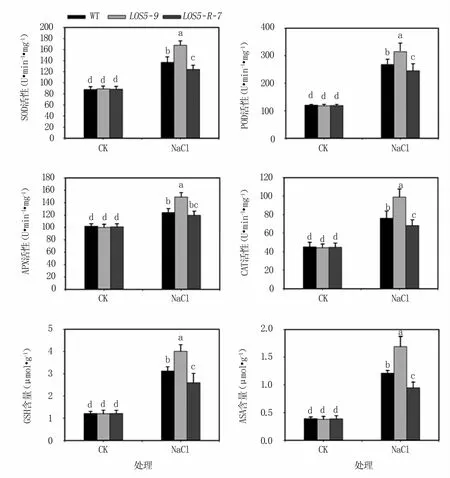
圖5 鹽脅迫下煙草植株抗氧化酶活性和抗氧化物質含量變化
2.3.3 鹽脅迫下煙草植株內源ABA和脯氨酸含量 ABA是植物內源合成的重要激素之一,鹽脅迫下ABA增加可引起氣孔關閉,減少水分蒸騰,還可通過促進植物根的生長并抑制莖的生長實現對鹽脅迫的應答。脯氨酸是一種重要的滲透調節物質,可以保護植物在遇到逆境時免受進一步的傷害。由圖6可知,正常生長條件下,植物體內源ABA和脯氨酸的含量均較低,野生與轉基因植株間無顯著差異。鹽脅迫條件下,煙草植株體內的ABA及脯氨酸含量急劇增加,LOS5-9轉基因植株的升幅最大,WT植株次之,LOS5-R-7轉基因植株升幅最小。其中LOS5-9轉基因植株的內源ABA和脯氨酸含量比WT煙草植株分別高35.26%和40.97%,比LOS5-R-7轉基因植株分別高72.87%和1.38倍。
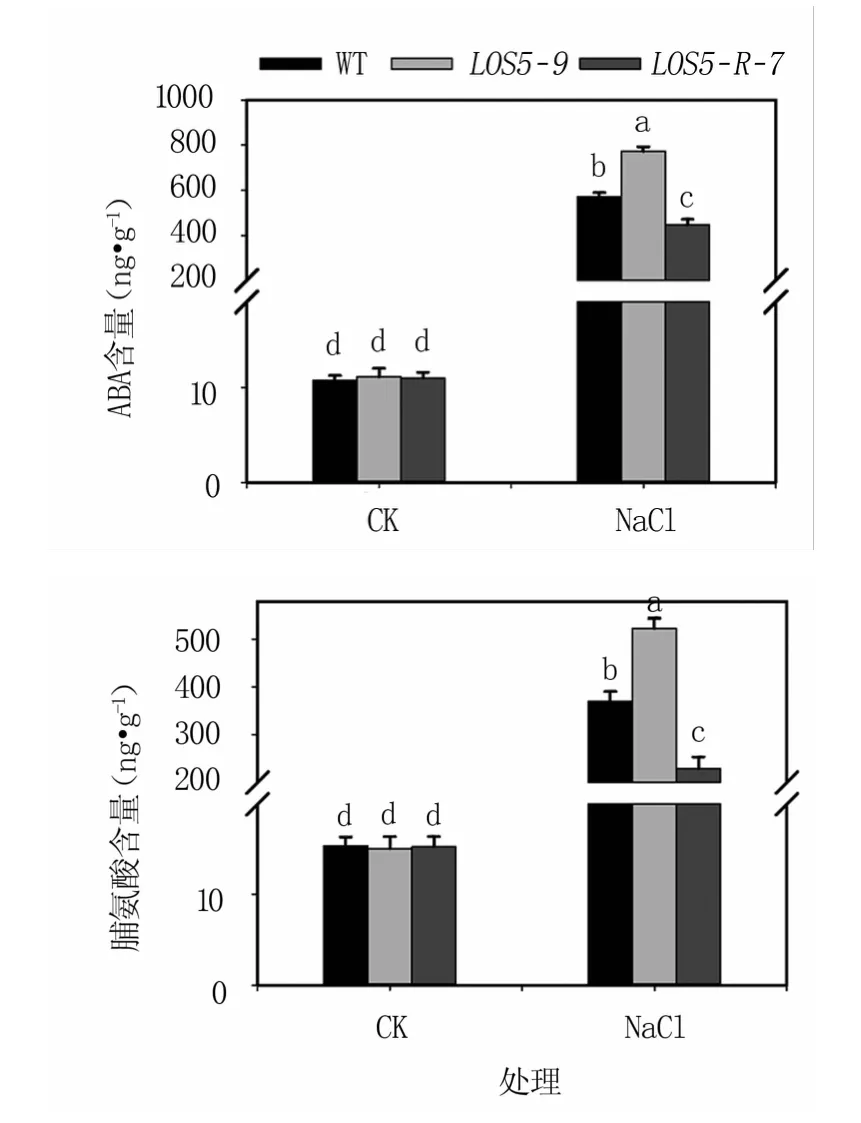
圖6 鹽脅迫下煙草植株內源ABA和脯氨酸含量變化
2.4 鹽脅迫相關調控基因的表達分析
為明確過表達AhLOS5基因提高轉基因煙草耐鹽性的作用機理,對其他抗逆相關基因在轉基因煙草中的表達模式進行了Northern blot檢測,包括P5CS、RD22和DREB2B。根據前人研究,DREB2B編碼一個與DRE順式作用元件結合的反式作用因子,通過調控DRE基因提高植物抗逆性,是不依賴ABA的抗逆途徑[20]。RD22的啟動子中具有脅迫應答轉錄因子MYC和MYB順式結合位點,是依賴ABA抗逆途徑中的重要基因[21,22]。P5CS是催化脯氨酸生物合成的關鍵酶,參與依賴ABA的抗逆脅迫途徑[23]。
結果(圖7)顯示,在WT煙草植株中,P5CS、RD22和DREB2B基因在正常條件下都有較低水平的表達,鹽脅迫可以誘導3個基因的超表達,說明3個基因都參與了植物抗鹽反應。在LOS5-9轉基因植株中,P5CS和RD22兩個基因受脅迫誘導表達的程度明顯高于WT煙草植株,而DREB2B基因的誘導表達程度則與WT植株無顯著差異。LOS5-R-7轉基因植株中,鹽脅迫僅顯著誘導DREB2B基因的超表達。說明AhLOS5與P5CS和RD22相同,都屬于ABA途徑相關的抗逆基因。
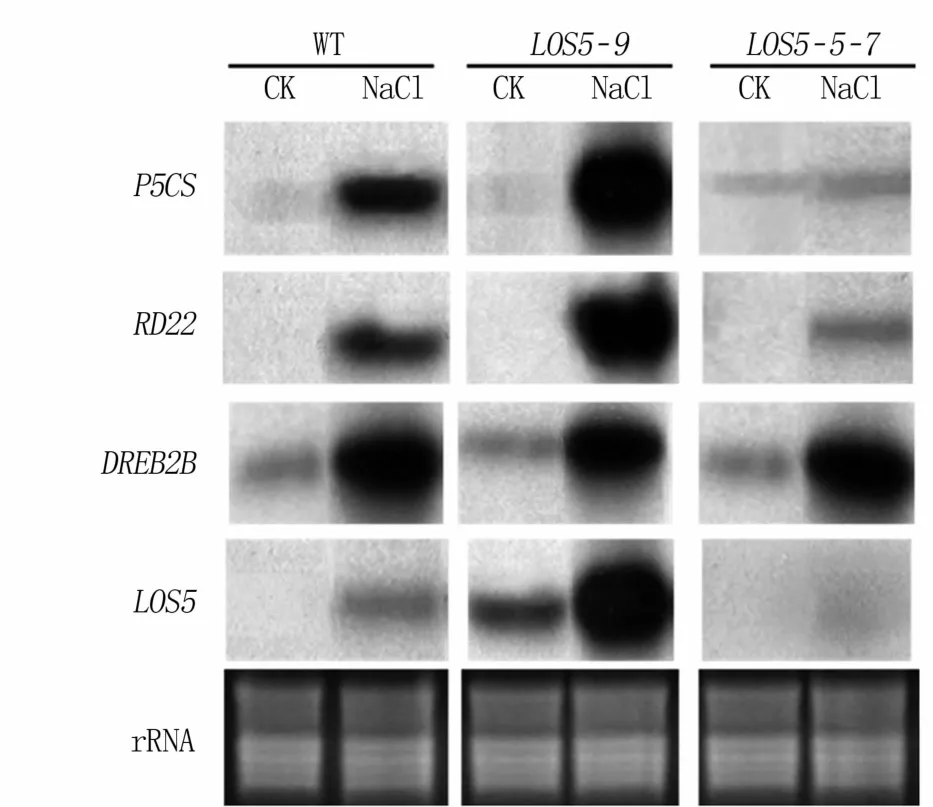
圖7 鹽脅迫下抗逆相關基因在煙草中的表達
3 討論與結論
植物抵御逆境脅迫的途徑可分為兩類,即依賴內源ABA的抗逆途徑和不依賴ABA的抗逆途徑。依賴ABA的抗逆途徑可引起內源ABA的積累,且對外源施加的ABA發生顯著的生物學效應,這一信號傳導途徑稱為依賴ABA的信號傳導途徑[22,24]。逆境脅迫時,外源噴施ABA可以增強抗氧化酶活性,降低活性氧含量,防止葉綠素降解,增大葉片相對含水量,減小質膜透性及丙二醛含量,增強PSⅡ的修復功能。在鹽脅迫下,植物體內ABA含量迅速增加,可降低葉片伸展率,調整保衛細胞離子通道;抑制氣孔開放、促進氣孔關閉,保持正常生命活動[25,26]。
在轉ABA生物合成相關基因的轉基因植株中,內源ABA積累是一個共性特征,包括轉AtZEP基因的擬南芥,轉NCED基因的番茄、擬南芥、煙草[8-10,27]。Xiong等[28]在2002年發現非生物脅迫下內源ABA的生物合成機制:首先滲透壓的改變誘導了NCED的表達,啟動了逆境脅迫ABA生物合成的第一步;ABA含量的波動引起隨后一系列ABA生物合成相關基因的表達,包括AAO、LOS5以及ZEP等基因,更增加了ABA的生物合成;這種多基因互作的協同效應最終使植株內源ABA積累量迅速增加。與本試驗結果一致。轉基因植株ABA通過調控許多受內源ABA誘導的脅迫應答基因,啟動了更多的生物合成,使得植物的抗逆性進一步增強。這也可以解釋本試驗中正義轉基因煙草在鹽脅迫下根長更長、脅迫耐受性更強的現象。
活性氧是植物鹽脅迫環境下產生的有害物質,可損壞細胞膜,造成膜脂過氧化,同時引起MDA在細胞中積累和相對電導率升高,影響細胞中蛋白質的合成。脅迫產生的ABA信號同時會激活細胞內多種抗氧化酶活性,包括SOD、POD、CAT和APX,這些過氧化物酶可以清除細胞中的活性氧,以保護細胞免受過氧化傷害[7]。本試驗結果顯示,在鹽脅迫下,轉基因植株和非轉基因植株都出現了MDA積累和相對電導率增加的現象;而正義轉基因植株的抗氧化酶活性更高,MDA含量和相對電導率更低。
為進一步證明過表達AhLOS5轉基因煙草耐鹽性是由鹽脅迫誘導產生的內源ABA調控的,本試驗選取了另外3個脅迫相關基因,研究其在不同煙草植株中的表達模式。結果顯示,在正義轉基因植株中,4個抗逆基因都受到鹽脅迫的誘導而超表達;而在反義轉基因植株中,鹽脅迫只能誘導不依賴ABA途徑的DREB2B基因的超表達,卻不能誘導ABA途徑的P5CS和RD22的過量表達。證明了LOS5基因的抗逆途徑與DREB2B不同,而與P5CS、RD22相同,都屬ABA途徑的抗逆基因,過表達AhLOS5基因的轉基因煙草植株獲得的耐鹽性是由脅迫誘導產生的內源ABA調控的。本研究為進一步探索AhLOS5基因在花生抗逆育種中的應用提供了理論基礎。

