VEGF、S-100P及clusterin在腱鞘巨細胞瘤中的表達情況及臨床意義
潘 媚,巫 娟,陳金蓉
1.四川省骨科醫院病理科,四川成都 610041;2.成都 416 醫院病理科,四川成都 610051
腱鞘巨細胞瘤是臨床較為常見的四肢腫物,其主要起源于腱鞘及肌腱之間的滑囊細胞,疾病進展較為緩慢,多為良性[1]。有研究者將腱鞘巨細胞瘤作為炎性反應性疾病[2]。而在2013年世界衛生組織將其稱之為纖維組織細胞性腫瘤[3]。鈣結合蛋白100(S100P)通過對鈣離子依賴性信號通路的介導作用,影響腫瘤細胞的增殖與分化。血管內皮生長因子(VEGF)可通過調控局部病灶部位的腫瘤組織的新生血管,進一步對腫瘤細胞的浸潤作用進行調控[4]。叢生蛋白(clusterin)又名睪酮抑制性前列腺信使-2,其與惡性腫瘤疾病的相關研究較多,但是與腱鞘巨細胞瘤的研究較少[5]。本研究主要通過腱鞘巨細胞瘤的免疫組織化學法研究及VEGF、S-100P及clusterin的表達規律對患者病理類型的診斷進行分析,為臨床診斷提供科學依據。
1 資料與方法
1.1一般資料 本研究為前瞻性研究,以2018年8月至2021年2月在四川省骨科醫院就診的腱鞘巨細胞瘤患者72例作為觀察組,其中男23例,女49例;年齡24~65歲,平均(40.00±11.14)歲;體質量指數(24.85±2.69)kg/m2;手足關節部位29例,膝關節31例,踝關節12例;局限型51例,彌漫型21例;完整包膜29例,不完整包膜43例。另選擇同期成都 416 醫院行健康體檢的良性纖維病變者72例作為對照組,其中男27例,女45例;年齡24~65歲,平均(40.44±11.61)歲;體質量指數(24.66±2.62)kg/m2。兩組一般資料比較差異無統計學意義(P>0.05),具有可比性。所有患者均簽署知情同意書,并經倫理委員會論證通過。
觀察組納入標準:(1)符合腱鞘巨細胞瘤診斷標準[6];(2)入組前未進行抗腫瘤治療;(3)簽署知情同意書。排除標準:(1)嚴重心臟、肝、腎功能障礙;(2)中途退出本研究。
1.2研究方法 分別對觀察組及對照組的病變組織進行采集,采用10%中性甲醛水溶液固定,常規脫水,石蠟包埋后進行連續切片,切片的厚度設定為4 μm,采用pH6.0的檸檬酸修復液對石蠟切片進行脫蠟及脫水,采用高壓加熱法對抗原進行修復。分別采用1∶100的VEGF、S-100P及clusterin抗體進行滴加,在4 ℃下進行孵育過夜,采用多聚物酶標二抗進行滴加后,在37 ℃下孵育45 min,采用DAB進行顯色,蘇木精進行復染。細胞漿內出現棕黃色或棕褐色顆粒物即為VEGF、S-100P及clusterin陽性。采用染色強度及陽性細胞的二級計數法對VEGF、S-100P及clusterin進行評分,無染色則為0分,淡黃色則為1分,黃褐色則為2分,深褐色則為3分。陽性細胞數目比例為<10%則為0分,10%~25%則為1分,>25%~50%則為2分,>50%~100%則為3分。染色強度及染色比例的評分乘積可作為以上蛋白表達程度的評價依據,<6分以下為低表達,≥6分則為高表達[7]。
1.3觀察指標
1.3.1兩組患者VEGF、S-100P及clusterin相對表達水平比較 分別對觀察組及對照組VEGF、S-100P及clusterin相對表達水平進行分析。
1.3.2不同病理特征患者VEGF、S-100P及clusterin相對表達水平比較 分別對不同病灶部位、性別、年齡、病變程度、包膜完整性患者VEGF、S-100P及clusterin相對表達水平進行比較。
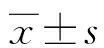
2 結 果
2.1兩組VEGF、S-100P及clusterin相對表達水平比較 觀察組VEGF、S-100P及clusterin相對表達水平明顯高于對照組(P<0.05),見表1。

表1 兩組VEGF、S-100P及clusterin相對表達水平比較
2.2不同病理特征患者VEGF、S-100P及clusterin相對表達水平比較 不同性別、年齡、腫瘤部位患者VEGF、S-100P及clusterin相對表達水平比較,差異無統計學意義(P>0.05);不同局限性、包膜及腫瘤最大徑患者VEGF、S-100P及clusterin相對表達水平比較,差異有統計學意義(P<0.05),見表2。

表2 不同病理特征患者VEGF、S-100P及clusterin相對表達水平比較
2.3相關性分析 通過相關性分析,患者VEGF、S-100P及clusterin與疾病局限性、包膜及腫瘤最大徑呈正相關(r=0.321~0.852),見表3。

表3 相關性分析
3 討 論
腱鞘巨細胞瘤主要是起源于腱鞘及關節滑膜層的良性病變,好發于手指、足部的腱鞘滑膜組織及小關節。有研究報道指出,腱鞘巨細胞瘤也可發生于臀部、腕部及肩部[8]。腱鞘巨細胞瘤高發于30~50歲,女性患者發病率明顯高于男性。在疾病進展中,腫瘤生長速度較為緩慢,結節的大小在多年內可維持在一定大小。2013年世界衛生組織將其定義在纖維組織細胞瘤范疇[9]。目前,按照腫瘤生長方式,可以將其分為局限型及彌漫型兩種類型。局限型腱鞘巨細胞瘤主要發生在手部及腕關節,其比例可達65%~89%[9-10]。在手部病變部位中,主要以食指及中指作為主要病灶部位,而膝關節等下肢部位的腱鞘巨細胞瘤發病較少。
VEGF主要位于機體6號染色體中,通過基因編碼形成VEGF蛋白,可與血管內皮細胞特異性結合,促進血管生長因子形成[7]。本研究中,觀察組VEGF相對表達水平明顯高于對照組,且隨著腫瘤最大徑增大及局限性改變,VEGF相對表達水平明顯上升。在疾病的進展中,當突破包膜及局限性降低時,腫瘤細胞的增殖需要獲取較多的氧氣及營養物質,新生的毛細血管代償性增多,但是在新生毛細血管的形成過程中,由于受到局部病灶部位的腫瘤細胞及炎性細胞的雙重影響,病灶部位的血管內皮功能發生明顯紊亂,進一步造成內皮細胞特異性表達VEGF[11]。而局部病灶部位的血管密度分析雖然可以在一定程度上反映局部病灶部位的血管形成情況,但是其對病灶部位的采樣具有明顯依賴性。S-100P在腫瘤細胞的異常表達與患者腫瘤細胞的生長、浸潤及轉移密切相關[10]。本研究中,觀察組S100P相對表達水平較對照組明顯升高,且不同局限性、包膜及腫瘤最大徑患者S-100P相對表達水平比較,差異有統計學意義(P<0.05)。有研究報道認為,腱鞘巨細胞瘤患者組織中基因啟動子區域的甲基化狀態與患者的浸潤程度及臨床分型存在一定相關性,局部病灶部位的甲基化狀態情況越高,患者的浸潤程度及臨床分型嚴重程度越高[12]。clusterin是從睪丸液體中分離得到,在多種腫瘤組織中呈現較高表達水平,同時在組織重建、結構重建、擴膜轉運對巨噬細胞具有趨勢化,在一定程度上促進了腫瘤細胞進展。在本研究中,雖然腱鞘巨細胞瘤不是惡性腫瘤,多數為良性腫瘤,但是觀察組clusterin相對表達水平明顯高于對照組,且clusterin與疾病的局限性、包膜及腫瘤最大徑呈正相關,說明clusterin在腱鞘巨細胞瘤的疾病進展中發揮重要作用。
綜上所述,腱鞘巨細胞瘤與VEGF、S-100P及clusterin表達可能相關,VEGF、S-100P及clusterin與腱鞘巨細胞瘤的包膜不完整彌漫型、局限性、腫瘤最大徑等病理特征可能存在一定關系。

