2020~2021年廣州市售牡蠣中GII型諾如病毒污染情況調查
楊家樂,薛 亮 ,蔡偉程,李貽靜,高珺珊,陳謀通,葉青華,吳 詩,張菊梅,別小妹 ,吳清平
(1.廣東省科學院微生物研究所,廣東省科學院,華南應用微生物國家重點實驗室,廣東省微生物安全與健康重點實驗室,廣東廣州 510070;2.南京農業大學食品科技學院,江蘇南京 210095)
諾如病毒(Norovirus,NoV)是一種常見的食源性病毒,人感染后會出現腹瀉、嘔吐等急性腸胃炎癥狀,通常在醫院、學校、養老院等人員密集場所易發生小規模的聚集性暴發[1?2],不但對人體健康產生危害,同時也造成了巨大的經濟損失。根據衣殼蛋白(VP1)的序列,諾如病毒可以分為GI-GX十種基因組,包括48個基因型[3?4]。諾如病毒傳播主要通過糞口途徑,患者的嘔吐物及糞便中一般都有較高濃度的病毒,有較強的傳染性,并通過氣溶膠傳播[5]。近些年國內各個省市因感染諾如病毒而出現急性腸胃炎癥狀的患者數量居高不下[6?9],其中2013~2017年廣東省報告的散發諾如病毒感染167例,超過60%的病例是由GII.2、GII.4、GII.17型病毒引起[10]。
諾如病毒能夠在自然環境中持續存在并保持感染性,主要通過將未經處理或未經充分處理的污水排放或泄漏到泉水、河流、水壩或入海口等水源中而最終進入環境中。該病毒常在食品及水中被檢出[11?13],新鮮的水果、蔬菜表面因接觸污水也存在污染風險,雙殼貝類(如牡蠣、貽貝等)一般在近海附近養殖,作為濾食性生物能夠過濾大量的水,對水中的病原微生物起到富集的作用[14];尤其貝類的消化組織中存在類組織血型抗原[15],在病毒與貝類組織結合過程中發揮重要作用,因此消化組織是病毒富集的主要部位,富集含量最高[16]。由于貝類中的病毒主要來自于環境,因此當新的病毒流行株在環境中出現時,貝類中也會檢測到同樣的病毒基因型。由于GII型諾如病毒結合的組織類型比其他基因型豐富,它可以存在于消化腺、腸道、腮部、外套膜等多個部位[17],因此需要重點關注該病毒基因型在牡蠣中的存在情況。
廣東作為貝類養殖大省,但同時市售牡蠣中存在諾如病毒污染問題[18],食用前如不高溫加熱將其中的病毒滅活,有被感染的風險,監測相關貝類產品中諾如病毒的污染水平對于預防此類事件的發生有重要意義。因此,為了進一步掌握廣州地區市售牡蠣中GII型諾如病毒污染情況,本研究開展了為期一年的監測調查,以期明確該地區牡蠣中諾如病毒的污染水平及季節分布規律。
1 材料與方法
1.1 材料與儀器
牡蠣樣品于2020年6月至2021年5月,在廣州市黃沙水產市場購買牡蠣,挑選體積大小近似(挑選的樣品體長在10~14 cm之間,體寬在6~9 cm之間,牡蠣肉重量(去殼)在14~20 g之間),新鮮且外觀無明顯損傷的牡蠣,每個牡蠣經過無菌解剖后取消化腺組織進行下一步檢測或保存在?80 ℃冰箱待檢;諾如病毒陽性樣本 來自廣州市急性腸胃炎患者的糞便樣本[19],經過處理后保存在?80 ℃冰箱;鼠諾如病毒(Murine norovirus,MNV) 由廣東省科學院微生物研究所食源性病毒組提供;蛋白酶K 30 U/mg,Merck公司;聚乙二醇(PEG)6000 kingbio公司;10×磷酸鹽緩沖鹽溶液 PH7.2,上海生工生物工程股份有限公司;Evo M-MLV One Step RT-qPCR Kit(Probe)艾科瑞公司;Premix Taq? (Ex Taq? Version 2.0 plus dye)、One Step Prime Script? RT-PCR Kit(Perfect Real Time )上海百賽生物技術有限公司;High Pure Viral RNA Mini Kit試劑盒 廣州美基生物科技有限公司;引物及探針 由北京六合華大基因科技有限公司合成;100 bp DNA Ladder 北京擎科生物科技有限公司。
Microfuge 20R臺式冷凍離心機 美國Beckman公司;Quant Studio 6 and 7 Flex Real-Time 熒光定量PCR儀 美國Thermo Fisher Scientific公司;羅氏LightCycler96實時熒光定量PCR儀 美國Roche公司;Biometra Tone 96 PCR儀 德國耶拿公司;振蕩培養箱 上海知楚儀器有限公司;DK-S22型電熱恒溫水浴鍋 廣東環凱微生物科技有限公司;MY-10/20手持式電動組織研磨器 上海凈信有限公司;SW-CJ-IFD型超凈工作臺 中國蘇凈安泰公司;T500電子天平 美國G&G公司。
1.2 實驗方法
1.2.1 樣品前處理 根據本實驗室已建立方法進行牡蠣樣本的處理[20],具體如下:每個牡蠣樣品取其消化腺組織0.15 g,分裝在1.5 mL離心管中打碎勻漿,加入10 μL鼠諾如病毒(作為過程控制對照),并加入1.2 mL蛋白酶K溶液(100 μg/mL)渦旋混勻,置于37 ℃恒溫培養箱320 r/min振蕩60 min;60 ℃水浴加熱15 min,使蛋白酶K滅活,待冷卻至室溫,10000 r/min離心3 min;吸取上清液,加入600 μL PEG6000(36% PEG6000,0.9 mol/L NaCl)并將混合液放入4 ℃冰箱靜置1 h,然后10000 r/min離心10 min;棄去上清液取沉淀;用140 μL 磷酸鹽緩沖鹽溶液(稀釋為1×)重懸沉淀,用于核酸抽提。
此外,取鼠諾如病毒以及諾如病毒樣本與樣品一起提取RNA,用于計算病毒回收率以及PCR擴增效率。
1.2.2 提取病毒RNA 用High Pure Viral RNA Mini Kit試劑盒提取病毒RNA,按照說明書中的操作步驟提取病毒RNA,直接用于核酸檢測,或置于?80 ℃冰箱保存代用。
提取病毒RNA后采用熒光定量RT-PCR和巢式RT-PCR進行檢測,兩種技術的檢測靈敏度存在差異。其中熒光定量RT-PCR是目前國家標準和ISO標準推薦的方法,靈敏度較高,而巢式RT-PCR靈敏度相對較低,但其結合桑格測序能夠獲得目的病毒序列。
1.2.3 實時熒光定量逆轉錄聚合酶鏈反應檢測 如表1和表2,反應體系:2 × One Step RT-qPCR Buffer 10 μL,Pro Taq HS DNA Polymerase 0.4 μL,Evo MMLV RTase Enzyme Mix 0.4 μL,上下游引物各0.4 μL(10 μmol/L),探針0.8 μL(10 μmol/L),RNA模板2 μL,加無RNA酶水至反應體系為20 μL。具體反應條件:42 ℃逆轉錄300 s,1個循環;95 ℃預變性10 s,1個循環;95 ℃變性5 s,60 ℃退火,20 s,45個循環。將諾如病毒標準品進行梯度稀釋(濃度為2×108~2×100copies),根據拷貝數與PCR反應的Ct值做標準曲線。結果判斷:若樣品有S型擴增且Ct值≤40,判為陽性,有S型擴增且Ct值>40或無明顯S型擴增曲線但報告有Ct值,仍判定為陰性。檢測結果為陽性樣本的Ct值,依據標準曲線(y=?3.428lg(x)+43.15)計算病毒拷貝數,其中y為熒光定量Ct值,x為病毒拷貝數。

表1 實時熒光定量逆轉錄聚合酶鏈反應(Real-time RT-PCR)的引物與探針Table 1 Primers and probes of Real-time reverse transcription polymerase chain reaction
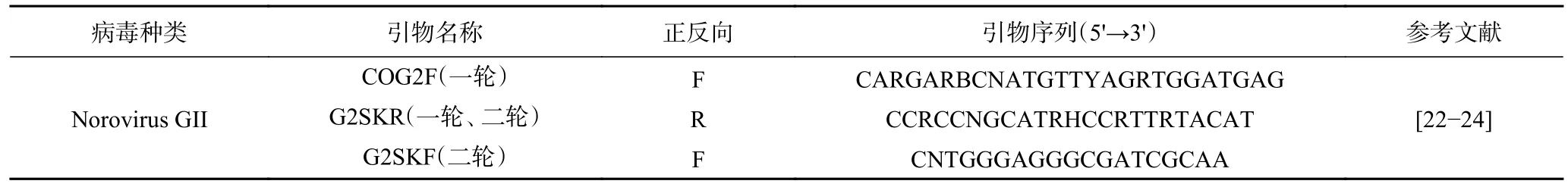
表2 巢式RT-PCR引物Table 2 Nested RT-PCR primers
1.2.4 巢式RT-PCR定性檢測 熒光定量檢測為陽性結果的樣品,經過巢式RT-PCR擴增后進行瓊脂糖凝膠電泳,符合目標條帶的擴增產物送去測序。第一輪巢式PCR反應體系:2×1 Step Buffer (Dye Plus) 10 μL,PrimeScript 1 Step Enzyme Mix 1 μL,上下游引物各1 μL,RNA模板2 μL,加無RNA酶水至反應體系為 20 μL。第一輪巢式PCR反應條件:50 ℃反轉錄30 min;94 ℃預變性4 min,55 ℃退火30 s,72 ℃延伸30 s,35個循環;72 ℃延伸7 min。第二輪巢式PCR反應體系:Premix Taq? (Ex Taq? Version 2.0 plus dye) 10 μL,上下游引物各1 μL,RNA模板2 μL,加無RNA酶水至反應體系為20 μL。第二輪巢式PCR反應條件:94 ℃預變性3 min;94 ℃變性30 s,50 ℃退火30 s,77 ℃延伸30 s,30個循環;72 ℃延伸5 min。
1.2.5 基因序列分析 擴增產物經瓊脂糖凝膠電泳分析后,將陽性擴增產物送于北京六合華大基因科技有限公司直接測序進行測序,將測序結果提交至在線基因分型工具(https://www.rivm.nl/mpf/typingtool/norovirus/),并在NCBI數據庫進行BLAST在線比對(https://blast.ncbi.nlm.nih.gov/Blast.cgi)。為進一步分析測序毒株,選取諾如病毒的各基因型毒株作為代表毒株進行比對,參考株基因序列均來源于Gen-Bank。采用ClustalX軟件進行序列比對,MEGA 7.0.26軟件構建進化樹(Neighbor Joining 法),bootstrap 檢驗設置1000次。
1.3 數據處理
本研究對每份樣品的回收率和PCR擴增效率均進行3次平行實驗以確保數據的穩定性,若樣品回收率>1%則判定為有效提取,否則不納入數據分析;采用EXCEL 2019匯總全部的原始資料和檢測結果;應用SPSS20.0軟件對諾如病毒檢出情況進行統計學分析,每月的平均病毒拷貝數用(平均值±標準差)表示,采用單因素方差分析對不同季節的病毒檢出率進行比較,檢驗水準α=0.05。
2 結果與分析
2.1 市售牡蠣中諾如病毒檢出情況
檢測結果顯示(表3和表4),廣州市市售牡蠣中存在諾如病毒污染情況,在2020年6月~2021年5月共計110份的樣品中,實時熒光定量RT-PCR檢測結果陽性樣本數為58份,全部為諾如病毒GII型,總體陽性率為52.7%。病毒污染含量范圍為1.56×103~1.09×106copies/g(消化腺)。
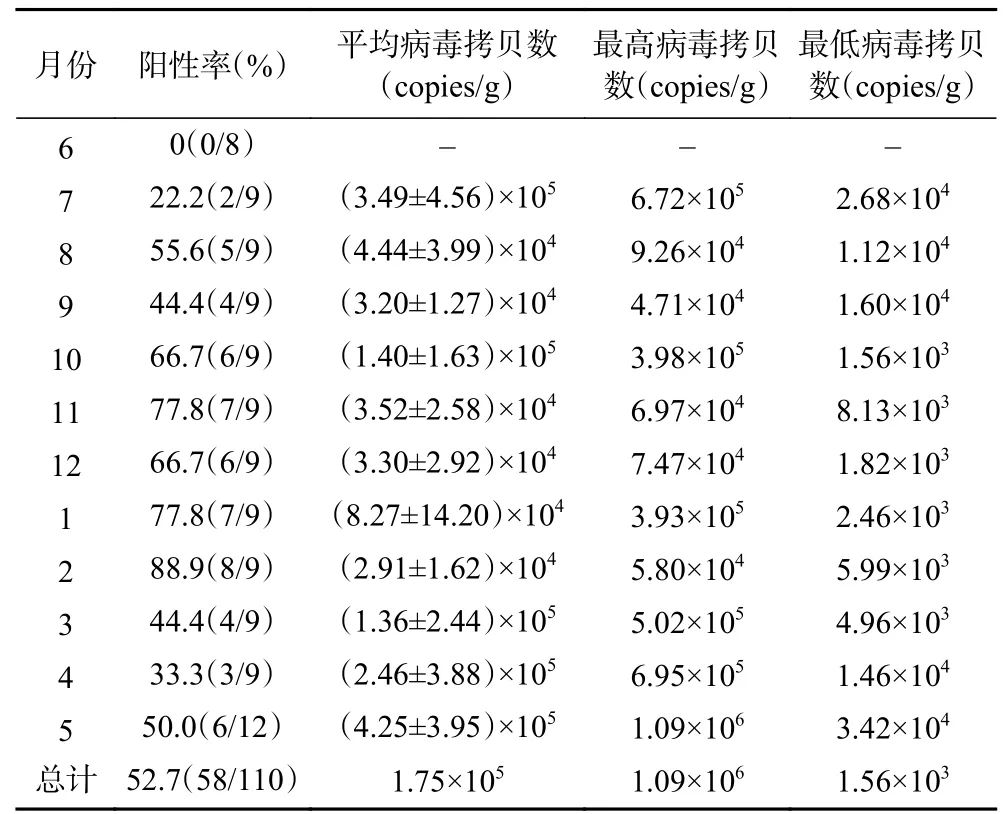
表3 2020年6月~2021年5月廣州市售牡蠣諾如病毒(GII)檢測情況Table 3 Detection results of norovirus GII in commercial oysters in Guangzhou from June 2020 to May 2021
2.2 市售牡蠣中諾如病毒檢出的季節分布規律
如表3所示,在2020年6月~2021年5月期間,病毒檢出陽性率隨季節變化而變化,冬季陽性率高于其他季節。如表3所示,在2020年6月~2021年5月期間,春季(3~5月)采集牡蠣樣品30個,其中陽性樣本數為13;夏季(6~8月)采集牡蠣樣品26個,其中陽性樣本數為7;秋季(9~11月)采集牡蠣樣品27個,其中陽性樣本數為17;冬季(12~2月)采集牡蠣樣品27個,其中陽性樣本數為21;秋季及冬季時檢測到諾如病毒陽性牡蠣樣本數要高于春季及夏季,所有的陽性樣本中,病毒含量均高于1000 copies/g(消化腺)(圖1)。
從季節分布來看,春季(3~5月)采集的樣本中諾如病毒平均污染量為2.69×105copies/g(消化腺),夏季(6~8月)采集的樣本中諾如病毒平均污染量為1.97×105copies/g(消化腺),秋季(9~11月)采集的樣本中諾如病毒平均污染量為6.91×104copies/g(消化腺),冬季(12~2月)采集的樣本中諾如病毒平均污染量為4.83×104copies/g(消化腺),不同季節中檢出的陽性樣本中病毒含量無明顯差異。從不同數量級病毒中的陽性樣品數量分布(表5)來看,病毒含量在104~105copies/g之間的樣品最多。

表5 不同數量級病毒中的陽性樣品數量分布Table 5 Distribution of positive samples in norovirus of different orders of magnitude
廣東省屬于亞熱帶季風氣候,秋冬季節溫度較低(平均溫度在20 ℃以下),降雨較少,而春夏季溫度較高,降水較多,對環境中病毒含量可能會造成一定影響。本文中的結果在一定程度上反應出牡蠣污染病毒的季節性差異,在下一步持續工作中,需要提高不同季節樣本檢測數量,更加系統的表征季節對于污染牡蠣的影響。
2.3 市售牡蠣中諾如病毒毒株系統發育分析
在對市售牡蠣的檢測中,為了確定陽性樣本中的病毒基因型,常利用巢式RT-PCR方法并結合桑格測序。由于巢式RT-PCR靈敏度相對較低,因此一些陽性樣品無法通過巢式RT-PCR得到病毒序列,在58份陽性樣品中最終得到14份陽性樣本的測序結果,將序列提交至GenBank數據庫,獲得序列號為OK090974-OK090987。在GenBank上進行BLAST比對,構建進化樹進行基因型鑒定(見圖1)。其中僅一條序列為GII.17基因型,來自12月份的牡蠣樣品,它與2015年美國檢測到的毒株(MT344182)、2016年的巴西檢測到的毒株(MN045198)、2018年在韓國檢測的毒株(MN461158)相似率均超過99%;此外13條序列均為GII.4基因型,分別來自2、3、5月份的牡蠣樣本,它們與2012年廣東省的毒株(MH 469205)、2013年美國檢測到的毒株(KY486271)、2017年澳大利亞檢測的毒株(MK280937)相似率超過90%,與本團隊前期研究中檢測到人群中流行的病毒基因型基本一致[9,19]。

圖1 廣州市售牡蠣中諾如病毒序列的系統發育樹Fig.1 Phylogenetic trees for norovirus sequences detected in commercial oysters in Guangzhou
3 討論
近些年世界范圍內與食用貝類相關的諾如病毒胃腸炎疫情層出不窮[25?28],多數是因為生食或者食用輕度加熱的貝類所導致。大多數國家或地區規定了貝類組織或貝類養殖水中腸道致病菌的可接受水平,例如在歐盟標準中,對貝類生產區劃分了A、B、C三個等級,其中規定A區中80%以上的產品中大腸桿菌含量必須少于230 個/100 g,B區中90%以上的產品中大腸桿菌含量少于4600 個/100 g,C區中全部產品中大腸桿菌含量少于46000 個/100 g[29],這些標準很好的控制細菌作為貝類相關疾病暴發原因,但未能阻止許多病毒源性疾病的暴發[30],因食用貝類而引起的病毒性胃腸炎暴發的調查表明,在患者的體內或使用過的餐具中檢出了諾如病毒[31?32]。雖然在牡蠣中存在的諾如病毒基因型較豐富,但本研究中主要檢測牡蠣中GII型的諾如病毒,因為大部分患者是以感染GII型諾如病毒為主[33],廣州地區市場中的牡蠣普遍存在污染問題,我們通過市售牡蠣監測調查發現該地區牡蠣中GII型諾如病毒的陽性率達到了52.7%,病毒含量最高達到了1.09×106copies/g,最低為1.56×103copies/g,經測序確定病毒基因型包括GII.4及GII.17型。由于國內消費者更習慣高溫烹飪而不是直接生食牡蠣,即使病毒檢出率偏高但也不會引起較高的人群感染率,但不能排除在高溫加工后仍有小部分病毒未被滅活,對于免疫力低下的人群如老人及兒童,需要注意此類風險。
沿海的國家和地區因地理和飲食特點等原因經常發生貝類相關的諾如病毒感染,例如韓國[34],日本[35],中國山東[36],廣東[37]等地都有報道。因此對貝類中諾如病毒的持續監測具有重要意義,很多國家一直在持續檢測國內相關產品中的諾如病毒污染狀況。意大利的研究人員在2005~2008年間采集的116個雙殼貝類樣本中檢出陽性率10.3%,其中GII.4-2004和GII.b為主要基因型[38]。在意大利的另一個監測調查中,貝類樣本中諾如病毒的檢出率為13.2%(31/235)[39]。荷蘭為期兩年的監測中,在牡蠣和貽貝樣本中諾如病毒的檢出率為16.7%(7/42份),包括GII.4等[40]。2017年7月到2018年8月在對中國山東省兩個牡蠣養殖區為期一年的采樣檢測中,諾如病毒GII基因型陽性率為31.7%(19/60)[41]。越來越多的國家意識到監測牡蠣中食源性病毒的重要性,不僅可以控制病毒引發的疾病風險,為貝類產品中病毒凈化方法提供參考標準,還為預測可能的病毒流行株提供了相關數據。
本研究的樣品主要來自廣東省陽江、茂名、臺山、湛江、順德等地,在采樣時選擇體積大小相近,新鮮有活力的牡蠣樣品,對牡蠣進行無菌解剖取其消化腺組織。根據文獻報道,在大多數的病毒污染牡蠣的調查中,檢測的組織是消化腺,因為該組織中病毒含量較其他部位高,相對容易檢出[16]。本研究中市售牡蠣諾如病毒總檢出率為52.7%(58/110),結果表明廣州市售牡蠣中諾如病毒污染水平較高,檢出率高于北京市(37.5%,21/56)[42]和連云港市(26.67%,48/180)[43],這可能和樣本前處理方法或結果判斷條件有關,本研究使用實驗室前期建立的檢測方法,病毒回收率是ISO/TS 15216-2:2013方法的7倍[20],對病毒含量偏低的牡蠣樣本有較好的檢測效果。同時,在對同一地區中牡蠣污染率增加的調查表明,陽性率的增加(2.7%上升至20.7%)可能與牡蠣產區的污染增加有關[44]。
秋冬季檢測的牡蠣中病毒的陽性率普遍比春夏季要高,而病毒含量水平卻沒有較大差異,這一情況與其他研究中的結果相似[45]。由于冬季環境溫度有利于諾如病毒持續在環境中存在[46],且冬季是諾如病毒流行的高峰時間段,因此在一定程度上會造成環境中如污水中病毒含量升高,濾食性雙殼貝類如貽貝、蛤和牡蠣在近海口地區生長時,會受到污水排放影響而富集水中的諾如病毒[47],構成了人-環-食傳播路徑。
測序結果顯示檢測的樣本中大多數為GII.4型毒株,GII.4型毒株是全球范圍內感染人體和在環境中檢測到的主要毒株,在70.0%~80.0%的急性胃腸炎患者的排泄物中都有檢測出該基因型的諾如病毒,并且GII.4基因型的變異株也陸續出現[48?49],另有一株GII.17型,近幾年GⅡ.17型逐漸成為世界范圍內的優勢流行株,Pu等[50]發現GII.17型毒株在污水、牡蠣和腸胃炎病例中的同時存在和占主導地位。在對北京市售牡蠣中諾如病毒檢測結果中同樣檢出該基因型,與人感染的GⅡ.17 毒株相似性高達 99.2%~100.0%[51]。
諾如病毒感染人體所需的劑量極低(18~2800個拷貝數)[52],根據本文的研究結果,廣州市售牡蠣中諾如病毒含量達到1.56×103~1.09×106copies/g(消化腺),因此食用時加工不徹底或者直接生食牡蠣,存在較大的諾如病毒感染風險。
4 結論
貝類是全球重要的經濟水產品,同時也是食源性諾如病毒傳播的重要載體。通過對市售牡蠣中諾如病毒污染狀況的監測研究,發現GII型諾如病毒陽性檢出率達52.7%,且GII.4型為優勢基因型,與病毒的臨床流行存在緊密聯系。因此,直接食用未加工或加工不徹底的市售貝類仍存在較大食品安全風險。本研究建議持續加強貝類中食源性病毒污染的長期監測工作,將有助于進一步推動我國貝類產業的良性發展,保障民眾健康。

