基于項目式學習培養化學宏微素養的實踐研究
——以“氣體摩爾體積”為例
龔翠萍 上海市川沙中學
新課程改革背景下,教學活動的設計更加注重化學學科核心素養的培養。在此階段應用項目式學習方法,通過創設情境,設置目標,提出問題,以制定項目任務的方式,讓學生主動參與探究和解決問題的活動,提交項目成果,并進行學習效果的檢測和項目活動的評價與改進,可以有效提升學生的學習興趣,培養學生的化學學科核心素養。
化學學科核心素養中的“宏觀辨識與微觀探析”,是化學研究物質及其變化的獨特視角。在化學學習中,學生應盡可能地將宏觀和微觀結合起來,從微觀本質上理解和思考宏觀現象和變化。新課程新教材強調教學過程是師生交往、共同發展的互動過程。在教學過程中以問帶學,通過問題鏈,處理好傳授知識與培養能力的關系,注重學生的獨立性和自主性的培養。引導學生觀察、質疑、探究,在實踐中學習,使學習成為在教師指導下主動的、富有個性的過程。
一、教學背景分析
(一)教材分析
在中學階段的基本概念和基礎理論知識中,《氣體摩爾體積》這一專篇占有重要地位,對學好化學計算、掌握氣體性質起著十分關鍵的作用,也是中學化學教學的重點和難點之一。中學化學許多反應都會涉及到氣體,若要進行定量分析,運用氣體摩爾體積不僅能簡化計算,給化學研究帶來方便,同時也能為以后學習有關氣態反應物和生成物的化學方程式計算、化學反應速率、化學平衡提供必備的基礎知識。
(二)學情分析
氣體摩爾體積是一個抽象的概念,需要學生從以前的“以質量為核心”向現在的“以物質的量為核心”及時轉變。實際上,大部分學生對固體、液體、氣體只有感性上的認識,卻很少關注物質的三態在微觀上的異同。好在高一學生具備了一定的探究意識和觀察能力、分析能力、數據處理能力,這些都為更好地學習氣體摩爾體積做好了鋪墊。
二、教學設計
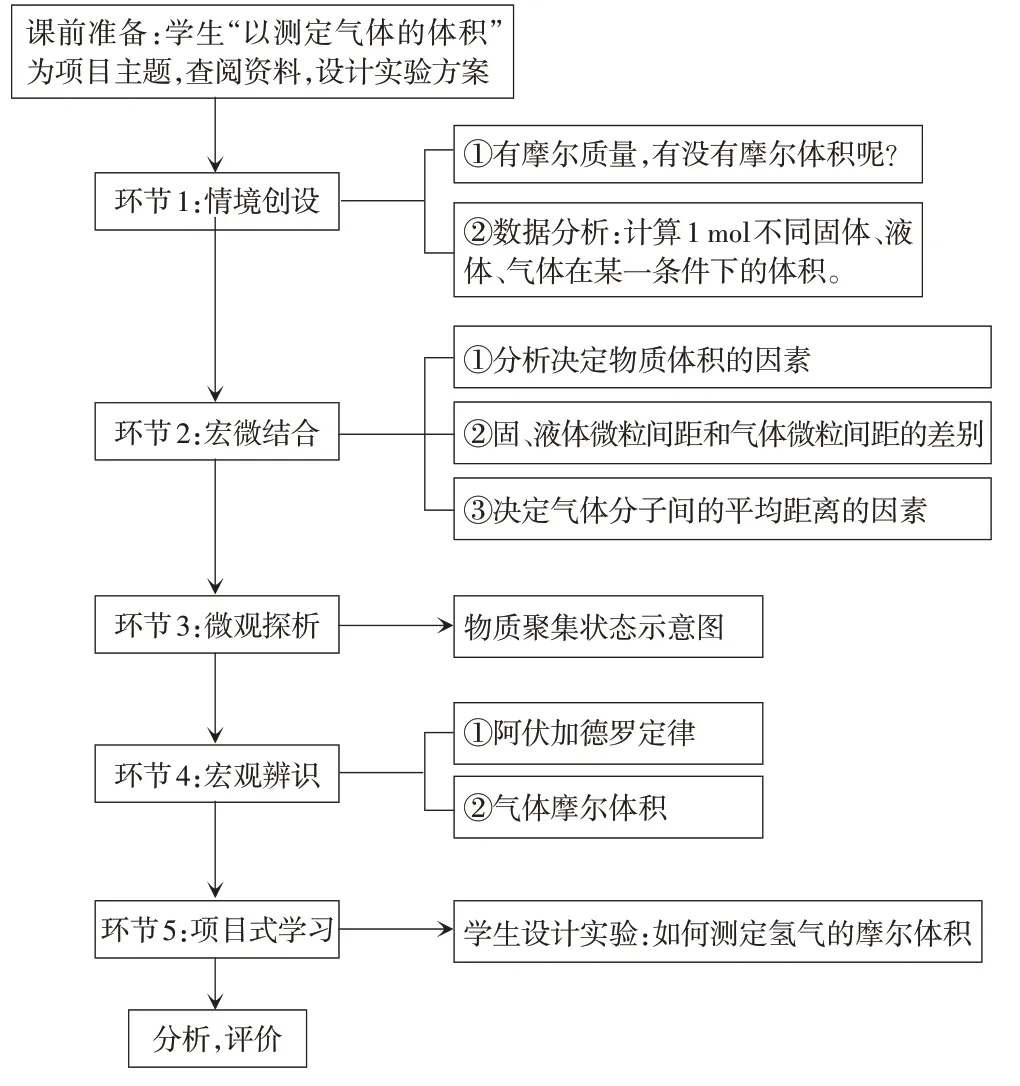
圖1
三、基于項目式學習的教學實施
(一)創設問境,滲透宏微結合的雙向培養(見表1)
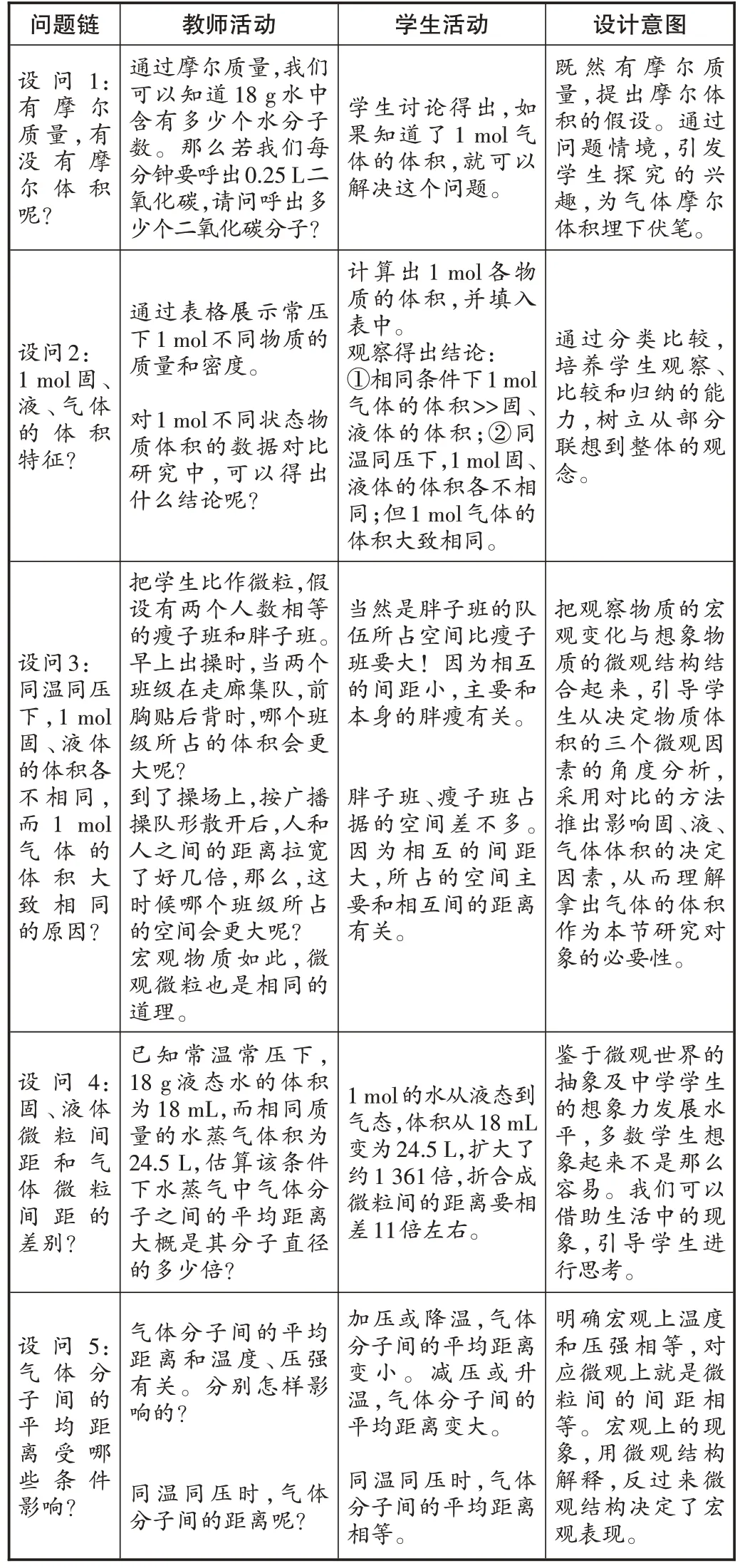
表1
(二)直觀展示,強化微觀探析素養的培養
【環節1】1 mol氣體的體積〉〉1 mol固、液體的體積

圖2 物質聚集狀態的示意圖
設計意圖:借助物質聚集狀態的示意圖,我們可以知道,氣體微粒間的距離遠大于固、液體微粒間的距離,所以當微粒數目都為1 mol 時,氣體的體積一定遠大于固、液體的體積。引導學生從固、液、氣體的微觀結構角度去解釋。
【環節2】有氣體摩爾體積,而沒有固、液體摩爾體積
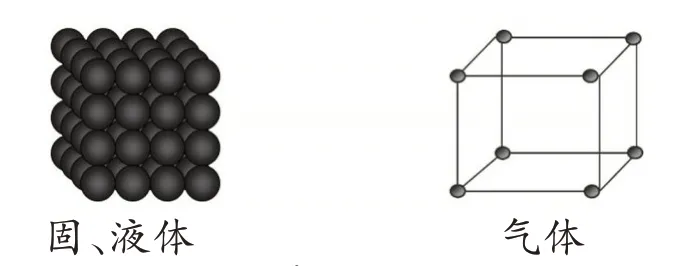
圖3
設計意圖:引導學生從圖示進一步體會固、液體微粒間距小,摩爾體積受微粒的大小影響,沒有定值,故沒有固、液體摩爾體積。氣體的摩爾體積受分子間距離的影響,因為分子間距在同溫同壓下是定值,故有氣體摩爾體積。
【環節3】阿伏加德羅定律中應用對象的說明
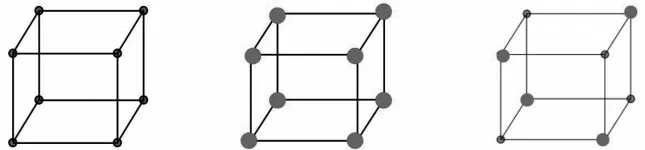
圖4
設計意圖:由圖可知,氣體分子間的距離遠遠大于分子直徑,故分子本身的大小可以忽略不計。所以這里的“任何氣體”,可以是單一氣體或混合氣體。通過直觀展示,更利于學生理解微觀結構影響宏觀現象。
(三)證據推理,鞏固宏觀辨識素養的培養
【環節1】建立阿伏加德羅定律
【教師】1 mol的氣體,微粒數相等,體積主要和微粒間距有關。同溫同壓下,由于不同的氣體分子間的距離相等,因此1 mol的氣體其體積相同。反過來,同溫同壓下,若兩種氣體的體積相同,則它們的分子數是什么關系?
【學生】它們的分子數一定相等。
【教師】引出阿伏加德羅定律。關注到“同”這一詞,前面的“三同”是條件,最后的“一同”是結論。
設計意圖:氣體運動規律是氣體所占體積的內因,外界條件是氣體所占體積的外因。外因通過內因起作用,內因是事物變化的根據。通過分析,使學生理解內因和外因的辯證關系。進一步幫助學生通過宏觀認識進行微觀探析,培養化學學科核心素養。
【環節2】建立氣體摩爾體積
【教師】通過概念辨析,明確1 mol的氣體,在同溫同壓下的體積是相等的。從而引出氣體摩爾體積的概念:一定溫度和壓強下,每摩爾氣體所具有的體積。
【教師】在標準狀況下,Vm=22.4 L·mol-1。那么只有在標準狀況下,氣體摩爾體積才等于22.4 L·mol-1嗎?
【學生】標準狀況只是定了氣體分子間距,氣體摩爾體積數值可以有很多,在確定的溫度和壓強下是定值。所以在非標準狀況下,氣體摩爾體積也可以是22.4 L·mol-1。
設計意圖:從標準狀況推廣到任一溫度和壓強,再次強調宏觀上一定的溫度和壓強決定了微觀上的微粒間距,即當溫度和壓強確定后,分子間的平均距離就是定值,只要粒子數確定,即體積確定。
(四)項目式學習,發展宏微結合素養的培養
1.項目介紹
1 mol 任何氣體的體積在同溫同壓下是相等的,在273 K和101 kPa時約為22.4 L。
布置任務:請你設計實驗測定一定條件下1 mol 氫氣的體積。
2.活動目標
(1)明確測定一定溫度和壓強下氣體摩爾體積的方法。
(2)學會測定1 mol氣體體積的實驗操作
(3)知道實驗誤差的形成和實驗相對偏差的計算
3.自主研究
活動1:學生小組討論,確定反應原理
問題1:制備氫氣的原理是什么?
問題2:反應物的選擇,相較于初中使用鋅粒與酸反應制備氫氣,為什么選擇鎂帶?
問題3:實驗時對硫酸的濃度有沒有要求?將硫酸換成鹽酸你認為是否合理?
小結:確定通過鎂和稀硫酸反應生成氫氣。
活動2:學生查閱資料,選擇反應裝置
問題1:實驗時一般不會直接用1 mol 的氣體進行測量,原因主要是什么?
問題2:通過反應物和生成物物質的量之間的關系,可以借由稱量固體物質的質量,等效替代氫氣的物質的量嗎?
問題3:生成的氫氣可用排水法收集在什么容器中?
問題4:測定氣體的體積,為什么要標明溫度和壓強?
小結:選擇電子天平稱量鎂帶質量,Y 形管、量氣管和水準管組合來測定反應中產生的氫氣的體積。
活動3:學生小組交流,設計反應路徑
問題1:化學定量實驗對實驗數據有何要求?為了達到這樣的要求,在實驗的設計上需要充分考慮哪些問題?
問題2:實驗時,稱取的鎂帶質量為何控制在0.015 0 g~0.025 0 g?
問題3:裝配好化學反應氣體體積測定裝置后,怎樣進行氣密性檢查?
問題4:讀量氣管刻度數據時,為何每次都需要先調節兩邊液面相平?
問題5:氫氣的體積怎么算?
小結:根據實驗裝置的設計,各小組交流實驗步驟,完善實驗方案。
活動4:學生實施項目,記錄實驗數據
學生小組實驗,測定并記錄常溫常壓下產生的氫氣的體積,進行數據處理,換算出1 mol 氫氣的體積,并能通過教師提供的實驗溫度下1 mol 氫氣體積的參考值,計算相對偏差。
教師盡可能多地收集全班同學的實驗數據,對這些數據進行對比,了解所有學生實驗數據的一致性情況及與參考值的偏差情況。
4.項目評價
(1)裝置的選擇
教師通過分析直接測量氣體體積的裝置(圖5)和排水法測量氣體體積的裝置(圖6)的利弊,引發學生討論自己的設計中有什么問題,嘗試進一步完善各小組設計方案,最后引出測定1 mol氫氣體積的正確裝置(圖7)。
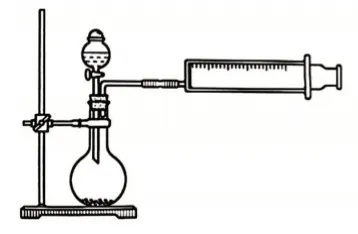
圖5
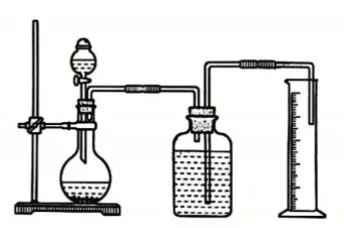
圖6

圖7
(2)實驗誤差分析
實驗偏差有的來自儀器裝置自身或試劑的品質,有的來自操作的不當。定量測定的偏差允許在一個范圍內存在。通過收集全班同學的實驗數據后,對測定結果與參考值偏差很大的情況,引導學生回顧自己的實驗過程,分析產生誤差的可能原因。
四、教學反思
開展項目式學習培養化學宏微素養的實踐研究表明:
1.有助于學生化學學科核心素養“宏觀辨識與微觀探析”的培養。教學中不斷設“障”立“疑”,顯性地為學生提供微觀與宏觀之間的雙向思維路徑,有助于培養學生的微觀想象能力,用微粒的觀念去學習的習慣。只有合理地建構了微粒觀,才能使學生用科學的觀點理解宏觀事物及其變化,做出正確的判斷,也就相應地提升了學生的素質。
2.項目式學習能夠促進學生學習態度的轉變,激發學生學習興趣。能提高學生綜合能力和實驗認知能力,培養學生實驗操作能力,促進學生實驗態度的轉變,提升實驗思維。在小組合作時,學生能親身體驗成功,讓學生的自我效能感倍增,不僅能增強學生的學習自信心,更為學生化學學科核心素養的發展創設了重要的條件。
3.有助于把教學活動的重心從“教”轉移到“學”上,把教師的職能重心從“授”轉移到“導”上,把教學目標的重心從單純的知識傳授轉移到能力培養、智力開發上,這才與新課程中教與學要求相吻合。當教師從知識的傳遞者變成學生學習的促進者、組織者和指導者,就會極大地調動起學生學習的積極性和主動性,培養學生的問題解決意識,這與新課改目標和諧統一。

