G-四鏈體與染色質(zhì)結(jié)構(gòu)相互作用關(guān)系的研究進展
楊 婧,侯 越,2,舒慧靈,孫 嘯*
(1.東南大學生物科學與醫(yī)學工程學院生物電子學國家重點實驗室,中國江蘇 南京 210096;2.西安交通大學生命科學與技術(shù)學院生物醫(yī)學信息工程教育部重點實驗室,中國陜西 西安 710049)
G-四鏈體(G-quadruplex,G4)是一種特殊的核酸二級結(jié)構(gòu),多形成于富含鳥嘌呤的DNA或RNA序列中。G4結(jié)構(gòu)首次被發(fā)現(xiàn)于體外環(huán)境,廣泛存在于基因組,通常標志著具有調(diào)控功能的染色質(zhì)區(qū)域,在生物體內(nèi)具有重要的調(diào)控功能,與染色質(zhì)結(jié)構(gòu)、表觀調(diào)控、基因組穩(wěn)定性、人類疾病等密切相關(guān)。
1910年,Bang[1]首次發(fā)現(xiàn)鳥嘌呤核苷酸在高濃度下能夠形成凝膠,這表明DNA中富含鳥嘌呤的序列可能形成更高階的結(jié)構(gòu)。1962年,Gellert等[2]使用X射線衍射實驗證明,鳥嘌呤可以組裝成四聚體結(jié)構(gòu)。隨著高通量測序技術(shù)的發(fā)展,G4檢測技術(shù)經(jīng)歷了從體外到體內(nèi)檢測的發(fā)展過程。2015年,劍橋大學Balasubramanian團隊提出G4-seq[3]方法,并利用該方法在人類基因組水平上得到了超過70萬個能夠在體外形成G4的序列。為探索G4結(jié)構(gòu)在內(nèi)源性染色質(zhì)環(huán)境中是否真實形成,該團隊在2018年提出了染色質(zhì)免疫沉淀測序方法(G4 ChIP-seq)[4],利用G4特異性抗體BG4,在K562細胞系中鑒定出了約8 000個能夠在體內(nèi)形成G4的序列。最近,中國科學院的研究團隊基于G4結(jié)合蛋白DHX36的結(jié)合結(jié)構(gòu)域,設(shè)計出一種人工G4探針蛋白[5],結(jié)合ChIP-seq技術(shù),在A549細胞系中測得了超過10萬個G4結(jié)構(gòu)。基因組中眾多G4預示著G4可能具有復雜的生物學功能,如表觀調(diào)控、與染色質(zhì)的相互作用等。
G4在多個層次與染色質(zhì)結(jié)構(gòu)存在相互作用,包括染色質(zhì)可及性、染色質(zhì)局部修飾狀態(tài)和染色質(zhì)全局空間構(gòu)象等。染色質(zhì)是由核小體壓縮折疊形成的高級結(jié)構(gòu),當DNA復制、轉(zhuǎn)錄等生物學過程發(fā)生時,致密的核小體結(jié)構(gòu)將會被破壞,染色質(zhì)由緊密變?yōu)殚_放的狀態(tài),這段區(qū)域即被稱為開放染色質(zhì)(open chromatin),這種允許調(diào)控蛋白與之結(jié)合的特性稱為染色質(zhì)的可及性(chromatin accessibility)。G4與核小體缺失及染色質(zhì)開放結(jié)構(gòu)存在著密切的聯(lián)系[6],同時,G4也可能招募蛋白質(zhì)因子進行染色質(zhì)修飾,包括DNA甲基化和組蛋白修飾[7]。我們前期的研究結(jié)果也表明,G4對染色質(zhì)空間構(gòu)象有影響[8],染色質(zhì)空間構(gòu)象包括染色質(zhì)環(huán)結(jié)構(gòu)、染色質(zhì)拓撲關(guān)聯(lián)域(topologically associating domain,TAD)及染色質(zhì)區(qū)室結(jié)構(gòu)。
本文將從3個方面詳細討論G4與染色質(zhì)結(jié)構(gòu)的相互作用關(guān)系,包括:G4在開放染色質(zhì)區(qū)域的富集現(xiàn)象,G4通過招募功能蛋白質(zhì)調(diào)控染色質(zhì)局部區(qū)域的表觀修飾,以及G4對染色質(zhì)空間結(jié)構(gòu)的影響。
1 G4結(jié)構(gòu)及其生物學功能
G4結(jié)構(gòu)由多個G-四分體(G-tetrad)平面構(gòu)成,G-四分體是G4序列中的鳥嘌呤(G)互相作用形成的穩(wěn)定的平面正方形陣列,通過Hoogsteen氫鍵堿基相互配對[9],三層及三層以上的G-四分體堆疊即形成穩(wěn)定的G4結(jié)構(gòu)(圖1)。每個鳥嘌呤的電負性羧基指向平面中心,可以容納一價金屬陽離子(M+)以穩(wěn)定G4結(jié)構(gòu)[9](圖1左)。其中,K+的作用最為明顯,人體富含K+、Na+離子的生理環(huán)境有利于G4結(jié)構(gòu)形成[10]。
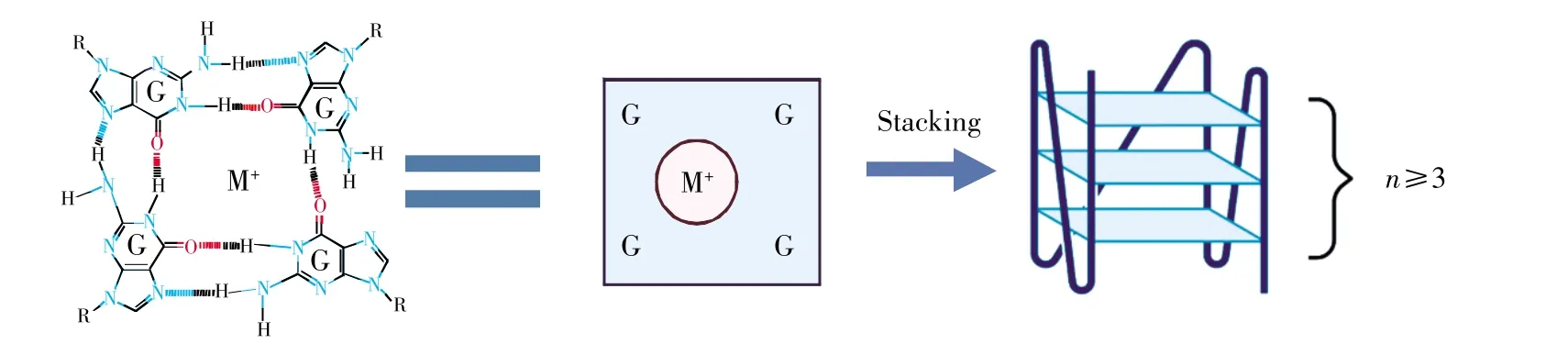
圖1 G-四鏈體結(jié)構(gòu)示意圖(使用BioRender繪圖)從左至右分別為G-四分體的化學結(jié)構(gòu)式示意圖、G-四分體的簡化示意圖和G4結(jié)構(gòu)示意圖。“n”為G-四分體的個數(shù)。Fig.1 G4 structure diagram(created with BioRender)From left to right are diagram of the chemical structure of G-tetrads,simplified diagram of G-tetrads,and diagram of G4 structure.“n”is the number of G-tetrads.
G4結(jié)構(gòu)具有多種拓撲結(jié)構(gòu)[11](圖2),根據(jù)DNA鏈的方向可分為平行結(jié)構(gòu)、反向平行結(jié)構(gòu)和雜合結(jié)構(gòu)。此外,G4結(jié)構(gòu)可以形成于單鏈DNA內(nèi)部(intramolecular)或幾條鏈之間(intermolecular),同時也能夠形成各種環(huán)狀結(jié)構(gòu)(loop structures)。結(jié)構(gòu)參數(shù)和外在因素如化學修飾[12]、分子聚集[13]等,會直接影響G4分子結(jié)構(gòu)的幾何形態(tài)和構(gòu)象,使其表現(xiàn)出廣泛性和多樣性。
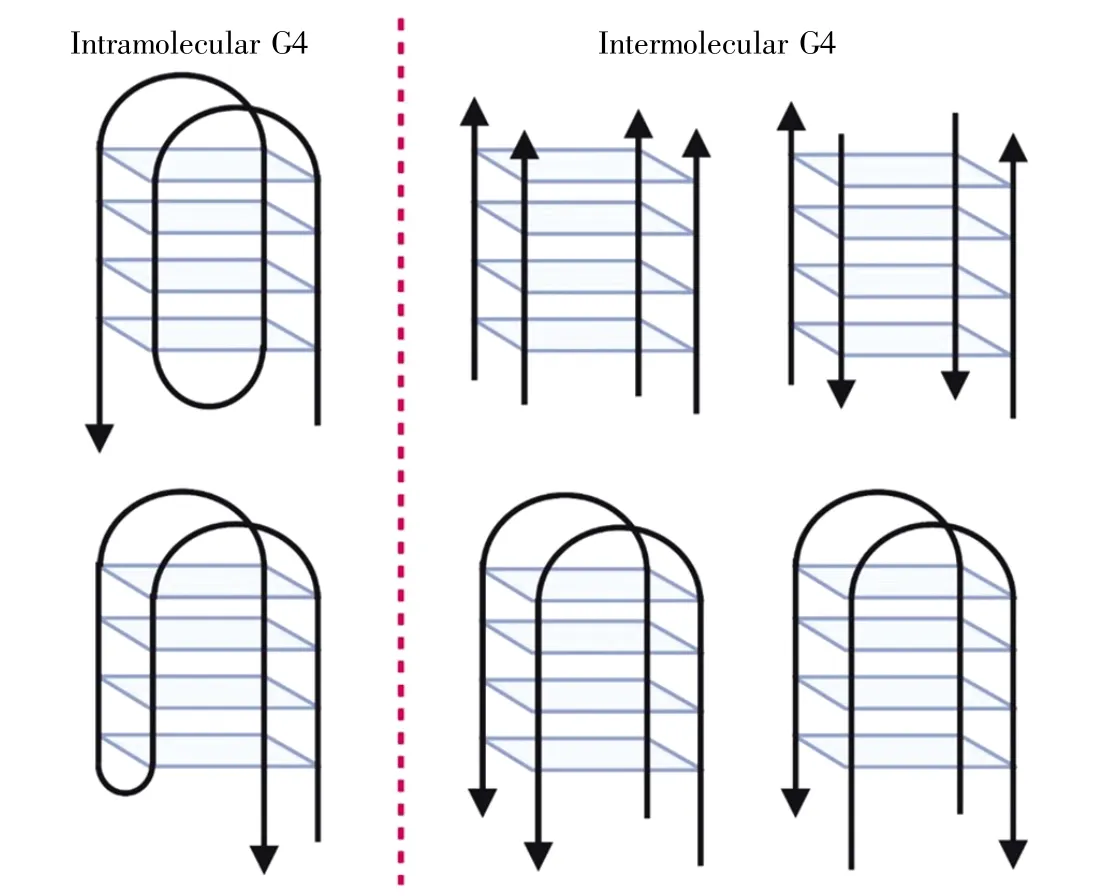
圖2 分子內(nèi)G-四鏈體(左)和分子間G-四鏈體(右)的結(jié)構(gòu)示意圖(參照文獻[11],使用BioRender繪圖)Fig.2 Intramolecular G4(left)and intermolecular G4(right)structure diagrams(created with BioRender,according to Reference[11])
GxN1~7GxN1~7GxN1~7Gx是可能形成 G4 結(jié)構(gòu)的模式序列(G4 motif)。“N”表示堿基“ATCGU”中的一個,長度范圍為1至7,稱為環(huán)(loop);序列中G的數(shù)目“x”大于等于3,稱為莖(G-tract)。但隨著研究的深入,研究人員發(fā)現(xiàn)G4序列存在很多特例,結(jié)構(gòu)也可以更加靈活,如在莖的長度大于3的體外環(huán)境下,環(huán)長可以達到30 nt[14];G莖上的堿基可以發(fā)生凸起或錯配[15],從而增加G4序列和結(jié)構(gòu)的復雜性。序列分析結(jié)果表明,人類基因組包含的G4序列超過30萬個[16]。G4序列具有形成G4的潛力,因此也將其稱為PG4(potential G-quadruplex)[11]。
G4在端粒維持、DNA復制和轉(zhuǎn)錄調(diào)控等生物學過程中發(fā)揮著重要作用。早期針對G4功能的研究主要集中在端粒區(qū)域,端粒由3′端尾部富含鳥嘌呤的單鏈DNA區(qū)和雙鏈區(qū)組成,這兩個區(qū)域都極易形成G4結(jié)構(gòu)。G4會影響端粒酶活性,端粒區(qū)域形成的反向平行G4可以阻礙端粒延伸[17],進而阻止癌細胞持續(xù)增殖分裂,因此G4可作為靶點進行癌癥治療,并由此引申出了G4的小分子配體的研究,用以結(jié)合和穩(wěn)定體內(nèi)G4[18]。G4在DNA復制中有雙重作用:一方面是可以作為復制的障礙導致突變基因組的不穩(wěn)定性增加,另一方面是后生動物復制起源的組成部分[10]。G4結(jié)構(gòu)在啟動子、增強子等調(diào)控區(qū)域的富集,可能對基因表達產(chǎn)生正向或負向的影響,從而引發(fā)轉(zhuǎn)錄組的改變。例如:Siddiqui-Jain等[19]最早對致癌基因c-MYC的研究表明,G4序列的突變或G4穩(wěn)定配體的添加會影響體內(nèi)轉(zhuǎn)錄事件;華盛頓大學的團隊針對人類細胞的基因組分析表明,轉(zhuǎn)錄解旋酶XPB和XPD(xeroderma pigmentosum group B and D genes)與G4序列明顯重疊,XPB和XPD能夠結(jié)合G4,且XPD還能夠解旋G4,因此它們可能被招募到G4結(jié)構(gòu)上幫助其完成轉(zhuǎn)錄[20]。此外,G4結(jié)合蛋白也會影響轉(zhuǎn)錄,如核仁蛋白與c-MYC NHE Ⅲ1元件的結(jié)合能夠誘導G4折疊,并降低癌基因c-MYC的轉(zhuǎn)錄水平[21]。
深入了解G4與染色質(zhì)結(jié)構(gòu)信息之間的關(guān)聯(lián),認識G4與染色質(zhì)結(jié)構(gòu)的相互作用,有助于理解G4的生物學功能。圖3概括了G4與染色質(zhì)結(jié)構(gòu)的相互作用關(guān)系,從染色質(zhì)的線性結(jié)構(gòu)、表觀調(diào)控和空間結(jié)構(gòu)方面展示了G4結(jié)構(gòu)對染色質(zhì)結(jié)構(gòu)的影響。在染色質(zhì)線性結(jié)構(gòu)方面,G4主要表現(xiàn)為在染色質(zhì)開放區(qū)域的富集(圖3A);在表觀調(diào)控方面,G4通常通過招募蛋白質(zhì)因子調(diào)控或影響表觀調(diào)控(圖3B~C);在染色質(zhì)空間結(jié)構(gòu)方面,G4能夠影響染色質(zhì)空間分割能力和遠程相互作用(圖3D)。
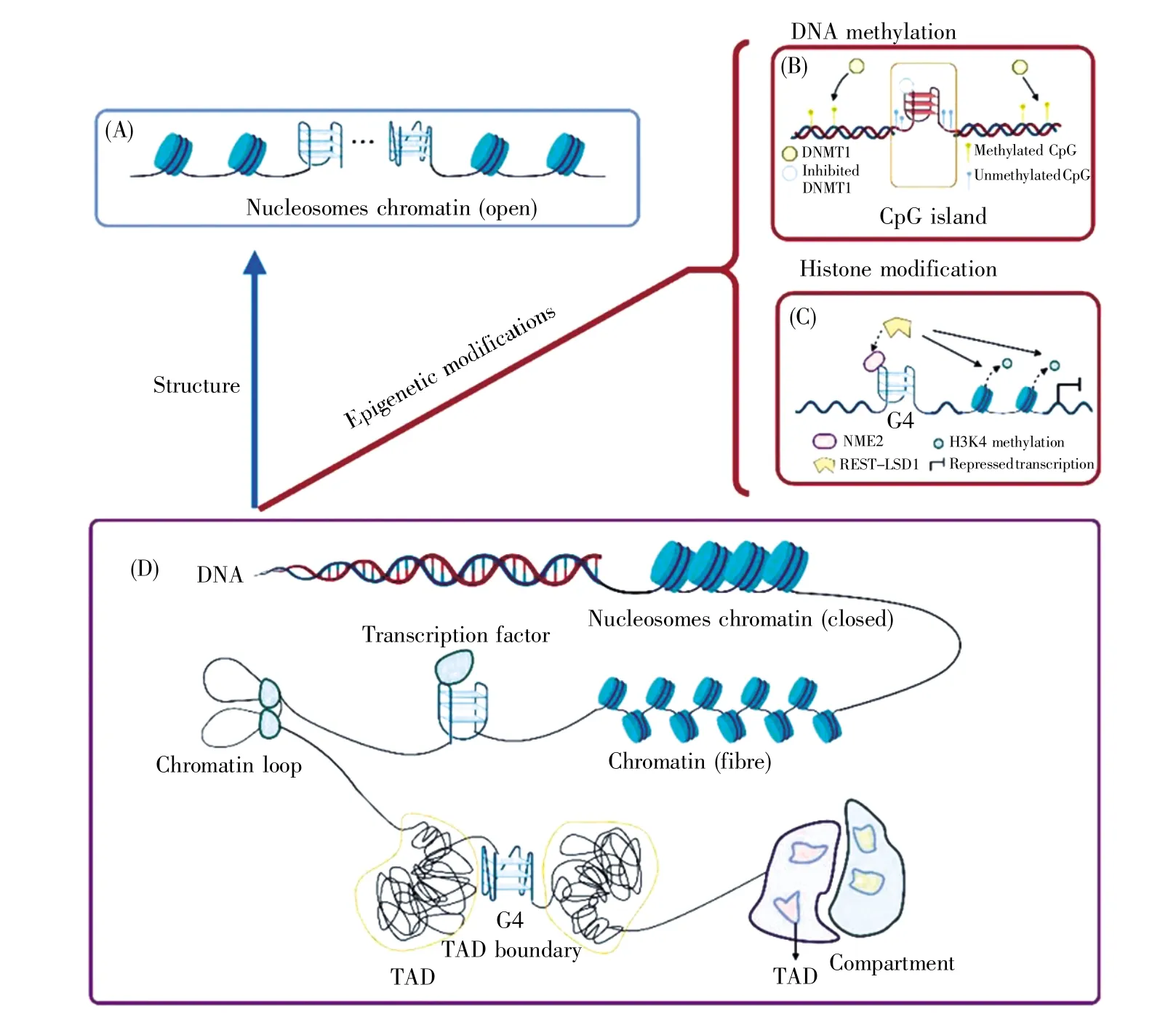
圖3 G-四鏈體與染色質(zhì)結(jié)構(gòu)的相互作用關(guān)系(使用BioRender繪圖)(A)G4在染色質(zhì)開放區(qū)域內(nèi)有富集現(xiàn)象;(B)CpG島上的G4能夠招募DNMT1并抑制其活性,調(diào)控DNA甲基化水平;(C)hTERT啟動子上的NME2依賴G4結(jié)構(gòu)招募阻遏復合物REST-LSD,去除H3K4甲基化,抑制基因表達;(D)染色質(zhì)空間結(jié)構(gòu)示意圖。G4與轉(zhuǎn)錄因子相互作用有助于染色質(zhì)環(huán)的形成;G4在TAD邊界顯著富集,影響TAD邊界的分割能力。Fig.3 Interaction between G4 and chromatin structure(created with BioRender)(A)G4 is enriched on the open region of chromatin;(B)G4 on CpG islands can recruit DNMT1,inhibit its activity and regulate the level of DNA methylation;(C)NME2 on the hTERT promoter relies on the G4 structure to recruit the repressor complex REST-LSD,remove H3K4 methylation and inhibit gene expression;(D)Schematic diagram of the spatial structure of chromatin.G4 interacts with transcription factors to contribute to the formation of chromatin loops.The significant enrichment of G4 at the TAD boundary indicates that G4 can affect the segmentation ability of the TAD boundary.
2 G4-DNA與染色質(zhì)開放結(jié)構(gòu)之間的關(guān)系
開放染色質(zhì)區(qū)域具有轉(zhuǎn)錄活性,與基因表達調(diào)控過程密切相關(guān)。已有研究證明,G4能夠影響基因轉(zhuǎn)錄調(diào)控功能[16],因此G4必定與染色質(zhì)開放結(jié)構(gòu)存在關(guān)聯(lián)。
由于G4-DNA檢測技術(shù)復雜,成本高,早期G4-DNA相關(guān)研究多采用PG4作為研究對象。2006年,Segal等[22]觀察了核小體占位率(nucleosome occupancy probability,NOP)與PG4的分布,發(fā)現(xiàn)與低NOP區(qū)域相比,高NOP區(qū)域的PG4基序密度較低。2009年,Halder等[6]繪制了全基因組尺度下PG4以及核小體在1號染色體中的分布,結(jié)果顯示PG4密度高的區(qū)域常表現(xiàn)出對核小體的排斥,且核小體和PG4很少有重疊,其他染色體中也存在相似的情況。由此可知,PG4基序與核小體存在競爭關(guān)系。染色質(zhì)的調(diào)控區(qū)域以核小體缺失為特征,這使得調(diào)控基因轉(zhuǎn)錄、復制和表觀遺傳的蛋白質(zhì)得以進入開放染色質(zhì)區(qū)域。根據(jù)PG4基序與核小體存在競爭關(guān)系的結(jié)論,以及PG4具有形成G4的可能性,可以推測出G4與染色質(zhì)開放區(qū)域必然存在某種特定的關(guān)聯(lián)。
2016年,Balasubramanian團隊著手闡明人類細胞中G4結(jié)構(gòu)和染色質(zhì)開放性之間的關(guān)系[23]。研究人員通過G4 ChIP-seq技術(shù)繪制了HaCaT細胞染色質(zhì)中G4結(jié)構(gòu)的全基因組位置圖,并利用測序技術(shù)ATAC-seq/FAIRE-seq繪制了染色質(zhì)開放區(qū)域。結(jié)果顯示,G4 ChIP-seq峰的98%與ATAC-seq和FAIRE-seq確定的區(qū)域重疊,這說明在染色質(zhì)開放區(qū)域,即核小體缺失區(qū)域,存在G4結(jié)構(gòu)的富集現(xiàn)象(圖3A)。這預示著,G4結(jié)構(gòu)的穩(wěn)定形成能夠阻礙核小體組裝,因此有利于染色質(zhì)局部排斥核小體以保持開放構(gòu)象,并增強轉(zhuǎn)錄起始和轉(zhuǎn)錄速率。
2020年,中國科學院的研究團隊使用G4結(jié)合蛋白探針及G4-ChIP測序技術(shù),探究了轉(zhuǎn)錄起始位點(transcription start site,TSS)功能區(qū)域的G4形成,發(fā)現(xiàn)G4集中在TSS的兩側(cè),與其他功能區(qū)域相比,TSS功能區(qū)域能夠形成更多穩(wěn)定的G4[5],這意味著在轉(zhuǎn)錄驅(qū)動的啟動子中,G4的形成更為活躍和穩(wěn)定。上述結(jié)果提示,轉(zhuǎn)錄過程與G4的形成可能是相互影響的。
G4在染色質(zhì)開放區(qū)域的富集阻礙了核小體的組裝形成,使局部染色質(zhì)結(jié)構(gòu)能夠保持開放狀態(tài),從而使與基因表達調(diào)控相關(guān)的蛋白質(zhì)因子得以進入染色質(zhì)開放區(qū)域發(fā)揮作用,增強轉(zhuǎn)錄起始和轉(zhuǎn)錄速率,G4在TSS功能區(qū)域兩側(cè)的穩(wěn)定形成也證實了G4與轉(zhuǎn)錄過程的關(guān)聯(lián)關(guān)系。
3 G4-DNA與染色質(zhì)狀態(tài)之間的關(guān)系
G4能夠作用于DNA甲基化及組蛋白修飾,引起染色質(zhì)結(jié)構(gòu)、DNA構(gòu)象、DNA穩(wěn)定性及DNA與蛋白質(zhì)相互作用方式的改變,從而調(diào)控表觀遺傳修飾。
2016年,奧塔哥大學的Cree等[24]首次在體外環(huán)境下測量了G4對DNA甲基轉(zhuǎn)移酶1(DNA methyltransferase 1,DNMT1)、DNMT3A、DNMT3B 的親和力。表面等離子共振分析結(jié)果表明,G4與DNMT3A和DNMT3B具有較高的親和力,其親和力與其他已知的G4結(jié)合蛋白相當,表明G4在DNA甲基化過程中可以通過調(diào)控甲基轉(zhuǎn)移酶來發(fā)揮作用。DNMT3A和DNMT3B的N末端調(diào)節(jié)區(qū)均包含1個ADD域和1個PWWP域。已有研究證明,含有ADD域的ATRX蛋白能夠與G4相互作用[25]。上述分析提示,DNMT3A/B可能通過ADD域與G4結(jié)構(gòu)結(jié)合從而發(fā)揮作用,但DNMT是通過何種方式調(diào)控DNA甲基化的還需要進一步研究。
2018年,Balasubramanian團隊提出了G4對DNA甲基化的重塑作用[7]。實驗通過全基因組重亞硫酸鹽測序(whole genome bisulfite sequencing,WGBS)方法對K562細胞系的甲基化水平進行了全面表征,并利用G4 ChIP-seq方法生成G4的全基因組數(shù)據(jù)庫,比較了BG4峰(即G4位點)與CpG島的重疊部分,發(fā)現(xiàn)大部分BG4峰與CpG島重疊,即大部分G4形成在低甲基化水平的CpG島區(qū)域,同時實驗人員注意到BG4峰的區(qū)域表現(xiàn)出顯著的甲基化缺失,這有力地證明了CpG島的低甲基化現(xiàn)象與G4結(jié)構(gòu)密切相關(guān)。為了探究DNMT與G4之間是否有某種形式的相互作用,Balasubramanian團隊以DNMT1為研究對象,探究DNMT1與CpG島的低甲基化是否存在關(guān)聯(lián),發(fā)現(xiàn)DNMT1在低甲基化水平的CpG島上顯著富集,形成雙峰的分布模式,隨后研究人員使用酶聯(lián)免疫吸附分析實驗(ELISA)證實,G4具有結(jié)合DNMT1的能力。因此,G4可能通過識別并結(jié)合DNMT1,在CpG島局部隔絕DNMT1,導致特定基因組位點的甲基化缺失(圖3B)。
2020年,Jara-Espejo等[26]分析了PG4與CpG島低甲基化的關(guān)聯(lián),并確定了可能調(diào)節(jié)這種現(xiàn)象的PG4的內(nèi)在和外在特性。實驗人員使用全基因組甲基化數(shù)據(jù)探索了PG4在CpG島上的作用,發(fā)現(xiàn)PG4對甲基化的作用是由穩(wěn)定性、位置和染色質(zhì)可及性驅(qū)動的:開放染色質(zhì)中的高穩(wěn)定性PG4具有高轉(zhuǎn)錄活性和形成潛能,可更有效地促進低甲基化。
G4還會影響組蛋白修飾。人類端粒結(jié)合蛋白能夠結(jié)合體內(nèi)端粒重復RNA上的G4和體外DNA上的G4,從而招募對端粒和亞端粒異染色質(zhì)維持起重要作用的組蛋白甲基轉(zhuǎn)移酶,促進端粒的組蛋白三甲基化[27]。端粒的表觀遺傳修飾與端粒長度調(diào)節(jié)和端粒相關(guān)疾病的發(fā)生發(fā)展過程及衰老密切相關(guān),對于基因組的完整性至關(guān)重要,因此,G4調(diào)控端粒表觀遺傳修飾的研究有助于端粒生物功能及作用機制的研究。
相關(guān)研究報道,人類端粒酶逆轉(zhuǎn)錄酶(human telomerase reverse transcriptase,hTERT)依賴于G4結(jié)構(gòu)的啟動子的轉(zhuǎn)錄抑制,該途徑通過腫瘤轉(zhuǎn)移抑制因子NME2(metastasis suppressor non-metastatic 2)招募RE1沉默轉(zhuǎn)錄因子-賴氨酸特異性組蛋白脫甲基酶1(RE1-silencing transcription factor-lysine-specific histone demethylase 1,RESTLSD1)阻遏復合物,去除組蛋白H3K4激活基因的單甲基化和二甲基化(即H3K4me1和H3K4me2),并抑制hTERT基因表達[28](圖3C)。hTERT在90%的腫瘤細胞中表達,但在絕大多數(shù)正常細胞中不表達[29],因此,依賴于G4與NME2的抑制hTERT基因表達的機制,能夠為癌癥提供新的治療思路,有助于開辟控制癌細胞中hTERT激活的潛在方法。
G4不僅能夠直接影響表觀遺傳修飾,還能夠間接影響組蛋白修飾的遺傳。G4會阻遏復制發(fā)生,因此在復制時需要解旋酶解開G4結(jié)構(gòu),然而當G4結(jié)構(gòu)的解旋暫時延遲時,響應(yīng)的基因組區(qū)域被繞過,導致新合成的組蛋白無法遺傳親本修飾[30],從而破壞表觀修飾的局部遺傳。
由此可見,G4結(jié)構(gòu)對染色質(zhì)狀態(tài)的影響是多層次、多方面的,二者相互關(guān)聯(lián)、相互影響。因此,G4對生物學過程和表觀遺傳修飾的影響是復雜多樣的。
4 G4-DNA與染色質(zhì)空間結(jié)構(gòu)的相互作用
大量證據(jù)表明,G4的形成會排斥核小體的定位,G4與染色質(zhì)的基本結(jié)構(gòu)和狀態(tài)都有關(guān)聯(lián),但G4與高階基因組組織之間的關(guān)系仍然未知。有研究報道,G4可能參與遠距離交互,如在裂殖酵母中,Rif1蛋白能夠結(jié)合G4,使染色質(zhì)在細胞核纖層形成環(huán)及局部染色體室,并抑制長距離復制[31];位于乳腺和宮頸惡性腫瘤中的長序列G4(long G4,LG4)斷裂會導致基因組融合[32]。
本研究組近期針對K562細胞系的Hi-C[33]及G4 ChIP-seq數(shù)據(jù)集進行了計算分析,結(jié)果表明,G4有助于定義被稱為拓撲結(jié)構(gòu)域(TAD)的更高層次的染色質(zhì)域[8]。我們觀察到G4在TAD邊界高度富集的現(xiàn)象(圖3D),并發(fā)現(xiàn)染色質(zhì)結(jié)構(gòu)蛋白(該蛋白質(zhì)對TAD形成起重要作用)在TAD邊界周圍高度富集。TAD邊界富集大量的高表達基因,頻繁的轉(zhuǎn)錄事件能夠形成大量的單鏈DNA,有利于G4的形成,這可能是G4在TAD邊界富集的原因。同時,TAD邊界上染色質(zhì)結(jié)構(gòu)蛋白的含量與G4的含量呈正相關(guān)。因此,G4很可能通過影響TAD邊界區(qū)域染色質(zhì)結(jié)構(gòu)蛋白的結(jié)合,影響邊界-邊界作用和染色質(zhì)結(jié)構(gòu)。TAD邊界最重要的作用之一就是阻斷兩個TAD之間的相互作用,這一功能的實現(xiàn)主要取決于TAD邊界上大量的絕緣子CTCF。通過計算我們發(fā)現(xiàn),存在G4的區(qū)域的CTCF結(jié)合位點有更強的染色質(zhì)分割能力,即G4會影響TAD邊界的分割能力。此外,G4還能夠參與染色質(zhì)環(huán)的形成,正鏈上的G4序列顯著富集在正向CTCF序列上,負鏈上的G4序列則顯著富集在負向CTCF序列上。染色質(zhì)環(huán)的形成主要依賴于黏連蛋白識別CTCF序列方向性,但其機制仍不清楚,因此我們提出模型:正、負鏈上的G4可以分別富集在正、負向的CTCF序列周圍,它們可以阻礙黏連蛋白活動,從而參與染色質(zhì)成環(huán)。
我們的研究還選用實驗數(shù)據(jù)中的增強子和啟動子,分析了G4對染色質(zhì)的遠距離作用是否存在影響,通過計算我們發(fā)現(xiàn),包含G4的增強子-啟動子之間的相互作用頻率明顯高于不含G4的增強子-啟動子相互作用對,因此我們認為,G4可以通過特殊的結(jié)構(gòu)招募轉(zhuǎn)錄因子到增強子或啟動子區(qū),調(diào)節(jié)長程相互作用。
轉(zhuǎn)錄因子YY1(Yin Yang 1)是調(diào)控染色質(zhì)遠程相互作用的重要蛋白質(zhì)[34]。最近,美國加州大學通過實驗證實,G4能夠通過與YY1進行相互作用調(diào)節(jié)染色質(zhì)遠距離互作[35]。實驗人員通過無偏定量蛋白質(zhì)組學方法確定,轉(zhuǎn)錄因子YY1能夠在體內(nèi)與G4相互作用;通過對照實驗和Hi-C方法證實,YY1-G4相互作用有助于DNA環(huán)化以及遠程位點相互作用。
越來越多的證據(jù)表明,染色質(zhì)之間的相互作用能夠調(diào)節(jié)基因表達[36~37],即基因的表達調(diào)控存在高階結(jié)構(gòu)特性,基因表達可能被遠程調(diào)控。G4不僅與染色質(zhì)局部結(jié)構(gòu)有關(guān),同時也與更高維度的染色質(zhì)結(jié)構(gòu)相關(guān),參與調(diào)節(jié)遠程位點相互作用。
5 總結(jié)與展望
G4結(jié)構(gòu)廣泛分布于各種生物的基因組和轉(zhuǎn)錄組,它們總體上影響DNA二級結(jié)構(gòu)、核小體定位、組蛋白修飾以及染色質(zhì)的空間結(jié)構(gòu)等,繼而影響DNA復制、基因轉(zhuǎn)錄、染色質(zhì)構(gòu)象變化等生物學過程。
G4具有調(diào)節(jié)中心法則的每個步驟的潛力,其與染色質(zhì)結(jié)構(gòu)和狀態(tài)的關(guān)聯(lián)研究能夠揭示G4結(jié)構(gòu)與染色質(zhì)相互作用的原理,為我們理解G4在生物學過程中的功能提供幫助。G4在染色質(zhì)開放區(qū)域和核小體缺失區(qū)域呈現(xiàn)富集狀態(tài),當它們與基因轉(zhuǎn)錄調(diào)控區(qū)域重疊時,就會影響基因的轉(zhuǎn)錄調(diào)控。G4不僅能夠協(xié)同轉(zhuǎn)錄因子識別并隔絕DNMT1,導致關(guān)鍵基因組位點的甲基化缺失,從而影響轉(zhuǎn)錄過程,還能夠通過形成復合物并招募相關(guān)酶,影響組蛋白修飾,從而調(diào)控染色質(zhì)的表觀修飾。但染色質(zhì)并非簡單的線性模型,高度折疊和壓縮的空間結(jié)構(gòu)勢必對染色質(zhì)結(jié)構(gòu)和基因表達產(chǎn)生影響。從空間結(jié)構(gòu)角度出發(fā),G4影響TAD邊界的分割能力,參與染色質(zhì)環(huán)的形成,除此之外,G4還能夠通過招募蛋白質(zhì)影響長程相互作用。
G4既然能夠影響基因調(diào)控,自然也與人類疾病相關(guān),其今后有望成為新藥開發(fā)的靶標。端粒G4結(jié)構(gòu)影響端粒酶表達,可能會導致癌癥發(fā)生發(fā)展;G4影響基因調(diào)控過程,包括轉(zhuǎn)錄調(diào)控、轉(zhuǎn)錄后及翻譯調(diào)控,從而影響基因表達的結(jié)果,導致疾病發(fā)生;表觀遺傳修飾也受到G4的調(diào)控,包括DNA甲基化、組蛋白修飾等,G4影響表觀遺傳修飾可能會引起表觀遺傳修飾異常疾病;G4過度穩(wěn)定和積累也會導致疾病。總之,深入研究G4生物學功能,有助于更好地了解疾病的發(fā)生機制,制定相應(yīng)的治療方案。而且,通過了解G4的結(jié)構(gòu)和功能,可以利用其生化特性開發(fā)新的G4配體,控制G4的形成及其生物學作用,從而針對疾病相關(guān)的G4開展特異性的新藥研發(fā),推進G4的靶向治療,促進藥物治療新方法和新技術(shù)的發(fā)展。

