某院免疫檢查點抑制劑類藥物超說明書用藥分析*
錢 燦,蔣 倩,李 超,袁 婷,宿懷予△
(1. 四川省德陽市人民醫院,四川 德陽 618000; 2. 四川省腫瘤研究所·四川腫瘤醫院藥學部,四川 成都 610000)
目前,抗腫瘤藥物發展迅速,已從細胞毒類藥物、分子靶向藥物階段進入到免疫治療階段。免疫檢查點抑制劑(ICIs)是腫瘤免疫治療藥物的代表。靶向程序性死亡受體1(PD-1)/程序性死亡受體-配體1(PD-L1)通路因其抗腫瘤療效持久、適用性相對廣,已成為極具發展前景和治療價值的腫瘤免疫治療策略[1]。同時,國內原研PD - 1/ PD - L1 抑制劑相繼上市,部分品種甚至通過2020年國家醫保談判,提高其可及性。盡管越來越多的ICIs 在美國食品藥物管理局(FDA)或國家藥品監督管理局(NMPA)獲批了越來越多的適應證,但藥品說明書中適應證的獲批速度仍不及臨床試驗證據的更新速度。結合疾病治療的迫切需要和患者意愿,臨床ICIs的使用不可避免地會存在超說明書用藥現象。高級別循證醫學證據是臨床超說明書用藥的重要支撐。為調查某院ICIs的超說明書使用情況,本研究中回顧并提取某院使用ICIs類藥物患者的病歷相關信息,對其超說明書用藥情況進行判定,并查閱相關循證醫學證據,參照Thomson 超說明書用藥分析系統標準進行證據分級[2],以為ICIs 類藥物的臨床應用提供參考,并提出其超說明書用藥管理要點。現報道如下。
1 資料與方法
1.1 資料來源
選取四川省德陽市人民醫院2019年4月至2021年3月使用PD-1/PD-L1 抑制劑的患者142 例,通過醫院信息系統及電子病案系統提取其用藥情況,包括是否使用PD - 1/PD - L1 抑制劑及其用法用量、主要診斷、是否有敏感基因突變、首次給予時間等。
1.2 方法
通過美康合理用藥信息支持系統(MCDEX)V3.3.4.0查詢相應藥品說明書中在國內所批準的適應證和用法用量,同時通過NMPA官網查詢尚未載入藥品說明書的最新批準的適應證信息。凡首次用藥時國內藥品說明書未載錄相應用法且NMPA未公布批準的,視為超說明書用藥。同時依次通過查詢FDA 批準的適應證,美國國家綜合癌癥網絡(NCCN)指南推薦情況,中國臨床腫瘤學會(CSCO)指南推薦情況,臨床試驗開展情況,結合Thomson 分級系統[2]分析ICIs 類藥物超說明書用藥概況,以及證據強度及證據變遷,并分級和評價PD - 1/PD-L1類藥物超說明書用藥情況。
1.3 數據處理
所有數據均錄入Excel軟件,采用SPSS 19.0統計學軟件分析。計數資料用率(%)表示,行χ2檢驗。P<0.05為差異有統計學意義。
2 結果
共收集到142 例患者,涉及7 種ICIs 類藥物存在超說明書用藥。ICIs類藥物國內獲批適應證見表1,患者首次使用ICIs 類藥物時間分布見圖1。122 例患者首次使用時存在超說明書用藥,詳見表2。其中,國產藥品超說明書用藥構成比為89.34%,顯著高于進口藥品的65.00%(χ2= 8.42,P<0.05)。ICIs 類藥物超說明書包括超癌種、超用法使用、跨期治療、跨線治療4 種類型,其中超癌種例數最多,為84例,占68.85%。但在臨床使用中,部分患者對應的藥品適應證獲批情況發生變化(表3)。截至2021年3月31日,卡瑞利珠單抗用于晚期鼻咽癌二線治療與信迪利單抗用于晚期肺鱗癌一線治療均為超說明書用藥,但這2項適應證先后于2021年4月和6月獲得NMPA 批準。以當前證據和NMPA 批準情況評判仍有84 例患者對應適應證目前仍未獲得NMPA 批準。2021年3月31日,我院Thomson 分級系統綜合評價為B級以上超說明書用藥涉及6種藥品的15種用法(表4)。其中,度伐利尤單抗治療廣泛期小細胞肺癌(ES-SCLC)不僅為NCCN 指南所推薦,同時相應適應證也被FDA批準,證據等級綜合評定為A 級;卡瑞利珠單抗聯合奧沙利鉑化療用于(肝功能Child - Pugh A 級或較好的B級)晚期肝細胞癌的一線治療已被《中國臨床腫瘤學會(CSCO)原發性肝癌診療指南2020》(簡稱《指南》)推薦,在該《指南》發布之時部分Ⅱ期臨床試驗已有結果,如中位緩解持續時間(mDOR)、中位總生存期(mOS)尚未達到終點,但該《指南》認為從已有數據[中位疾病進展期(mTTP)和中位無進展生存期(mPFS)]上看,該療法從療效上仍顯示出良好前景,患者安全性和耐受性良好,該《指南》給出Ⅲ級推薦,2B級證據,Thomson分級為B 級;信迪利單抗用于晚期肺鱗癌的二線治療,盡管目前尚無指南推薦,但因多中心的隨機、開放、平行對照Ⅲ期臨床試驗(ORIENT - 3)的結果支持,證據強度綜合評價仍為A 級。目前,該院仍存在部分證據暫未達到Thomson分級為B級以上的超說明書用法(表5)。
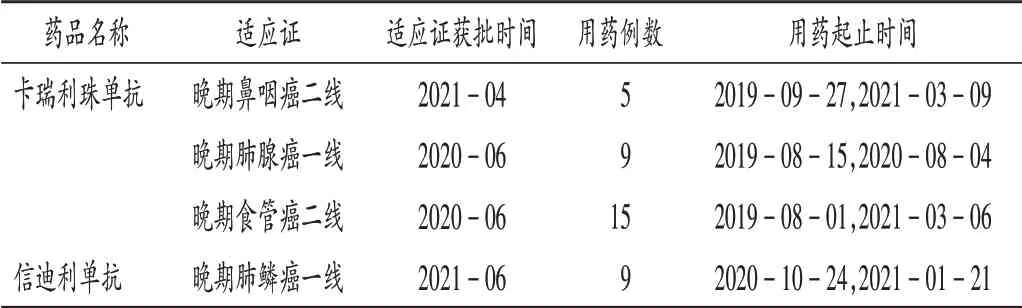
表3 首次用藥與當前證據存在適應證獲批變化的用藥情況Tab.3 The use of drugs with the change in approved indications of current evidence and initial drug use
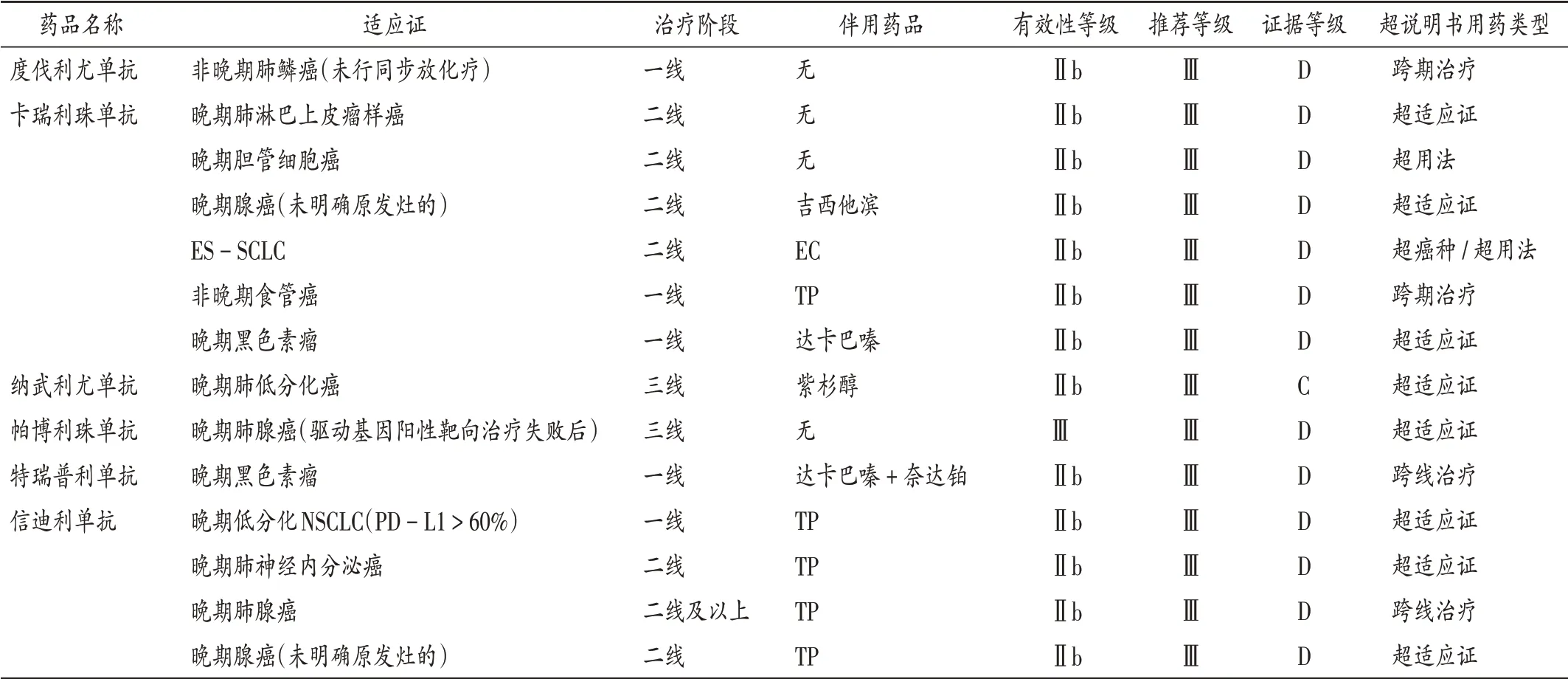
表5 證據強度暫未達到Thomson分級為B級以上的藥品使用情況Tab.5 The use of drugs with the evidence strength which has not yet reached the Thomson Category B
3 討論
3.1 ICIs 類藥物使用概況
我院ICIs 類藥物的使用始于2019年4月,由圖1 可知,在起步階段選藥相對單一。用藥初期,患者卡瑞利珠單抗使用例數相對較多,這與其在非小細胞肺癌(NSCLC)和食管癌等高發實體瘤臨床試驗的結果及適應證獲批相對較早,如食管癌Ⅲ期臨床試驗ESCORT完成于2019年7月,NSCLC Ⅱ期臨床試驗結果于2019年9月公布,相應適應證同時獲批于2020年6月;且相對于進口藥品更具經濟性和依從性,初期治療病例也多以NSCLC 和食管癌為主有關。隨后,ICIs 類藥物的品種選擇向多元化衍變,這與使用經驗積累、循證醫學證據不斷涌現,如2020年1月NSCLC 治療藥物信迪利單抗ORIENT - 11 臨床試驗達到主要終點、2020年12月特瑞普利單抗CHOICE-01研究達到主要研究終點,以及經濟性和可及性進一步提高有關。
3.2 對ICIs 類藥物超說明書用藥證據的評述
我院國產藥品超說明書用藥構成比顯著高于進口藥品,與國產藥品相對于進口藥品的經濟性、可及性、依從性有關。以首次用藥時的情況判定,122 例患者涉及超說明書用藥,而以2021年6月獲批適應證來看,仍有84 例患者存在超說明書用藥,側面反映了新的臨床試驗結果的不斷發布及證據的持續更新。該院使用ICIs類藥物的大部分病例在首次用藥時其對應適應證有Thomson 分級B 級以上循證醫學證據支持,但因患者主觀用藥意愿等原因,少部分患者仍存在證據強度不足的用藥情況。
Thomson 分級B 級以上要求至少是“結論不一致的隨機對照試驗的Meta 分析,小規模或研究方法有缺陷的隨機對照試驗,非隨機研究”,而A 級以上即要求“隨機對照試驗的Meta 分析,多個、設計良好、大樣本的隨機試驗”。我院A 級證據的超說明書用藥如度伐利尤單抗聯合化療用于ES-SCLC 的一線治療,有設計良好的多中心隨機開放標簽對照試驗CASPIAN 研究結果[10]所支持,該適應證已獲FDA 批準,并在NCCN 小細胞肺癌指南(2021.V2)上獲得推薦(1 類證據)。卡瑞利珠單抗單藥用于肺鱗癌二線治療證據由前瞻性Ⅱ期傘式研究SHR-1210-Ⅱ-201[11]所支持,但因其樣本量、試驗設計等原因,綜合給予B 級評價。而CameL - sq 研究[5]中則為多中心、隨機、雙盲、Ⅲ期對照臨床研究,論證了卡瑞利珠單抗聯合化療用于晚期或轉移性鱗狀NSCLC 患者一線治療,可顯著延長患者的無進展生存期,則給予A 級評價。相對地,若無高質量臨床試驗證據,僅有個案報道或專家意見,抑或是治療方法尚存爭議、現有證據與患者疾病分期或治療階段不符,證據強度均評價為C級或以下。
個案報道:如人群中發病率較低的低分化NSCLC、肺神經內分泌癌、肺淋巴上皮瘤樣癌等,暫未開展ICIs類藥物對對應癌種的相關臨床試驗,目前僅有部分個案報道,如我院1 例為將納武利尤單抗用于復發性晚期肺低分化癌多周期治療后的患者。MAUCLET 等[12]報道的1 例納武利尤單抗治療胸部姑息放療后的神經內分泌癌患者,雖獲得良好療效,但個案的證據強度有限,綜合評價為C 級。同理,對于卡瑞利珠單抗或信迪利單抗用于肺神經內分泌癌和肺淋巴上皮瘤樣癌,尚無高質量個案報道,Thomson 分級證據強度評價為D 級。
不同治療階段用藥證據不足:藥物在一線治療獲得推薦并不代表其在二線治療就一定有效,反之亦然。如度伐利尤單抗聯合EC用于ES- SCLC 初始治療(1 類證據),而復發時卻不再被推薦。反之,一種ICIs 如果二線治療有陽性證據,不代表用于一線治療就會取得相應良好療效。如CheckMate 078 試驗證實,在既往含鉑雙藥治療中或治療后出現進展的晚期NSCLC 患者中,納武利尤單抗在中國人群中的有效性和安全性均優于標準化療方案[13],但一線使用納武利尤單抗并未得出優于化療方案的臨床試驗結果[14]。同理,特瑞普利單抗用于惡性黑色素瘤一線、信迪利單抗用于肺腺癌二線及以上治療均無高質量循證醫學證據支持。故Thomson分級證據評價強度均為D級。
疾病不同分期的治療證據不足:分期治療的意義在于根據腫瘤大小、淋巴結轉移情況和遠處轉移情況,結合患者自身情況,參照既有證據及有效性、安全性、經濟性、可及性和依從性,選擇最佳治療方案。如度伐利尤單抗用于ⅢA 期肺鱗癌(患者情況為cT3N0M0)。盡管《CSCO 非小細胞肺癌指南2020年版》推薦臨床N2 且預期無法行根治切除的NSCLC 患者給予度伐利尤單抗作為同步放化療后鞏固治療,但并未推薦其他淋巴結轉移程度且未經放化療的非晚期肺癌一線治療。這類分期治療證據不足的,Thomson 分級證據評價強度均為C 級及以下。
聯合/非聯合用藥方案證據不足:卡瑞利珠單抗聯合依托泊苷與卡鉑方案用于ES-SCLC二線治療屬聯合用藥方案證據不足,卡瑞利珠單抗單藥用于膽道細胞癌二線治療屬非聯合用藥證據不足。《CSCO 小細胞肺癌指南2020年版》中ES-SCLC的一線治療推薦了阿替利珠單抗和納武利尤單抗聯合EC 方案。而二線治療中,卡瑞利珠單抗聯合阿帕替尼用于鉑類化療后ES - SCLC二線治療的隨機開放標簽的臨床試驗得到了良好的臨床療效[15],但并不能推導出卡瑞利珠單抗聯合EC 方案就能取得相似結果,缺乏高質量循證醫學證據。
超適應證用藥證據不足:適應證的獲批是基于高質量循證醫學證據支持的結果。如前所述CASPIAN 試驗為度伐利尤單抗適用于ES - SCLC 一線治療適應證獲批的關鍵試驗。但如尚無適應證獲批,絕大部分則是因為尚無高質量循證醫學證據支撐。如將卡瑞利珠單抗用于晚期惡性黑色素瘤的一線治療。帕博利珠單抗和納武利尤單抗均獲批FDA 黑色素瘤適應證,特瑞普利單抗于2018年在NMPA 獲批用于特定階段黑色素瘤的治療。而卡瑞利珠單抗針對惡性黑色素瘤目前僅有少量藥代動力學數據[16],在臨床Ⅰ期試驗[17]或以上研究中,尚無嚴謹的治療黑色素瘤的試驗結果,故Thomson分級證據評價強度判定為D級。
ICIs類藥物的臨床應用中,須注意循證醫學證據的變遷,如新適應證的獲批和既往適應證的撤回,甚至是臨床結果的問世。臨床藥師應將此類證據變遷信息及時向臨床傳遞,做到用藥告知。隨著ICIs 類藥物的臨床應用,不同的免疫治療相關不良反應也會伴隨出現,涉及皮膚、內分泌系統、肝臟、胃腸道、肺部、眼部、神經、血液等多器官系統[18]。特別是對免疫性肺炎這一類罕見且嚴重的不良反應,臨床治療過程中應做好監護,并及時處置。
3.3 ICIs 類藥物超說明書用藥的規范化備案審批
醫療機構應對ICIs 類藥物超說明書備案制訂完善的備案審批流程,而臨床藥師在審批過程中應重視循證醫學證據,嚴格把握適應證、腫瘤的分期與治療階段及聯用藥物的遴選。院內超說明書用藥申請應在醫療組討論后,由科主任填寫申請表格(包括患者信息、說明書相應信息和擬超說明書用法等),同時附帶循證醫學證據、風險處置預案,臨床藥師對循證醫學證據進行審查和判定。安全性可控且Thomson 分級B 級以上證據的超說明書用藥可提呈藥學部和醫務部主管審批流程。在藥事管理委員會和醫學倫理委員會審議后,最終通知相關管理科室和臨床科室發起人,完成超說明書用藥申請審批的閉環流程。
3.4 小結
ICIs 類藥物上市時間相對較短,證據及臨床使用經驗均相對欠缺。該院ICIs 類藥物的使用尚處于起步階段,藥品品種選擇由相對集中向相對分散變化,并存在較多超說明書用藥情況,其中部分超說明書用藥Thomson 證據未達到B 級以上。ICIs 類藥物的超說明書用藥應充分兼顧患者意愿、經濟性、臨床證據及知情同意。同時,醫院對于涉及超說明書用藥的情況,應鼓勵臨床完善備案,臨床藥師應遵循高質量循證醫學證據進行審核,并及時將藥物適應證最新信息反饋至臨床,在保障患者利益最大化的同時降低醫療風險。

