體重指數對多囊卵巢綜合征患者代謝指標與妊娠結局的影響
張素芝 張麗 茹慧波 姚勝杰 王樹松 張欣
多囊卵巢綜合征(polycystic ovary syndrome,PCOS)是育齡期女性常見的內分泌代謝紊亂性疾病,發病率為8%~13%[1],可引起女性無排卵性不孕。該病的主要臨床表現為月經紊亂、不孕、高雄激素血癥與卵巢多囊樣改變,同時常伴隨肥胖、血脂異常等,并有發生2型糖尿病、代謝綜合征、心血管疾病、妊娠期并發癥等風險。除引起不孕以外,已有研究表明,患有PCOS的女性流產率是正常女性的3倍[2],流產原因除常見的染色體異常、解剖異常、感染、免疫因素等外,還與PCOS患者自身的代謝異常引起的內分泌紊亂有關。我國PCOS人群中肥胖的發生率為34.09%[3],了解體重因素引起的代謝異常對妊娠結局的影響,為臨床精準治療提供診治依據。本研究通過研究不同體重指數(BMI)的PCOS患者的代謝指標差異,探討對PCOS患者代謝及妊娠結局的影響。
1 資料與方法
1.1 一般資料 本研究經河北省生殖健康科學技術研究院倫理委員會審批通過后,招募2018年1月至2019年12月于我院行供精人工授精(AID)的年齡20~40歲的PCOS患者606例。排除標準:(1)合并內科、外科、精神科嚴重原發性疾病;(2)近3個月曾服用影響性激素、血糖及血脂代謝的藥物以及降血壓藥物。根據BMI將患者分為4組,即低BMI組90例、正常體重組190例、超重組182例、肥胖組144例。
1.2 診斷標準 (1)不孕癥診斷標準:參照第9版《婦產科學》[4],女性無避孕性生活至少12個月而未孕。(2)PCOS診斷標準:依據歐洲人類生殖與胚胎學會和美國生殖學會制定的診斷標準[5]。①月經稀發/閉經;②經陰道超聲至少一側卵巢內直徑2~9 mm的竇狀卵泡數量≥12個,或者至少一側卵巢體積≥10 ml;③臨床或生化高雄激素血癥;④以上3個條件至少符合其中任意兩項并排除其他高雄激素病因,如先天性腎上腺皮質增生、庫欣綜合征、分泌雄激素的腫瘤。(3)分組標準:根據BMI分為:低體重組(BMI<18.5 kg/m2)、正常體重組(18.5 kg/m2≤BMI<24 kg/m2)、超重組(24 kg/m2≤BMI<28 kg/m2)和肥胖組(BMI≥28 kg/m2)[6]。
1.3 觀察指標 (1)一般情況:年齡、身高、體重、腰圍、臀圍、收縮壓、舒張壓等,計算BMI、腰臀比(WHR)。(2)性激素與代謝指標:患者于月經周期第2~5天空腹靜脈采血,采用全自動生化分析儀測定血清促卵泡激素(FSH)、黃體生成素(LH)、泌乳素(PRL)、雌二醇(E2)、孕酮(P)、睪酮(T)水平;雅培Architect1系統特異性化學發光分析測定空腹血糖(FPG)、空腹胰島素(FINS)、總膽固醇(TC)、三酰甘油(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)和尿酸(UA)的血清濃度。采用SNB同步盒放射免疫法測定血清維生素D3(VD3)濃度。高效液相色譜法測定血清同型半胱氨酸(Hcy)水平,熒光檢測采用Chromsystems試劑盒(德國)。(3)妊娠結局:統計1個AID助孕周期的生化妊娠率、臨床妊娠率和流產率。
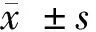
2 結果
2.1 患者一般臨床資料情況 PCOS患者中的血清VD3平均值明顯低于正常參考區間值,HOMA-IR平均值明顯高于正常參考區間值。此外,BMI和睪酮的均值接近正常參考區間的上限值。見表1。

表1 患者一般臨床資料情況
2.2 不同BMI分組的PCOS患者血清生化指標比較 血清P、T、PRL、FG、FINS、TG、TC、UA、HDL和VD3水平在不同亞組中存在顯著性差異(P<0.05),而空腹血清FSH、LH、E2水平和年齡各組之間無顯著差異(P>0.05)。超重組和肥胖組PCOS患者血清P、T、PRL、FPG、FINS、TG、TC和UA水平高于低體重組和正常體重組,而HDL和VD3水平低于低體重組和正常體重組(P<0.05);低體重組PCOS患者LH/FSH和HOMA-IR高于正常體重組(P<0.05)。超重組和肥胖組的Hcy和LDL水平高于低體重組和正常體重組(P<0.05)。見表2,圖1。

圖1 4組患者血清FPG(A)、Hcy(B)、HDL(C)、FINS(D)、LDL(E)、P(F)、PRL(G)、T(H)、TC(I)、TG(J)、UA(K)、VD3(L)的比較
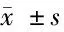
表2 不同BMI分組的PCDS患者血清生化指標比較
2.3 不同BMI分組妊娠結局比較 低體重組妊娠率、流產率均與正常體重組接近,差異無統計學意義(P>0.05)。與正常體重組比較,隨著體重的增加,HCG陽性率及臨床妊娠率有逐漸降低的趨勢,流產率有逐漸增高的趨勢,但4組間差異均無統計學意義(P>0.05)。見表3。

表3 不同BMI分組妊娠結局比較 %(例)
3 討論
隨著人類生活方式的改變,肥胖已經成為重大社會健康問題。數據統計顯示,超過1/2的PCOS女性超重或肥胖。此外,肥胖又加劇了PCOS的進展和疾病的嚴重程度[7]。PCOS肥胖患者具有更嚴重臨床表現,包括月經不調、不孕、流產、妊娠高血壓、糖尿病、早產、高雄激素血癥、葡萄糖耐量異常等[8]。PCOS與血脂具有密切的關系,血脂異常可能是導致PCOS患者肥胖的重要原因[9]。我們進一步證實PCOS患者血脂存在異常。與體重過輕和正常組相比,超重和肥胖組的血清P、T、PRL、FPG、FINS、TG、TC和UA的水平顯著升高,而HDL和VD3的水平較低。
PCOS是一種復雜的涉及多個系統的全身性代謝性疾病,目前仍缺乏有效的治療手段。對于肥胖的PCOS患者,改善機體代謝狀態、減輕體重至關重要。因此,有必要深入了解PCOS肥胖的特征,以達到早期診斷和合理干預目的。我們從血清參數角度分析PCOS患者的肥胖特征。先前的研究顯示,PCOS患者的血清Hcy水平顯著高于健康對照組[10]。本結果發現,肥胖的PCOS患者與非肥胖的PCOS患者相比,血清Hcy和LDL水平顯著升高。
血清Hcy水平升高又稱為高同型半胱氨酸血癥,Hcy可通過氧化應激、損傷血管內皮細胞、刺激血管平滑肌細胞增殖、影響凝血功能,改變基因組甲基化水平等多種機制誘導疾病的發生, 包括細胞毒性和胚胎毒性, 引發妊娠丟失與妊娠期并發癥等[11]。本研究發現超重組與肥胖組Hcy水平高于正常體重組,而妊娠率有降低趨勢,可能與高Hcy水平相關。據報道,在病態肥胖中,葉酸和維生素B12能夠緩解胰島素抵抗和代謝綜合征[12]。因此,及時補充葉酸、B12可能對PCOS患者改善機體的代謝狀態有幫助,并且可以降低流產率。
肥胖能夠加重PCOS患者的胰島素抵抗,促進炎癥發生,加劇內分泌系統紊亂,進而導致生殖功能惡化[13]。有研究認為,胰島素抵抗是PCOS患者肥胖的原因[14]。盡管胰島素抵抗與肥胖有關。在我們的研究中,注意到PCOS中體重過輕比正常體重患者胰島素抵抗更加明顯,這表明IR可能并不是導致PCOS肥胖的直接病因。
本研究表明隨著BMI的增加,PCOS患者的P、T和PRL逐漸增高,糖代謝的空腹血糖、胰島素及脂代謝的TC、TG、HDL、LDL和UA多項指標出現異常,說明控制體重可以明顯改善PCOS患者機體的代謝狀態,肥胖型PCOS患者體內Hcy更高,提示葉酸代謝可能受到影響。低體重的PCOS患者妊娠率及流產率不受影響,而隨著體重的增加PCOS患者的HCG陽性率及臨床妊娠率有逐漸降低的趨勢,流產率有逐漸增高的趨勢,但無統計學差異,我們尚需增加樣本量進一步研究驗證。
綜上所述,PCOS患者機體存在不同程度的代謝紊亂,隨著體重指數增加,多項代謝指標明顯異常。控制體重,保持合理體重指數,可以改善體內代謝異常指標,從而有可能改善妊娠結局。

