磷、鐵脅迫對棘孢木霉根際定殖的影響
趙 微,崔 璇,趙 蕾
(山東師范大學 生命科學學院,濟南 250014)
磷是滿足植物生長發育所必需的大量元素之一,通常以正磷酸鹽的形式吸收,構成核酸、生物膜等物質,參與多種重要的生化反應,但由于磷在土壤中的有效性低,易通過離子交換吸附、配位吸附和化學反應固定等方式被土壤轉化為無效態磷[1],導致世界性耕地普遍面臨著缺磷問題,而鐵作為保證機體生物氧化還原活動正常進行的重要微量元素,組成多種酶類和電子傳遞蛋白,但鐵常以難溶或微溶性化合物形式存在于土壤中,從而造成植物的鐵營養缺乏[2]。
木霉菌(Trichodermasp.)是一類廣泛存在于土壤中的植物根際有益真菌,可通過產生酸性磷酸酶、有機酸等溶磷作用[3-5]以及缺鐵條件下產生嗜鐵素[6-7]等促進植物對磷和鐵等元素的吸收利用。木霉菌在植物根際的有效定殖是其促進植物根系生長和營養吸收的必要條件,而土壤脅迫因子如缺磷、缺鐵對木霉菌在植物根際定殖的影響尚不明確。
有研究表明,多種病原菌對植物的侵染與嗜鐵素有關[8],如食源性致病菌沙門氏菌(Salmonellaenterica)侵染植物與嗜鐵素的生物合成有關[9],引起植物葉斑病的病原菌鏈格孢菌(Alternariaalternata)嗜鐵素合成相關基因AaNPS6敲除后對柑桔的致病性降低[10],說明胞外嗜鐵素不僅與病原菌的鐵吸收有關,還參與菌體對植物的侵染過程。而木霉菌在植物根部的定殖也與某些因素有關,如纖維素膨脹因子合成相關基因swollenin過度表達能促進里氏木霉菌(Trichodermareesei)在黃瓜根系的定殖[11],但木霉菌產生的嗜鐵素對菌體在植物根際定殖的影響尚不明確。本試驗利用篩選并鑒定的棘孢木霉菌(Trichodermaasperellum)T6以及獲得的棘孢木霉菌(T.asperellum)嗜鐵素合成相關基因sidA的敲除突變株[12],研究磷、鐵脅迫對菌體在擬南芥根部定殖的影響,為進一步完善非生物脅迫下棘孢木霉菌(T.asperellum)對植物的促生機制提供借鑒。
1 材料與方法
1.1 材料與試劑
1.1.1 材 料 棘孢木霉菌(Trichodermaasperellum)T6、棘孢木霉菌(T.asperellum)sidA基因敲除突變株,由山東師范大學微生物學實驗室獲得并保存;擬南芥(Columbia 生態型),由齊魯師范學院能源植物研究中心惠贈。
1.1.2 培養基 PDA(Potato dextrose agar):200 g馬鈴薯,20 g葡萄糖,20 g瓊脂,去離子水定容至1 L。
MS(Murashige & Skoog)固體培養基:30 g蔗糖,50 mL MSⅠ儲液(6.6 g NaCl,33 g NH4NO3,38 g KNO3,3.4 g KH2PO4,7.4 g MgSO4·7H2O,去離子水定容至1 L),5 mL MSⅡ儲液(4.46 g MnSO4·4H2O,1.24 g H3BO3,1.72 g ZnSO4·7H2O,0.166 g KI,0.05 g Na2MoO4·2H2O,0.005 g CuSO4,0.005 g CoCl2·6H2O,去離子水定容至1 L),5 mL MSⅢ儲液(5.56 g FeSO4,7.46 g EDTA,去離子水定容至1 L),5 mL MSⅣ儲液(20 g肌醇,0.1 g鹽酸硫胺素,0.1 g鹽酸吡哆醇,0.1 g煙酸,0.4 g甘氨酸,去離子水定容至1 L),20 g瓊脂,去離子水定容至1 L,pH調至5.8。
缺磷MS固體培養基:在MS培養基基礎上去除KH2PO4。
缺鐵MS固體培養基:在MS培養基基礎上去除FeSO4。
1/2 MS固體培養基:2.32 g MS培養基干粉,15 g蔗糖,20 g瓊脂,去離子水定容至1 L,pH調至6.0。
無磷液體培養基:10 g葡萄糖,0.5 g (NH4)2SO4,0.3 g CaCl2,0.3 g MgSO4·7H2O,0.3 g KCl,0.03 g MnSO4,0.03 g FeSO4·7H2O,0.4 g酵母膏,去離子水定容至1 L,pH調至7.0~7.5。
1.1.3 主要試劑 RNA提取試劑盒、DNA反轉錄試劑盒購自大連TaKaRa生物科技有限公司;Chrome azurol S(CAS)檢測液、透明液,磷酸二氫鉀、磷酸二氫鈉、利福平等試劑均為國產分析純。引物合成、序列測定由上海生工生物工程有限公司完成。
1.2 方法
1.2.1 孢子懸液的制備 將棘孢木霉菌(T.asperellum)T6劃線接種于PDA平板,28 ℃培養 7 d,待培養基表面被深綠色孢子覆蓋,用移液器取5 mL無菌水加入平板中,反復吹打菌落表面,獲得高濃度孢子懸液。取1 mL孢子懸液加入盛有30 mL無菌水的錐形瓶中,內含玻璃珠,振蕩15 min,獲得均勻孢子懸液。用血球計數板計數,孢子終濃度調至1×107CFU/mL。
1.2.2 嗜鐵素產量的測定 利用CAS檢測法[13]測定嗜鐵素含量。取2 mL孢子懸液加入100 mL無磷液體培養基,28 ℃、180 r/min振蕩培養5 d。每24 h取樣4~6 mL,4 ℃、10 000 r/min離心10 min,取上清液2 mL,加入等體積CAS檢測液,充分搖勻后暗處理30 min。測定630 nm處吸光值(As),未接菌對照組的吸光值為參比值(Ar),用去離子水調零。嗜鐵素含量計算公式如下:
嗜鐵素含量=[(Ar-As)/Ar]×100%
1.2.3 木霉菌生物量的測定 采用細胞干重法[14]測定木霉菌生物量。將棘孢木霉菌(T.asperellum)T6在不同磷濃度的無磷液體培養基中28 ℃、180 r/min振蕩培養7 d后,抽濾收集菌絲體,50 ℃烘干至恒質量,稱量菌絲干質量。
1.2.4 嗜鐵素合成相關基因sidA表達的半定量測定 采用RT-PCR檢測磷濃度對sidA基因表達的影響。在不同磷濃度的液體培養基28 ℃、180 r/min振蕩培養棘孢木霉菌(T.asperellum)5 d后,將菌液移入100 mL離心管中,離心棄上清,將菌絲沉淀用液氮研磨至粉末狀,采用Trizol法提取菌體的總RNA。依據艾德萊生物試劑盒說明書在RNase-free離心管中構建反轉錄體系,進行反轉錄得cDNA。以cDNA為模板,以S-RT-F/S-RT-R為引物進行 PCR 擴增(表1)[12]。對PCR產物進行瓊脂糖凝膠電泳,觀察內參基因(actin)和(sidA)基因的電泳條帶亮度,分析不同磷濃度下sidA基因的表達情況。

表1 引物序列Table 1 Primers used in this study
1.2.5 木霉菌利福平抗性標記 將棘孢木霉菌(T.asperellum)T6和sidA基因敲除突變株(記為ΔsidA)分別接種于含10 μg/mL利福平的PDA培養基中28 ℃培養2 d。挑取菌落形態與出發菌株相似的單菌落,分別接種于含50 μg/mL、80 μg/mL和100 μg/mL利福平的PDA培養基中培養,直至篩選出能在含200 μg/mL利福平的PDA培養基上穩定生長的棘孢木霉菌 (T.asperellum)T6和ΔsidA作為標記菌株[15]。
1.2.6 標記菌株的定殖檢測 將已消毒的擬南芥種子點種于1/2 MS固體培養基中,4 ℃冰箱中春化3 d。隨后在光照培養箱中培養3 d,設置 25 ℃、16 h光照、8 h黑暗處理、光照強度為300 μmol/(m2·s)。選取長勢相似的擬南芥幼苗轉接至不同處理MS固體培養基中培養7 d,接種經篩選得到的標記菌株。
待擬南芥根部被菌絲侵染,將擬南芥放入75%乙醇表面消毒3 min后用無菌水沖洗,取最后一次沖洗液涂布于含200 μg/mL利福平的PDA平板,28 ℃培養2 d,檢查根表面的消毒效果。將已消毒的擬南芥根部研磨至糊狀,使根組織內的標記菌株釋放,取100 μL組織懸液稀釋10倍、100倍、1 000倍,涂布于含200 μg/mL利福平的PDA平板上,28 ℃培養2 d后進行平板計數,計算單位為CFU/g[15]。
擬南芥繼續光照培養2 d后,將植株浸入透明液,4 ℃保存24 h后在倒置熒光顯微鏡下觀察標記菌株在擬南芥根部的侵染情況。
1.3 數據分析
采用Microsoft Excel 2010和SPSS 19.0軟件進行數據處理和方差分析。
2 結果與分析
2.1 磷濃度對嗜鐵素產量的影響
將棘孢木霉菌(T.asperellum)T6接種于不同磷濃度的培養基中,每24 h測定發酵液中嗜鐵素含量。結果表明,在第5天,無磷和低磷 (1 μmol/L)條件下嗜鐵素產量顯著高于足磷 (1 mmol/L)濃度,三者嗜鐵素含量分別為: 16.41%、16.77%和6.45%;與足磷培養基相比,無磷和低磷培養基中菌體嗜鐵素產量分別增加154.42%和160%(圖1)。使用獨立樣本t檢驗,對不同磷濃度菌絲體干質量進行差異性分析可知,菌絲干質量差異不顯著(P>0.05),表明磷濃度對菌體生長量影響不大。由此可見,磷充足時嗜鐵素產量較低,而缺磷脅迫則能促進嗜鐵素的產生。
2.2 磷濃度對嗜鐵素合成相關基因sidA表達的影響
sidA基因表達的半定量測定結果見圖2。以內參基因actin作為標準,無磷條件下電泳條帶最亮,說明sidA基因表達量最多,磷濃度為 1 μmol/L和1 mmol/L的電泳條帶較暗,說明sidA表達量較少。由此在分子水平上證明,缺磷脅迫能促進嗜鐵素合成相關基因sidA的表達。

圖1 磷濃度(0、1 μmol/L、1 mmol/L)對嗜鐵素產量的影響Fig.1 Yield of siderophores under different phosphorus concentrations(0,1 μmol/L,1 mmol/L)
2.3 磷脅迫對棘孢木霉T6和ΔsidA定殖的 影響
在證明擬南芥根部消毒徹底后,采用抗利福平標記法測定磷脅迫對棘孢木霉菌(T.asperellum)T6和ΔsidA定殖的影響,對平板中的菌落進行計數。在缺磷(MS-P)培養基中棘孢木霉菌(T.asperellum)T6的定殖量是含磷(MS)培養基的3倍;而ΔsidA在含磷與缺磷培養基中的定殖量卻無顯著性差異(P>0.05)(圖3-A);并且無磷條件下棘孢木霉菌絲分布較為密集,在擬南芥根尖處常聚集成團;而足磷處理的菌絲在遠離根尖處偶有分布(圖3-B)。以上結果說明,磷含量充足以及嗜鐵素合成相關基因sidA敲除時,由于棘孢木霉菌嗜鐵素產量明顯減少,菌體的根際定殖能力降低。因此,缺磷脅迫下棘孢木霉菌(T.asperellum)產生的嗜鐵素能夠促進菌體在植物根際的定殖。

圖2 RT-PCR產物電泳圖Fig.2 Electrophoresis map for RT-PCR-amplified products
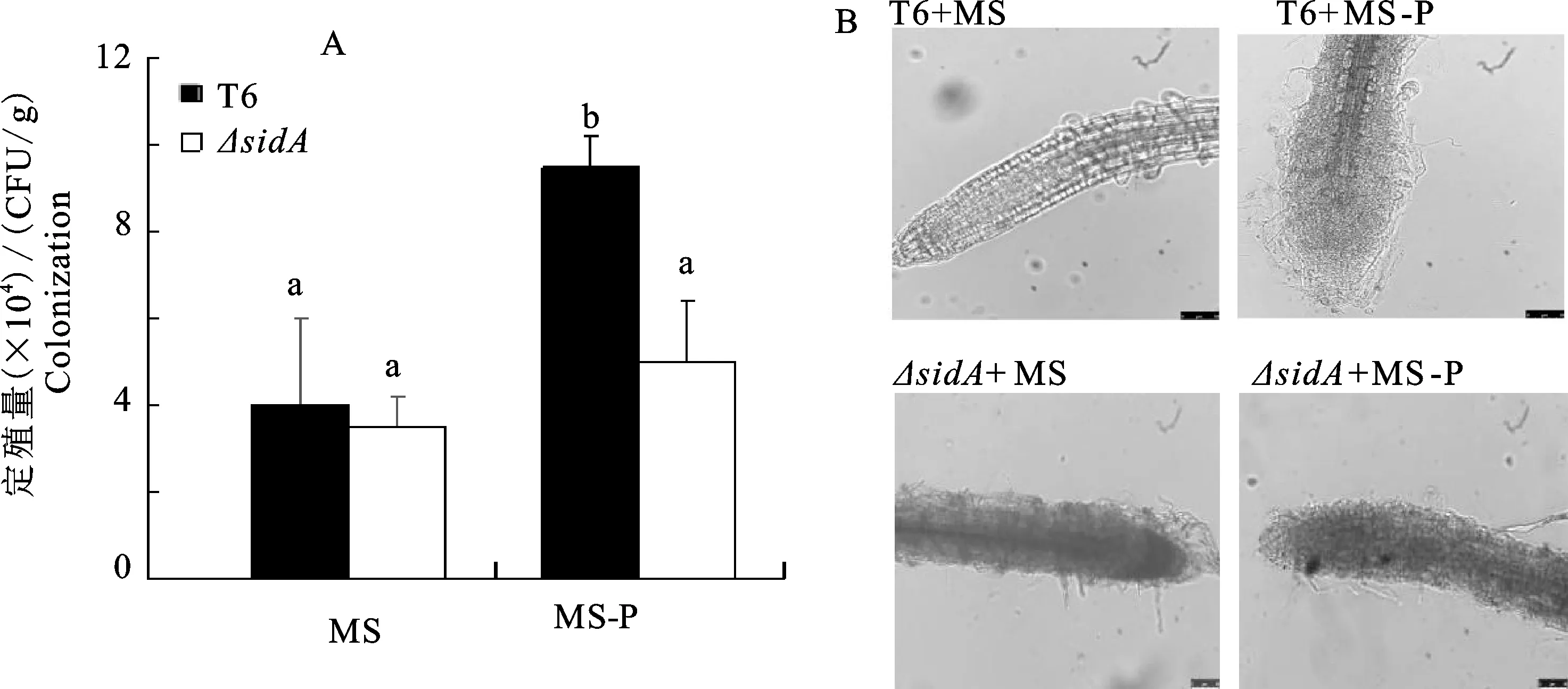
A. 菌體的定殖量; B. 菌體定殖擬南芥根部的顯微照片(標尺=10 μm);不同字母表示差異顯著(P<0.05),下同
2.4 鐵脅迫對棘孢木霉T6和ΔsidA定殖的影響
圖4是采用抗利福平標記法測定鐵脅迫對棘孢木霉菌(T.asperellum)T6和ΔsidA在擬南芥根部定殖的影響。結果表明,缺鐵(MS-Fe)培養基中棘孢木霉菌T6的定殖量是含鐵(MS)培養基的2.1倍;且缺鐵條件下,棘孢木霉菌T6在擬南芥根部的定殖量顯著高于ΔsidA,是突變株的1.9倍(圖4-A)。用倒置熒光顯微鏡對擬南芥根部進行鏡檢發現,缺鐵培養基中棘孢木霉菌絲已侵入擬南芥根部并產生大量孢子;而含鐵培養基中菌體在擬南芥根際的定殖密度較低(圖4-B)。說明在缺鐵條件下,突變株由于嗜鐵素合成相關基因sidA的缺失,嗜鐵素產量明顯減少,減弱棘孢木霉菌(T.asperellum)的根際定殖能力。因此,缺鐵脅迫下棘孢木霉菌(T.asperellum)產生的嗜鐵素能夠促進菌體在植物根際的定殖。

A.菌體的定殖量; B.菌體定殖擬南芥根部的顯微照片(標尺=10 μm)
3 討論與結論
木霉菌是一種應用廣泛的植物生防促生真菌,能夠通過與植物形成共生體、分泌多種酶類和代謝產物[16]提高植物對生物和非生物脅迫的抗性[17-18]。研究發現,木霉菌在鐵脅迫下具有通過非核糖體途徑產生一種或幾種嗜鐵素的能力[19],提高植物對土壤難溶性礦質元素的利用率。山東師范大學微生物學實驗室前期研究發現,棘孢木霉菌(T.asperellum)不僅在缺鐵脅迫下能夠產生特異性螯合Fe3+的嗜鐵素,將土壤中難溶性鐵轉變為可溶性鐵[3, 6],還具有根際定殖能力[5]。本研究利用CAS檢測法和RT-PCR檢測法研究磷濃度對棘孢木霉菌(T.asperellum)嗜鐵素產量和嗜鐵素合成相關基因sidA表達量的影響,發現磷脅迫同樣能夠提高菌體嗜鐵素產量以及sidA基因表達,具體機制尚待明確,而磷脅迫對菌體嗜鐵素合成的影響至今未見報道。
有文獻報道,缺磷脅迫能夠促進叢枝菌根真菌(AMF)定殖及其與植物根系的相互作用[20-21],而菌體產生的嗜鐵素與定殖也有一定的關系,如熒光假單胞菌(Pseudomonasfluorescens)分泌的熒光嗜鐵素可顯著提高其種子粘附和根際定殖能力[22]。本試驗采用抗利福平標記法測定缺磷、含磷以及缺鐵、含鐵下棘孢木霉菌(T.asperellum)T6和sidA敲除突變株在擬南芥根際的定殖能力,發現棘孢木霉菌絲可以穿透并定殖于植物根表皮和外皮層組織中,且磷、鐵脅迫下棘孢木霉菌(T.asperellum)產生的嗜鐵素能夠促進菌體在植物根際的定殖。
水楊酸(SA)、茉莉酸(JA)和乙烯(ET)介導的信號通路是目前已知的植物調控自身防御反應的3個重要信號通路。研究發現,致病性腸桿菌歐文氏菌(Erwiniasp.)產生的嗜鐵素chrysobactin(CB)能夠激活水楊酸介導的抗病信號傳導途徑,抑制PDF1.2(ET/JA pathway)基因表達,提高菌體對擬南芥的侵染能力[23]。此外,木霉菌能夠增強WRKY18和WRKY40基因表達,抑制JAZ蛋白激活JA信號途徑,并負調控防御基因FMO1、PAD3和CYP71A1表達,通過短暫抑制植物早期防御反應,促進菌體在植物根際定殖[24]。由此推測,可能是由于缺磷、缺鐵脅迫下棘孢木霉菌產生的胞外嗜鐵素不僅有利于菌體從寄主植物中獲得鐵營養,還能夠對植物防御反應進行調控,從而有益于菌體對植物根系的粘附與定殖。此研究結果為進一步探究非生物脅迫下棘孢木霉菌對植物根際定殖和促生機制奠定了基礎。

