天然多糖改善潰瘍性結(jié)腸炎的作用機(jī)制研究進(jìn)展
孫亞哲,王鑫楠,辛貴忠,劉麗芳
(中國藥科大學(xué)中藥學(xué)院,天然藥物活性組分與藥效國家重點(diǎn)實(shí)驗(yàn)室,江蘇 南京 210009)
潰瘍性結(jié)腸炎(ulcerative colitis,UC)是一種慢性、非特異性的炎癥性腸病,病變部位可由直腸延伸至結(jié)腸近端,具有反復(fù)性腸道黏膜或固有層炎癥反應(yīng),其程度不等[1]。流行病學(xué)數(shù)據(jù)顯示,近幾十年來盡管UC死亡率較低,但發(fā)病率和流行率在歐美發(fā)達(dá)國家中仍很高,發(fā)展中國家也持迅速增長的趨勢(shì)[2]。患者主要癥狀包括出血性腹瀉,體質(zhì)量減輕和腹部絞痛等[3]。UC的病因和發(fā)病機(jī)制是多因素綜合影響的結(jié)果(圖1),遺傳易感性和外部環(huán)境對(duì)腸道微生物群的相互作用,會(huì)導(dǎo)致腸道屏障受損,進(jìn)而導(dǎo)致免疫應(yīng)答失調(diào),且隨著炎癥程度和病程的推進(jìn),將大大增加病人患結(jié)直腸癌的風(fēng)險(xiǎn)。目前,臨床治療UC以使用5-氨基水楊酸類、皮質(zhì)類固醇類、生物制劑和免疫抑制劑類藥物為主,然而這些藥物的療效有限,且價(jià)格昂貴。皮質(zhì)類固醇類和免疫抑制劑類藥物的使用所帶來的副作用如骨質(zhì)疏松、抑郁癥、滿月臉等癥狀不容忽視,并且接近15%的患者后期仍需要接受結(jié)直腸切除手術(shù)[2, 4]。因此,開發(fā)安全有效的新藥物和實(shí)施個(gè)性化醫(yī)療改進(jìn)策略是UC疾病控制亟待解決的問題。
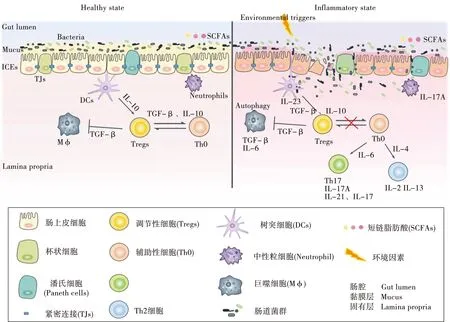
圖1 潰瘍性結(jié)腸炎(UC)的發(fā)病機(jī)制
利用天然產(chǎn)物治療UC目前是一種很有前景的替代傳統(tǒng)療法[5],其中,多糖作為一類重要的活性物質(zhì)而逐漸受到醫(yī)藥行業(yè)的廣泛關(guān)注[6]。多糖通常指由10個(gè)以上的單糖通過糖苷鍵連接組成的天然高分子聚合物,廣泛分布在植物、動(dòng)物、真菌、海藻等自然資源中,在生物體的生長發(fā)育中發(fā)揮著重要的作用。多項(xiàng)研究表明,多糖具有良好的抗腫瘤、抗凝血、抗炎、降糖及免疫調(diào)節(jié)等生物活性[7];同時(shí),多糖也具有安全無毒、療效好、成本低、生物相容性好的優(yōu)勢(shì)[8],使其在多種疾病治療方面得到了應(yīng)用。近年來,大量體內(nèi)外相關(guān)數(shù)據(jù)也表明,多糖能夠通過不同的作用途徑緩解UC的癥狀。例如,黃芪多糖可通過抑制核因子-κB(NF-κB)信號(hào)通路,減少炎癥因子釋放來改善葡聚糖硫酸鈉(dextran sulfate sodium salt,DSS)所致的小鼠結(jié)腸損傷[9];竹蓀多糖在高劑量時(shí)具有明顯的治療UC,緩解腸上皮細(xì)胞損傷的效果[10];大蒜多糖能顯著增加UC小鼠腸道菌的多樣性和豐富度,調(diào)節(jié)腸道代謝物的比例,具有良好的抗炎、增強(qiáng)免疫的作用[11];除此之外,攝入不同劑量的菊粉型果聚糖提高了UC患者的標(biāo)志物,并誘導(dǎo)腸道菌群發(fā)生顯著變化,此變化與丁酸鹽的產(chǎn)量增加有關(guān),這為輕至中度UC的輔助治療提供了一定的借鑒意義[12]。
本文概述了近年來UC的相關(guān)發(fā)病機(jī)制,著重探討了多糖在改善UC方面的直接或間接干預(yù)機(jī)制,為UC的臨床治療和多糖的進(jìn)一步開發(fā)利用提供一定的參考。
1 UC的發(fā)病機(jī)制
1.1 腸道屏障
腸道內(nèi)穩(wěn)態(tài)是基于多個(gè)組成部分所維持的微妙平衡,黏膜結(jié)構(gòu)的改變是UC組織病理學(xué)的主要特征,這包括上皮細(xì)胞異常、結(jié)腸隱窩形態(tài)和密度的下降、固有層細(xì)胞改變及免疫細(xì)胞浸潤[4]。腸上皮屏障(intestinal epithelial cells,IECs)是構(gòu)成腸部內(nèi)外環(huán)境的邊界,是抵御外來病原體的第一道物理屏障[13]。它由腸上皮細(xì)胞、杯狀細(xì)胞、微折細(xì)胞、神經(jīng)內(nèi)分泌細(xì)胞和潘式(Paneth)細(xì)胞構(gòu)成[5]。細(xì)胞旁通路被嚴(yán)格調(diào)控,只允許某些溶質(zhì)和液體通過,形成選擇性通透屏障;連接復(fù)合物,主要包括上皮細(xì)胞間緊密連接(tight junctions,TJs)、黏著連接(adherens junctions,AJs)和連接細(xì)胞內(nèi)骨架的橋粒,封閉了細(xì)胞間隙并提供結(jié)構(gòu)支持[14]。TJs是細(xì)胞旁路的主要限速因子,主要由跨膜蛋白如occludin、claudins以及zonulin-1(ZO-1)組成,他們與細(xì)胞骨架相連,調(diào)節(jié)大分子選擇性地通過TJs,同時(shí)也是不同信號(hào)通路的直接靶點(diǎn)和效應(yīng)體,影響TJs復(fù)合物的組裝、維持和屏障功能[15]。IECs在抵御外來抗原侵襲時(shí)也能分泌一些抗菌蛋白如α,β防御素、蛋白水解酶、糖酵解酶和抗菌肽[5]。
IECs的有序更替是維持腸道屏障的重要機(jī)制。然而在疾病狀態(tài)下時(shí),炎癥使IECs可能變得更“緊”或更“漏”,緊密連接蛋白表達(dá)異常,腸道上皮屏障的完整性被破壞,導(dǎo)致其通透性增加,這可能是UC前期發(fā)病的一個(gè)重要影響因素[16]。
與ICEs緊密結(jié)合的黏液層,將腸上皮細(xì)胞與腸腔隔開,構(gòu)成了腸道的化學(xué)屏障。黏液由杯狀細(xì)胞分泌的黏蛋白聚合后,結(jié)合水在腸腔內(nèi)膨脹為網(wǎng)狀凝膠而形成,包括一個(gè)內(nèi)部的堅(jiān)固層和一個(gè)外部的松散層[17]。外層由黏液蛋白2(mucin 2,Muc2)和各種碳水化合物修飾組成,與結(jié)腸菌群相互作用;而內(nèi)層的致密性可以阻止細(xì)菌滲透,同時(shí)仍允許小分子包括微生物代謝物的交換。在UC中觀察到黏液功能紊亂,表現(xiàn)為黏液糖基化和硫酸鹽化減少,黏液層厚度降低,糞便的黏蛋白溶解性增加,或黏液的殺菌能力降低,急性炎癥的區(qū)域甚至出現(xiàn)黏液層脫落[18]。Muc2缺陷的小鼠對(duì)黏膜刺激物的敏感性也持增強(qiáng)趨勢(shì)[19]。這些改變可能進(jìn)一步促進(jìn)了UC的發(fā)作,使炎癥的解決變得復(fù)雜化。
1.2 免疫應(yīng)答反應(yīng)
黏膜系統(tǒng)屏障對(duì)共生菌是耐受的,然而當(dāng)屏障破壞增加,更多腔內(nèi)抗原越過屏障時(shí),這些耐受機(jī)制失效,導(dǎo)致局部免疫細(xì)胞受到刺激,產(chǎn)生細(xì)胞因子,隨后免疫細(xì)胞浸潤,進(jìn)一步加劇炎癥過程。因此,免疫反應(yīng)和炎癥通路是了解UC發(fā)病機(jī)制的關(guān)鍵信息[20]。UC的先天免疫反應(yīng)與中性粒細(xì)胞、巨噬細(xì)胞和樹突狀細(xì)胞(dendritic cells,DCs)的活躍有關(guān)[21]。有研究表明,中性粒細(xì)胞彈性酶和髓過氧化物酶等蛋白在UC中的表達(dá)上調(diào),這與中性粒細(xì)胞胞外陷阱有關(guān)[4]。另一方面,樹突細(xì)胞和巨噬細(xì)胞在免疫反應(yīng)中不僅參與抗原的呈遞、攝取和加工,還可以通過對(duì)病原體相關(guān)分子模式的識(shí)別,誘導(dǎo)多種信號(hào)通路的激活(如NF-κB、PI3K/AKT、AMPK、JAK/STAT)和促炎因子如腫瘤壞死因子-α(TNF-α)、白介素(IL)-6、IL-1β等的增加。
與先天性免疫相反,適應(yīng)性免疫是高度特異性的,主要參與者是T細(xì)胞。輔助性T細(xì)胞(helper T cell,Th0)可被激活并分化成Th1、Th2或Th17細(xì)胞,這有助于清除特定病原體。然而,激活的T細(xì)胞亞群異常發(fā)育可能通過過度釋放細(xì)胞因子和趨化因子導(dǎo)致炎癥的發(fā)生,這驅(qū)使一些研究將克羅恩病(Crohn’s disease,CD)和UC與不同亞型的促炎免疫反應(yīng)聯(lián)系起來[17]。前者主要由Th1/Th17反應(yīng)引起,而后者則是Th2反應(yīng)更占優(yōu)勢(shì),組織中觀察到IL-13的上調(diào)[21]。調(diào)節(jié)性T細(xì)胞(regulatory T cells,Tregs)則通過產(chǎn)生抗炎因子如IL-10和轉(zhuǎn)化生長因子-β(TGF-β)來控制黏膜穩(wěn)態(tài),抑制Th0細(xì)胞亞群,調(diào)節(jié)腸道異常免疫反應(yīng)。細(xì)胞因子也作為一種信號(hào)分子,在炎癥通路等不同作用下驅(qū)動(dòng)著UC的發(fā)病[22]。
1.3 腸道菌群的影響
人體腸道內(nèi)含有大量復(fù)雜的微生物群落,包括各種細(xì)菌、真菌、噬菌體和病毒,這一群體通常被稱為“隱藏的代謝器官”[23]。近年來,隨著測序技術(shù)以及非基因組技術(shù)的并行發(fā)展,腸道菌群在人類健康和疾病中的作用也逐漸變得清晰。腸道菌群主要由厚壁菌門、擬桿菌門、變形菌門和放線菌門組成,分布在結(jié)腸和遠(yuǎn)端小腸,以一種互惠的方式與人體共同進(jìn)化[24]。短鏈脂肪酸(short-chain fatty acids,SCFAs),包括乙酸、丙酸、丁酸,是腸道微生物發(fā)酵膳食纖維活動(dòng)的主要產(chǎn)物[25],在維持腸道健康方面也發(fā)揮著重要的作用。SCFAs作為主要的能量底物,通過改變結(jié)腸上皮細(xì)胞表型直接影響宿主消化道[26]。特別是丁酸鹽,能夠通過調(diào)節(jié)緊密連接蛋白的表達(dá)來增強(qiáng)腸道屏障功能,這種作用可能是通過激活A(yù)MPK或下調(diào)claudin-2來完成的[27]。丁酸鹽還能抑制腫瘤細(xì)胞的生長和遷移,并表現(xiàn)出抗炎和免疫調(diào)節(jié)的特性,降低腸道炎癥和結(jié)直腸癌的發(fā)病率[28]。
盡管UC的發(fā)病可能與特定的菌群無關(guān),但腸道中普遍存在的微生物生態(tài)失調(diào)在大量的研究中已得到證實(shí),常表現(xiàn)為生物多樣性減少、腸道菌群組成異常、空間分布改變以及菌群間、不同菌株與宿主的相互作用變化[24]。例如,與健康人相比,UC患者糞便中有機(jī)酸的濃度降低,腸道擬桿菌屬(Bacteroides)和梭狀芽孢桿菌亞簇XIVab(Clostridiumsubcluster XIVab)豐度減少,而腸球菌(Enterococcus)的數(shù)量遠(yuǎn)高于健康受試者[29]。在屬水平上,另一項(xiàng)研究中則發(fā)現(xiàn)UC患者中丁酸的產(chǎn)生菌F.prausnitzii明顯減少,UC緩解期F.prausnitzii顯著上升,提示F.prausnitzii可能在UC的治療中發(fā)揮重要作用[30]。除細(xì)菌失調(diào)外,真菌群落隨念珠菌的生長而變化,病毒(噬菌體)的富集在UC患者和健康對(duì)照組之間也存在差異性,這可能與UC黏膜炎癥有關(guān)[31-32]。
1.4 其他
隨著基因測序技術(shù)的進(jìn)步,全基因組關(guān)聯(lián)分析(GWAS)的進(jìn)行逐漸證實(shí)了遺傳易感性這一影響因素參與了炎癥性腸病(inflammatory bowel disease,IBD)的發(fā)生和發(fā)展。值得注意的是,表觀遺傳學(xué)和自噬等相關(guān)的探索也為UC的發(fā)病機(jī)制提供了新的見解,一些學(xué)者對(duì)此進(jìn)行了詳細(xì)的綜述[33-34],本文將不再覆蓋。這些遺傳學(xué)角度的新發(fā)現(xiàn)表明進(jìn)一步研究基因之間以及基因與環(huán)境等因素的相互作用對(duì)開發(fā)治療UC的新藥物是至關(guān)重要的。
2 多糖干預(yù)UC
正如上文所概述的,外部環(huán)境及遺傳易感個(gè)體的影響,腸腔內(nèi)上皮屏障和黏膜屏障的破壞,過度激活的腸部免疫應(yīng)答反應(yīng)以及腸道菌群紊亂,綜合因素的作用下進(jìn)一步加劇了UC的各種癥狀。多糖具有良好的抗炎、免疫調(diào)節(jié)、抗癌等生物活性,人們對(duì)多糖在治療UC方面的藥理活性也進(jìn)行了大量的研究,以確定其治療范圍和作用機(jī)制(圖2)。多糖可刺激結(jié)腸黏蛋白的合成及分泌,促進(jìn)結(jié)腸黏膜修復(fù),延緩腸上皮細(xì)胞凋亡;或介導(dǎo)信號(hào)通路(如JAK/STAT、AMPK、NF-κB、PI3K/AKT),調(diào)節(jié)細(xì)胞因子的平衡來降低UC免疫反應(yīng)程度;除此之外,多糖也可以通過影響腸道菌群豐度,增加短鏈脂肪酸(SCFAs)的含量,來減輕UC炎癥。下面幾節(jié)將詳細(xì)介紹多糖參與調(diào)節(jié)UC的作用機(jī)制。
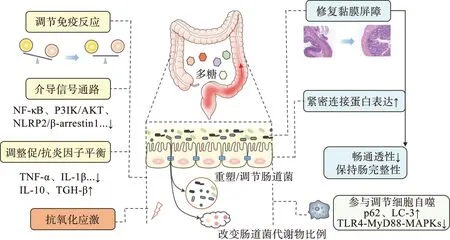
圖2 多糖改善UC的作用機(jī)制
2.1 多糖修復(fù)腸道屏障
有效的腸道屏障對(duì)于防止微生物及外界抗原的入侵至關(guān)重要,緊密連接蛋白和黏液層的完整性是維持正常腸道屏障的兩個(gè)關(guān)鍵因素。JIN等[35]觀察到DSS誘導(dǎo)型的結(jié)腸炎小鼠結(jié)腸緊密連接被破壞,杯狀細(xì)胞數(shù)目減少,腸腔內(nèi)和固有層黏液合成明顯減少,給予巴戟天多糖(NFP)11 d后可見緊密連接蛋白(ZO-1、occludin)的表達(dá)顯著提高,杯狀細(xì)胞衰竭得以緩解;同時(shí),NFP抑制小鼠腸道黏膜的破壞,促進(jìn)組織保護(hù),這可能與其酸性多糖的結(jié)構(gòu)有關(guān)。CUI等[36]則發(fā)現(xiàn)凝膠柱鹽洗部分的黃芩多糖可同時(shí)上調(diào)ZO-1,occludin和claudin-5三種連接蛋白的表達(dá)來修復(fù)UC小鼠腸道屏障。銀耳多糖(TPF)在干預(yù)治療UC小鼠后,能明顯提高M(jìn)uc2和鈣激活的氯離子通道輔助蛋白1(calcium-activated chloride channel regulator 1,Clca1)的基因和蛋白表達(dá)水平,恢復(fù)黏液屏障功能,減輕結(jié)腸損傷的臨床癥狀;體外脂多糖(lipopolysaccharide,LPS)刺激的Caco-2細(xì)胞模型進(jìn)一步發(fā)現(xiàn)TPF對(duì)腸屏障和黏液屏障相關(guān)基因的上調(diào)表達(dá)呈劑量依賴性[37]。此外,蘆薈多糖能夠通過核因子E2相關(guān)因子2/血紅素氧合酶-1(Nrf2/HO-1)信號(hào)通路有效促進(jìn)腸道緊密連接蛋白基因的表達(dá),從而降低腸通透性,維持腸道完整性[38]。
2.2 多糖介導(dǎo)腸道免疫應(yīng)答反應(yīng)
大量研究表明免疫系統(tǒng)在抵御外界物質(zhì)干擾過程中的過度反應(yīng)直接影響著UC的發(fā)生及發(fā)展,炎癥反應(yīng)由促炎因子和抗炎因子的之間的平衡決定,而他們的分泌也受到多種信號(hào)分子的調(diào)節(jié)。過去幾十年里天然多糖的免疫調(diào)節(jié)活性一直是研究的熱點(diǎn),在干預(yù)UC這一領(lǐng)域研究也較多。例如,在實(shí)驗(yàn)性小鼠結(jié)腸炎模型中,黃芪多糖(APS)在緩解小鼠體質(zhì)量減輕、改善疾病活動(dòng)指數(shù)(DAI)的同時(shí),顯著降低了NF-κB的水平,減少促炎因子TNF-α,IL-1β和IL-6的分泌,提示APS可能抑制NF-κB信號(hào)通路來調(diào)節(jié)結(jié)腸組織促炎反應(yīng),減輕結(jié)腸損傷[9]。另一項(xiàng)研究表明,APS通過抑制派爾集合淋巴結(jié)(PPs)中IL-17的表達(dá),恢復(fù)Tregs細(xì)胞的數(shù)量和功能,有效控制Th17/Tregs細(xì)胞間的平衡,維持腸道免疫穩(wěn)態(tài)[39]。NLRP3炎性小體(NOD-like receptor protein 3,NLRP3)是NOD樣受體家族成員,表達(dá)于免疫細(xì)胞和上皮細(xì)胞,可由β-阻遏蛋白1(β-arrestin1)激活,進(jìn)而促進(jìn)IL-1β、IL-18等促炎因子的釋放[40],因此,NLRP3/β-arrestin1信號(hào)通路可能是UC治療的潛在靶點(diǎn)。LIANG等[41]給予DSS誘導(dǎo)的UC小鼠不同劑量的鐵皮石斛多糖(DOPS),發(fā)現(xiàn)DOPS可下調(diào)β-arrestin1的表達(dá),并中斷NLRP3信號(hào)通路的激活,下調(diào)IL-1β、IL-18、IL-6、TNF-α及IFN-γ的水平,且在高劑量時(shí)顯著增加抗炎因子IL-10的比例,調(diào)整促/抗因子平衡。HU等[42]從JAK2/STAT-3信號(hào)通路出發(fā),探討蘆薈多糖(AP)干預(yù)2,4,6-三硝基苯磺酸(2,4,6-trinitrobenzenesulfonic acid solution,TNBS)誘導(dǎo)的UC大鼠后的治療效果,結(jié)果表明AP可下調(diào)此通路的相關(guān)基因和蛋白表達(dá),降低IL-6的分泌,減少結(jié)腸上皮細(xì)胞凋亡。一些藥用菌類多糖如猴頭菇多糖、竹蓀多糖可抑制MAPKs、P3IK/AKT等信號(hào)通路進(jìn)而減輕UC炎癥反應(yīng)[10, 43]。由此可見,多糖類物質(zhì)具有多靶點(diǎn)調(diào)節(jié)UC腸道免疫應(yīng)答反應(yīng)的優(yōu)勢(shì)。
2.3 多糖調(diào)節(jié)腸道菌群及其代謝物
腸道菌群結(jié)構(gòu)的變化揭示了UC患者與健康人的顯著差異,此外,無菌小鼠模型顯示在沒有腸道菌群的情況下不會(huì)觸發(fā)嚴(yán)重的結(jié)腸炎癥,進(jìn)一步證明了腸道菌群與UC炎癥及其緩解密切相關(guān)[44]。利用天然多糖調(diào)節(jié)腸道菌群的生態(tài)失調(diào)已成為治療UC的新手段。研究表明,多糖對(duì)腸道菌群的調(diào)節(jié)保護(hù)作用是多方面的。菊花多糖作用于TNBS誘導(dǎo)的大鼠UC模型后,可觀察到糞便微生物中機(jī)會(huì)致病菌大腸桿菌(Escherichia)、腸球菌(Enterococcus)和普雷沃氏菌(Prevotella)豐度下降,而雙歧桿菌(Bifidobacterium),丁酸球菌(Butyricicoccus)、梭菌(Clostridium)、毛羅菌(Lachnospiraceae)、乳桿菌(Lactobacillus)等有益菌的豐度均有不同程度的升高;菌群與生化因子的相關(guān)聯(lián)分析顯示有益菌的變化與抗炎因子IL-10、IL-4等水平呈正相關(guān),有害菌則與IL-6、IL-17、TNF-α等促炎因子水平正相關(guān),這表明菊花多糖不僅直接參與調(diào)節(jié)UC大鼠腸道菌群的組成,恢復(fù)腸道微生態(tài)平衡,還能通過腸道菌與機(jī)體細(xì)胞因子表達(dá)之間的密切關(guān)聯(lián),間接恢復(fù)UC大鼠免疫系統(tǒng)的紊亂[45]。UC小鼠口服金針菇多糖后,除調(diào)節(jié)腸道菌群平衡外,還可以增加腸腔內(nèi)短鏈脂肪酸(SCFAs)含量,降低厚壁菌門/擬桿菌門(F/B)的比值,改善腸道微生物多樣性和豐富度,達(dá)到緩解UC癥狀的目的;此外,PICRUSt預(yù)測分析顯示金針菇多糖干預(yù)后的菌群功能發(fā)生改變,主要表現(xiàn)在代謝途徑、次生代謝物、細(xì)胞膜骨架等方面[46]。類似的關(guān)于多糖調(diào)節(jié)UC腸道菌平衡的現(xiàn)象也在其他研究中得到了反映(表1)。
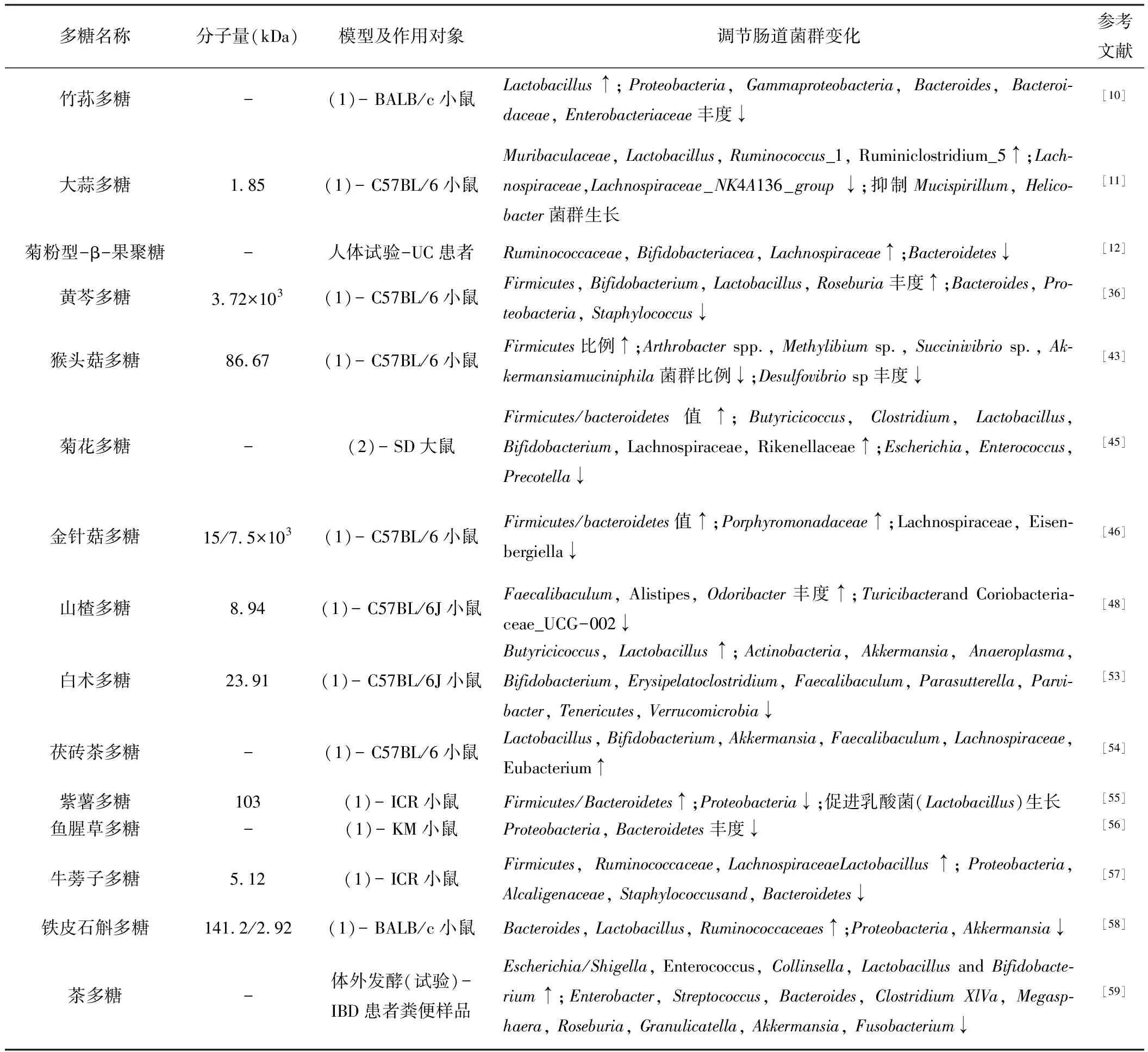
表1 多糖對(duì)UC腸道菌群的調(diào)節(jié)
然而,由于缺乏多糖水解酶,大部分多糖不能被人體直接消化吸收,他們?cè)谀c道菌群的作用下降解,形成次級(jí)代謝物,最終發(fā)酵得到SCFAs。作為主要的下游代謝物,SCFAs經(jīng)腸上皮吸收進(jìn)入循環(huán)系統(tǒng),或被腸細(xì)胞自身利用,在改善腸道通透性、抗炎、調(diào)節(jié)UC腸道健康方面發(fā)揮重要作用[47]。GUO等[48]觀察到山楂多糖干預(yù)UC小鼠后,以Alistipes和Odoribacter菌屬為代表的擬桿菌門明顯富集,這與糞便中乙酸及丙酸的產(chǎn)生呈正相關(guān),接著他們利用LPS處理的大鼠腸上皮細(xì)胞(ICE-6)模型驗(yàn)證乙酸和丙酸的抗炎活性,結(jié)果顯示乙酸作用更強(qiáng),提示乙酸可能是山楂多糖抑制結(jié)腸炎癥的關(guān)鍵代謝物。GPR(G protein-coupled receptor)41、GPR43是SCFAs的受體,在炎癥、代謝和過敏性疾病中表現(xiàn)出不同的功能[49]。SHAO等[50]在研究猴頭菇菌絲體多糖治療醋酸型UC大鼠時(shí),采用氣相-質(zhì)譜聯(lián)用法(GC-MS)檢測結(jié)腸內(nèi)容物中SCFAs的比例,與模型組相比,藥物組乙酸和丁酸的相對(duì)比例呈劑量依賴性增加,同時(shí)結(jié)腸組織中GPR41、GPR43的表達(dá)也隨之提高,表明猴頭菌菌絲多糖抗UC機(jī)制與調(diào)節(jié)短鏈脂肪酸含量、激活相關(guān)受體信號(hào)通路有關(guān)。無獨(dú)有偶,TANG等[51]的研究證實(shí)了特定劑量的黃芪多糖和黨參多糖聯(lián)合給藥可改善UC小鼠的臨床癥狀,減輕結(jié)腸黏膜損傷,作用機(jī)制與上調(diào)糞便中異戊酸及丁酸水平,激活芳香烴受體(AhR)相關(guān),這也為中藥配伍治療UC提供了理論依據(jù)。
腸道微生物產(chǎn)生的代謝物除SCFAs外,還包括多胺、二級(jí)膽汁酸、膽堿代謝產(chǎn)物、脂類等,在代謝組學(xué)水平上,它們的變化也是UC的一個(gè)重要特征[52]。FENG等[53]使用非靶向代謝組學(xué)手段來檢測白術(shù)多糖治療UC小鼠后腸道糞便及血漿代謝物的變化水平,發(fā)現(xiàn)白術(shù)多糖可改變尸胺、纈氨酸、亮氨酸、5-氨基戊酰胺、甘膽酸、熊去氧膽酸等多種代謝物的含量,構(gòu)建了包含“菌群-代謝物-表型”的信息關(guān)聯(lián)網(wǎng)絡(luò),為全面理解白術(shù)多糖調(diào)節(jié)UC的機(jī)制提供了重要信息。YANG等[54]注意到茯磚茶多糖(FBTP)干預(yù)UC小鼠后,色氨酸代謝途徑受到了明顯影響,采用UPLC-QqQ-MS法測定小鼠糞便中色氨酸及其代謝物的含量,結(jié)果表明FBTP可明顯抑制UC小鼠色氨酸和吲哚-3-乙酰胺(indole-3-acetamide,IAM)的水平,顯著提高小鼠糞便中吲哚-3-乙酸(indole-3-acetic acid,IAA)和吲哚-3-乙醛(indole-3-acetaldehyde,IAld)的水平,其中IAA的變化與乳酸菌豐度呈正相關(guān),提示FBTP通過調(diào)節(jié)腸道菌群紊亂來促進(jìn)色氨酸代謝;此外,IAA和IAld的增加也能激活A(yù)hR信號(hào)通路,增加IL-22的表達(dá),從而修復(fù)腸道上皮屏障。
如上所述可知,建立“多糖-腸道菌群-UC”的聯(lián)系,明確多糖的益生機(jī)制,對(duì)開發(fā)安全有效的抗UC藥物具有一定的理論指導(dǎo)意義。
2.4 其他調(diào)節(jié)機(jī)制
炎癥損傷是UC的重要病理過程,除了細(xì)胞因子的分泌異常,還包括過度氧化應(yīng)激。氧化應(yīng)激的主要特征是丙二醛(MDA)的過量產(chǎn)生和谷胱甘肽-過氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)、過氧化氫酶(CAT)等抗氧化酶活性的降低。此外,過量的髓過氧化物酶(MPO)、一氧化氮(NO)也導(dǎo)致UC結(jié)腸組織中炎癥細(xì)胞的浸潤[60]。多糖可修復(fù)結(jié)腸氧化損傷來緩解UC癥狀。REN等[43]發(fā)現(xiàn)猴頭菇多糖干預(yù)炎癥小鼠后結(jié)腸中NO、MDA的含量降低,T-SOD的活性顯著升高,表明猴頭菇多糖可通過抑制UC小鼠體內(nèi)氧化應(yīng)激反應(yīng)來減輕結(jié)腸炎癥反應(yīng)。LIU等[38]的研究證實(shí)蘆薈多糖具有調(diào)節(jié)抗氧化系統(tǒng)平衡(提高GSH、SOD、CAT酶活性,降低MDA水平)的重要作用,從而改善結(jié)腸抗氧化狀態(tài)。
自噬是細(xì)胞應(yīng)激反應(yīng)中降解蛋白質(zhì)、細(xì)胞器和循環(huán)物質(zhì)的動(dòng)態(tài)生物學(xué)過程。在此過程中,自噬小體外膜與溶酶體融合形成自噬溶酶體,最后降解包裹內(nèi)容物,維持細(xì)胞內(nèi)穩(wěn)態(tài)[61]。功能失調(diào)的自噬會(huì)引起多種疾病的產(chǎn)生,其中,自噬與IBD的相互作用也受到學(xué)者的廣泛關(guān)注。
天然多糖調(diào)節(jié)細(xì)胞自噬的相關(guān)研究為探究治療UC的靶點(diǎn)提供了新的見解。LI等[62]檢測到DSS誘導(dǎo)型結(jié)腸炎中小鼠結(jié)腸組織自噬標(biāo)記物L(fēng)C3-2和LC3-1的比值明顯升高,自噬相關(guān)蛋白ULK1、p62、Beclin-1、LC3的表達(dá)水平下降,提示結(jié)腸損傷可能是過度自噬所造成的;給予血紅密孔菌多糖(PPS)后則能逆轉(zhuǎn)上述指標(biāo)的變化,且緊密連接蛋白(ZO-1和E-cadherin)的表達(dá)水平得以恢復(fù),說明PPS可能依賴于自噬抑制調(diào)節(jié)結(jié)腸炎的腸道穩(wěn)態(tài)。然而,自噬對(duì)腸黏膜的穩(wěn)態(tài)調(diào)控是雙向的。另一項(xiàng)關(guān)于人參多糖(GP)與糞菌移植(FMT)聯(lián)合治療結(jié)腸炎大鼠的研究中,WANG等[63]發(fā)現(xiàn)激活細(xì)胞自噬可抑制氧化應(yīng)激、阻斷炎癥級(jí)聯(lián)反應(yīng)來緩解腸道炎癥,其機(jī)制與人參多糖調(diào)節(jié)腸道菌結(jié)構(gòu),抑制Toll樣受體-髓樣分化因子88-MAPKs(TLR4-MyD88-MAPKs)信號(hào)通路,激活哺乳動(dòng)物雷帕霉素靶蛋白(mTOR)依賴性自噬(腸道菌群-TLR4-mTOR軸)相關(guān)。目前,從自噬角度闡釋多糖與潰瘍性結(jié)腸炎相互作用的報(bào)道還較少,但已有的數(shù)據(jù)為進(jìn)一步闡明“多糖-自噬-UC”關(guān)聯(lián)軸提供了參考依據(jù)。
3 結(jié)語
天然多糖治療UC具有安全、療效確切、低毒副作用等優(yōu)點(diǎn)。多糖可通過修復(fù)腸道上皮及黏膜屏障,介導(dǎo)腸道免疫應(yīng)答反應(yīng)、調(diào)節(jié)腸道菌群及其代謝物水平、抗氧化應(yīng)激、參與細(xì)胞自噬等途徑緩解UC癥狀,改善腸道炎癥反應(yīng)。
然而,系統(tǒng)地推進(jìn)天然多糖成為抗UC新藥物或其輔助品,仍具有潛在的挑戰(zhàn)性。未來可能的研究應(yīng)解決以下問題:(1)多糖結(jié)構(gòu)復(fù)雜,用于樣品制備和化學(xué)表征的方法重復(fù)性較差,使得多糖質(zhì)量控制較為困難,阻礙了其產(chǎn)品的研究與開發(fā),有必要進(jìn)一步提高質(zhì)控方面的相關(guān)研究;(2)多糖經(jīng)口服進(jìn)入人體后不能被直接消化吸收,需在腸道菌群的分解、發(fā)酵作用下才能被機(jī)體利用。盡管本文從UC發(fā)病的綜合角度出發(fā),闡述了多糖干預(yù)治療UC的作用機(jī)制,但多糖與腸道菌群互作的特殊性對(duì)腸道穩(wěn)態(tài)的發(fā)展是不容忽視的,需要更充分的證據(jù)來明確“多糖-腸道菌-UC”之間的關(guān)聯(lián);(3)目前針對(duì)多糖治療UC的研究多數(shù)還處于動(dòng)物實(shí)驗(yàn)階段,缺乏臨床應(yīng)用研究,因此其臨床實(shí)用性有待考究;(4)隨著各種組學(xué)技術(shù)的高速發(fā)展,特別是高通量測序技術(shù),使得識(shí)別多糖生物轉(zhuǎn)化過程的關(guān)鍵功能菌變得更加快捷、簡便。利用多組學(xué)關(guān)聯(lián)分析也有助于揭示多糖“多靶點(diǎn)”干預(yù)UC的作用特性,但需注意的是多組學(xué)數(shù)據(jù)分析的重復(fù)性及因果關(guān)系,以便形成可驗(yàn)證的數(shù)據(jù)評(píng)價(jià)系統(tǒng);(5)開發(fā)天然多糖靶向遞藥系統(tǒng)或多糖修飾藥物,探索多糖與其他藥物聯(lián)合應(yīng)用的綜合治療模式將有助于解決UC傳統(tǒng)藥物治療帶來的弊端,提高UC患者生活質(zhì)量。

