MCM2、MCM4、MCM10在胰腺癌中的表達和預后價值及其作用機制
賈如江,趙樹山,尹清臣,劉秀麗,楊龍龍,溫桂海
(邯鄲市中心醫院普一科,邯鄲 056102)
微小染色體維持(minichromosome maintenance,MCM)蛋白家族廣泛存在于真核生物細胞中,參與DNA復制前復合物的形成、DNA復制的起始及DNA的延長。由MCM2~MCM7這6個保守且高度同源的蛋白組成環形結構的親水性六聚體復合物是真核細胞DNA復制前復合體的關鍵組分,與DNA復制的穩定性和準確性存在密切聯系,是DNA復制與延伸所必需的。其功能失調可導致染色體缺陷,進而可能導致腫瘤的形成[1-2]。基于基因表達譜芯片的分析顯示,MCM4可作為喉鱗狀細胞癌的分子標志物[3]。胰腺癌是惡性程度最高的腫瘤之一。本研究基于生物信息學方法分析MCM2、MCM4、MCM10在胰腺癌中的表達,分析其臨床意義及其與預后的關系,以期為胰腺癌精準治療提供新的靶點。
1 材料與方法
1.1 在線數據庫分析MCM2、MCM4、MCM10在胰腺癌中的表達
GEPIA數據庫(gepia.cancer-pku.cn/)即基因表達譜數據動態分析,是由北京大學開發的在線數據庫,可結合TCGA(The Cancer Genome Atlas,http://cancer.gov/)和GTEx(https://gtexportal.org)數據庫分析基因在不同腫瘤中的表達情況。本研究利用GEPIA數據庫在線分析MCM2、MCM4、MCM10的mRNA在胰腺癌與正常胰腺組織中的表達差異。HPA(Human Protein Atlas)數據庫(http://proteinatlas.org/)可提供人類蛋白質的組織和細胞分布信息。本研究利用HPA數據庫在線分析MCM2、MCM4、MCM10蛋白在胰腺癌中的表達,且從TCGA數據庫中下載胰腺癌數據分析MCM2、MCM4、MCM10基因的表達與胰腺癌分期的關系。
1.2 在線數據庫預后分析
利用GEPIA數據庫分析MCM2、MCM4、MCM10基因的表達與胰腺癌患者的無病生存率(disease-free survival,DFS)、總生存率(overall survival,OS)的關系,以及胰腺癌中MCM2、MCM4、MCM10蛋白表達的相關性。利用HPA數據庫在線檢索MCM2、MCM4、MCM10在TCGA RNA標本庫中的表達量,分析其RNA的表達與胰腺癌患者生存的關系。
1.3 String-DB數據庫
String-DB數據庫(https://string-db.org)是生物基因和蛋白質相互作用分析的檢索平臺,包含了已證實和可預測的蛋白-蛋白相互作用生物數據庫,也包括了蛋白質之間間接功能的相關性。它除了包含有試驗數據、從PubMed摘要中挖掘的結果和綜合其他數據庫數據外,還包括利用生物信息學的方法預測的結果。本研究在線數據庫檢索條件輸入“MCM2、MCM4、MCM10”,物種選擇“homo sapiens”,置信度選擇“Medium 0.4”,相互作用選擇連接數不超過10,最后進行檢索。
1.4 Metascape進行富集分析
進一步采用Metascape數據庫(https://metascape.org/)對MCM2、MCM4、MCM10及相關作用基因進行基因本體(gene ontology,GO)富集分析。
1.5 統計學分析
2 結果與分析
2.1 HPA數據庫分析MCM2、MCM4蛋白的表達
HPA數據庫中在線分析MCM2、MCM4、MCM10蛋白在胰腺癌中的表達。免疫組織化學分析結果顯示:MCM2(抗體HPA031496)在11例胰腺癌中有2例高表達,6例中表達,1例低表達,2例陰性表達(圖1);MCM4(抗體HPA031496)在12例胰腺癌中有4例高表達,2例中表達,5例低表達,1例陰性表達(圖2)。該數據庫中未檢測到MCM10在胰腺癌中的陽性表達。本研究對從TCGA數據庫中下載胰腺癌數據進行了分析,其結果顯示,MCM2、MCM4、MCM10的基因表達與胰腺癌分期無明顯的相關性(P>0.05)。

圖1 MCM2在胰腺癌組織中的表達(免疫組化,100×)Fig. 1 MCM2 were expressed in pancreatic cancer tissue (immunohistochemical, 100×)(a)高表達;(b)中表達;(c)低表達;(d)陰性表達。(a) High expression; (b) Medium expression; (c) Low expression; (d) Negative expression.
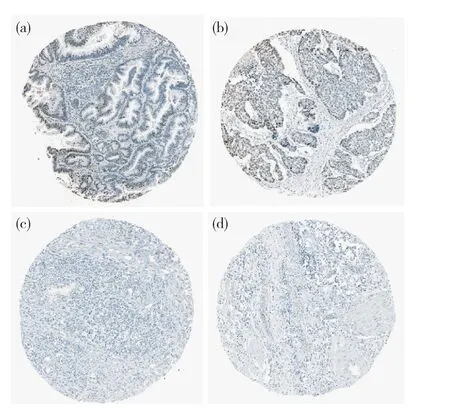
圖2 MCM4在胰腺癌組織中的表達(免疫組化,100×)Fig. 2 MCM4 were expressed in pancreatic cancer tissue (immunohistochemical, 100×)(a)高表達;(b)中表達;(c)低表達;(d)陰性表達。(a) High expression; (b) Medium expression; (c) Low expression; (d) Negative expression.
2.2 在線軟件GEPIA數據庫統計分析
根據在線GEPIA數據庫的分析,納入的179例胰腺癌組織和171例正常胰腺組織的對比結果顯示,MCM2、MCM4、MCM10的表達差異有統計學意義(P<0.05)(圖3)。
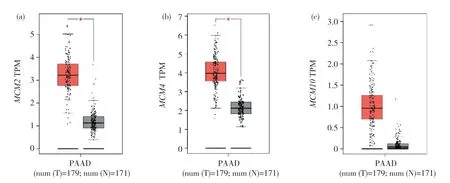
圖3 GEPIA分析MCM2、MCM4、MCM10在胰腺癌組織和正常胰腺組織中的表達差異Fig. 3 GEPIA analysis of the differential expression of MCM2, MCM4, and MCM10 in pancreatic cancer tissues and normal pancreatic tissues(a)MCM2;(b)MCM4;(c)MCM10。 (a) MCM2; (b) MCM4; (c) MCM10.
2.3 在線數據庫檢測MCM2、MCM4、MCM10 mRNA與胰腺癌預后的關系
在GEPIA數據庫中利用Kaplan-Meier法分析MCM2、MCM4、MCM10mRNA的表達水平與胰腺癌患者的DFS和OS的關系,結果提示,MCM2、MCM4、MCM10mRNA高表達組的胰腺導管腺癌(pancreatic ductal adenocarcinoma,PAAD)患者的DFS和OS(P<0.005)均明顯低于低表達組(圖4)。為進一步分析MCM2、MCM4、MCM10mRNA的表達與胰腺癌患者遠期預后的關系,本研究在HPA數據庫中共分析了176例患者的胰腺癌組織,結果顯示,MCM2、MCM4、MCM10mRNA的FPKM的平均表達數值為6.17、6.13、0.62;預后分析結果顯示,當MCM2、MCM4、MCM10mRNA的表達節點的FPKM的平均表達數值分別設定為6.17 、6.13、0.62時,MCM2、MCM4、MCM10mRNA的表達與胰腺癌患者的預后存在明顯的相關性,其高表達組相比較低表達組預后較差(P=0.00140,P=0.00024,P=0.00028)(圖5)。

圖4 GEPIA分析MCM2、MCM4、MCM10表達對胰腺癌患者的DFS和OS的影響Fig. 4 GEPIA analyzed the effects of different MCM2, MCM4, and MCM10 expression on the DFS and OS in pancreatic cancer patients(a)MCM2;(b)MCM4;(c)MCM10。 (a) MCM2; (b) MCM4; (c) MCM10.
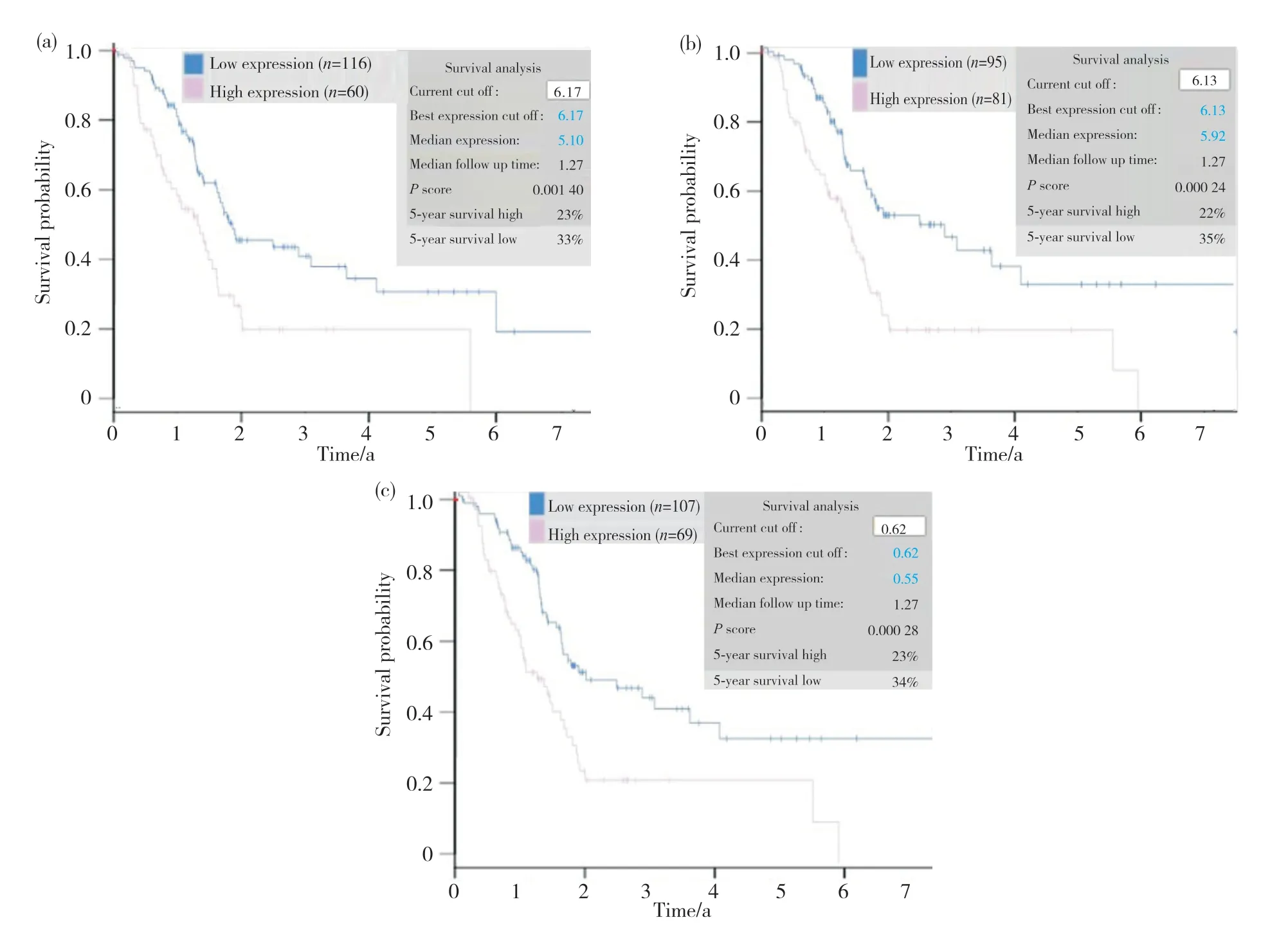
圖5 MCM2、MCM4、MCM10表達胰腺癌患者的總體生存曲線比較Fig. 5 Comparison of the overall survival curves for patients with pancreatic cancer expressing MCM 2, MCM4, and MCM10(a)MCM2;(b)MCM4;(c)MCM10。 (a) MCM2; (b) MCM4; (c) MCM10.
2.4 MCM2、MCM4、MCM10基因表達的相關性分析
利用GEPIA數據庫分析胰腺中MCM2、MCM4、MCM10基因表達的相關性,結果顯示,MCM2與MCM4(r=0.71)、MCM4與MCM10(r=0.71)、MCM2與MCM10(r=0.67)表達關系密切,具有明顯的相關性,差異有統計學意義(圖6)。
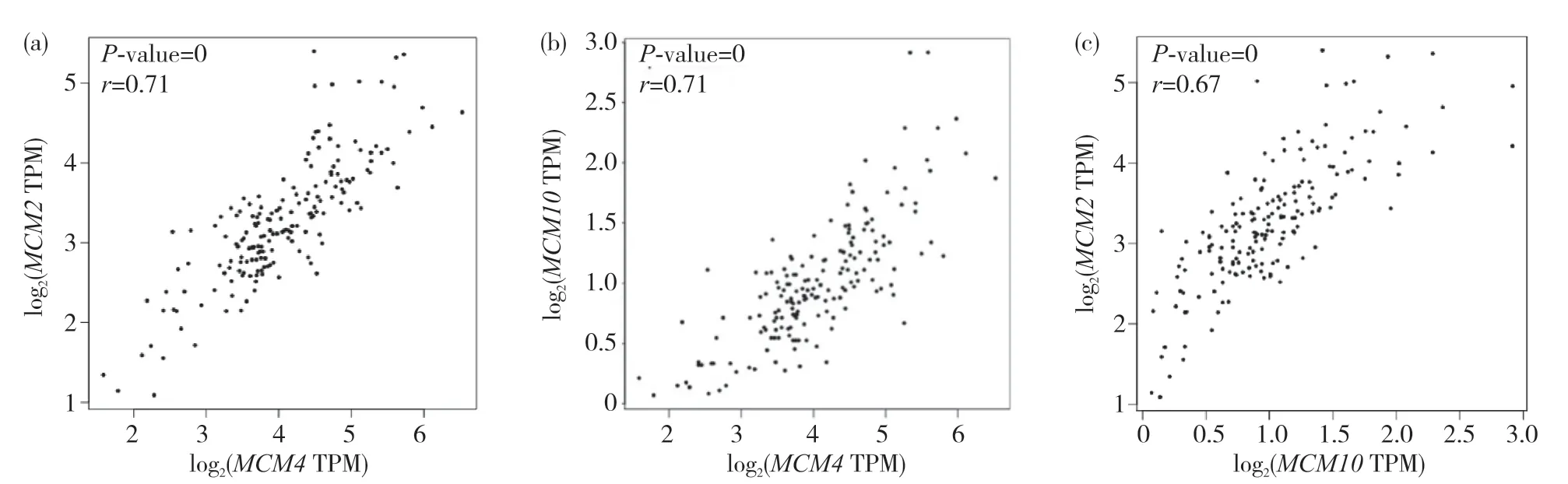
圖6 GEPIA數據庫分析胰腺癌中MCM2、MCM4、MCM10表達的關系Fig. 6 Analysis of MCM2, MCM4, and MCM10 expression relationship by the GEPIA database in pancreatic cancer(a)MCM2與MCM4的表達關系;(b)MCM10與MCM4的表達關系;(c)MCM2與MCM10的表達關系。(a)Expression relationship of MCM2 and MCM4; (b) Expression relationship of MCM10 and MCM4; (c) Expression relationship of MCM2 and MCM10.
2.5 String-DB數據庫
蛋白質相互作用網絡(protein-protein interaction networks,PPI)富集分析結果顯示(圖7):在PPI網絡中,預測的與MCM2、MCM4、MCM10具有密切相互作用的蛋白有MCM5、MCM6、RPA3、RPA1、POLA2、ORC2、ORC3、DBF4、CDC6和GINS2(P<1.0e-16)等。

圖7 與MCM2、MCM4、MCM10相關的蛋白網絡的分析Fig. 7 Analysis of the protein network associated with MCM2, MCM4, and MCM10
2.6 Metascape對MCM2、MCM4、MCM10及相關作用基因進行GO富集分析
利用Metascape數據庫對MCM2、MCM4、MCM10及相關作用基因進行GO富集分析,發現其主要富集在前復制復合體的活化、DNA復制、DNA合成、DNA復制的啟動、細胞核DNA的復制、CDC6相關的復制起點識別復合物、皮瓣轉移、介導通路、體溫自動調節通路等信號通路中。柱狀圖為top 8的顯示富集的條目(圖8)。

圖8 MCM2、MCM4、MCM10及相關作用基因富集分析Fig. 8 Enrichment analysis of MCM2, MCM4, MCM10, and related role genes
3 討論
胰腺癌是惡性程度最高、預后最差的消化道惡性腫瘤之一[4-5],其5年生存率不足10%[6]。近年來其發病率有明顯的上升趨勢。我國胰腺癌發病率居所有惡性腫瘤第10位,死亡率居第6位[7]。MCM家族包括MCM2~MCM10這9種進化高度保守的家族蛋白,是DNA復制過程中的通行證,可控制細胞周期從G1期向S期進展[8-9],在復制起始過程中具有解螺旋酶的活性,在細胞周期內控制復制起始時間上具有重要作用[10]。MCM4是潛在的食管癌增殖的新型標志物[11]。MCM4、MCM6和MCM10的表達水平與腫瘤進展呈正相關關系[12-13]。MCM2、MCM4、MCM8和MCM10的過表達與胰腺癌的不良預后有關[14]。MCM家族在DNA復制與細胞周期進程和檢查點調控結合等方面具有重要作用,有望成為胰腺癌治療中的重要靶點[15]。
本研究通過在線數據庫對MCM2、MCM4和MCM10進行檢索,其結果充分表明,MCM2、MCM4和MCM10基因在胰腺導管腺癌中高表達,并且其高表達的胰腺癌患者預后較差。這預示MCM2、MCM4和MCM10可能能夠成為胰腺癌新的預后標記物。
有趣的是,本研究檢測到MCM2、MCM4蛋白在胰腺癌中高表達,但是未檢測到MCM10在胰腺癌中表達,這一結果和基因表達層面不吻合,分析原因可能是與基因表達與蛋白生成之間會總受到相關因素干擾有關,需要我們進一步通過基礎試驗研究來尋找答案。本研究分析顯示,MCM2、MCM4、MCM10基因表達與胰腺癌分期無明顯相關性,原因可能是大數據庫的病例收集入庫存在一定的偏頗,下載的胰腺癌數據庫中Ⅰ期病例和Ⅲ、Ⅳ期病例均較少,影響了分析結果的科學性。
胰腺癌具有間質成分較多的特性[16-17]。臨床胰腺癌對化療敏感性差,易出現耐藥性。探索解決胰腺癌化療耐藥性是目前研究的熱點問題[18]。有研究證明,減少過量的MCM復合物可以增加腫瘤細胞對化療的敏感性,通過下調MCM4部分降低MCM復合物,可增加胰腺癌細胞對吉西他濱和氟尿嘧啶的敏感性[19]。
本研究基因富集分析發現,MCM2、MCM4、MCM10及其密切作用的相關蛋白主要富集在前復制復合體的活化、DNA復制、DNA合成、DNA復制的啟動、細胞核DNA的復制、CDC6相關的復制起點識別復合物、Flap連結的移除、體溫自動調節通路等信號通路中。我們的研究認為,MCM2、MCM4、MCM10在胰腺癌中高表達,并且表達具有明顯的相關性,三者構成MCM家族在胰腺癌中的主要成分,構成功能模塊,通過前復制復合體的活化、DNA復制、DNA合成、DNA復制的啟動、細胞核DNA的復制、CDC6相關的復制起點識別復合物等生物過程參與胰腺癌細胞的發生與發展,甚至可能影響胰腺癌耐藥性的發生,從而影響胰腺癌患者的預后。MCM2、MCM4、MCM10在胰腺癌中功能模塊的發現有望為胰腺癌的靶標治療提供新的方向。
綜上所述,本研究利用生物信息學數據庫分析了MCM家族中MCM2、MCM4、MCM10在胰腺癌患者中的表達差異及其與胰腺癌患者預后的相關性,并推測其可能存在的作用機制,為胰腺癌的精準治療提供了新的方向,但是仍需要進一步的試驗研究證實,以期為胰腺癌的臨床治療提供新的靶點。

