BDNF對過敏性哮喘小鼠氣道炎癥影響的研究
聶 穎,張領領,胡軍峰,徐輝甫
(武漢市第一醫院兒科,湖北 武漢 430022)
支氣管哮喘(哮喘)是兒童中常見的慢性肺部疾病,兒童哮喘因病情反復發作、遷延不愈等特點,對其身心健康及家庭和社會帶來了巨大的經濟、精神負擔[1]。目前全球約有3億哮喘患者,其中兒童發病率約占總發病率的一半[2]。中國16城市兒童哮喘患病率20年對比研究顯示,0~14歲中國兒童哮喘的總患病率較10年及20年前分別上升了43.4%和147.9%[3]。近年來,腦源性神經生長因子(brain-derived neurotropic factors,BDNF)參與哮喘氣道炎癥反應的過程日益受到關注。臨床研究表明,BDNF不僅參與了兒童哮喘的發病,且與兒童哮喘發病的嚴重程度呈正相關,但其具體機制尚不明確[4-5]。本研究通過建立過敏性哮喘小鼠模型,運用重組人BDNF及其抑制劑TrkB/Fc對哮喘模型進行干預,觀察干預肺組織中BDNF表達的變化及氣道炎癥、炎癥相關因子白細胞介素-17A(IL-17A)、嗜酸性粒細胞趨化因子(Eotaxin)表達的變化情況,探討BDNF參與哮喘氣道炎癥的分子機制,為兒童哮喘的病情評估及精準治療提供理論依據。
1 材料與方法
1.1 主要材料及實驗動物
1.1.1 主要材料
雞卵清蛋白(ovlbumin,OVA,Sigma公司),重組人BDNF(美國PeproTech),TrkB/Fc(美國R&D公司);一抗:Anti-BDNF(美國Abcam公司);二抗:山羊抗兔辣根過氧化物酶(美國Santa Cruz公司);小鼠IL-17A ELISA試劑盒(美國R&D公司)、小鼠Eotaxin ELISA試劑盒(美國R&D公司)。
1.1.2 實驗動物
經過倫理委員會批準,選取2019年10月至12月飼養于武漢市第一醫院SPF級實驗動物中心的雌性3~4周齡C57/B6J小鼠40只,體重10~12g。該實驗獲武漢市第一醫院動物保護和利用委員會批準。動物飼養穩定于約25℃,相對濕度約70%,晝夜照明12/12h。
1.2 實驗方法
1.2.1 哮喘模型的建立
依據有關參考文獻[6]建立哮喘小鼠動物模型。哮喘組小鼠于第1、13天經其腹腔注射0.01%OVA/A1(OH)3,混合液0.1mL[內含OVA 10μg和A1(OH)3凝膠20mg]致敏,從第25天開始,每天以1%OVA生理鹽水溶液霧化激發30min,連續7天。正常對照組小鼠致敏及激發時均以生理鹽水替代OVA。
1.2.2 實驗動物的分組及藥物的干預
以隨機數字表法將實驗動物分為五組,每組8只,分別為A組:正常對照組;B1組:哮喘組(模型未干預組);B2組:哮喘+生理鹽水干預組;B3組:哮喘+重組人BDNF干預組;B4組:哮喘+TrkB/Fc干預組。模型激發的第25天開始,激發前1h將各干預組小鼠以10%水合氯醛4mL/kg腹腔注射麻醉,剪開頸部皮膚行氣道插管,將2μg/小鼠的重組人BDNF或1μg/小鼠的TrkB/Fc溶解于50μL的0.9%氯化鈉中,氣道內滴注給藥,連續7天,每日1次。
1.2.3 HE染色及肺組織的病理評分
石蠟切片二甲苯脫蠟,酒精脫水,置于HE染色5min,酒精分化10s,流水沖洗返藍20min,HE染色20s,脫水、透明、中性樹膠封片,顯微鏡下觀察。
肺組織的病理評分參照Lee等[7]的評分標準,支氣管周圍炎癥細胞浸潤程度判定:0分為沒有炎癥細胞;1分為可偶見炎癥細胞;2分為可見薄層(1~5個)炎癥細胞;3分為可見厚層(>5個)炎癥細胞。
1.2.4 Western blot法檢測肺組織中BDNF蛋白的表達
肺組織50mg置于勻漿管中加入組織裂解液500μL裂解30min,提取蛋白并調整蛋白濃度。樣品加熱變性后電泳轉至聚偏二乙烯(PVDF)膜上。5%脫脂奶粉TTBS緩沖液室溫振蕩封閉2h后洗膜,加入一抗羊抗鼠BDNF單克隆抗體(1∶1 000,Abcam公司)4℃室溫孵育過夜,第2天加入二抗辣根酶標記羊抗兔(1:5 000,Santa Cruz公司)室溫孵育1h,小鼠β-actin作內參照,用LAS3000圖像分析系統,以目的蛋白與β-actin灰度值的比值進行定量分析。
1.2.5 ELISA法檢測肺組織中IL-17A、Eotaxin水平
采用ELISA法檢測IL-17A、Eotaxin水平,嚴格按照試劑盒說明書進行具體操作。
1.3 統計學方法
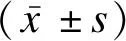
2 結果
2.1 各組小鼠肺組織病理學形態改變及肺組織的病理評分
2.1.1 肺組織的病理改變
正常對照組(A組)小鼠細支氣管和肺泡壁結構清晰,無炎癥細胞浸潤;哮喘組(B1組)小鼠細支氣管周圍可見大量炎癥細胞浸潤,基底膜增厚;哮喘+生理鹽水干預組(B2組)小鼠細支氣管周圍可見大量炎癥細胞浸潤,上皮細胞增生,肺泡間隔增寬;哮喘+重組人BDNF干預組(B3組)小鼠細支氣管周圍可見大量炎癥細胞浸潤,黏液分泌增多、管腔狹窄,平滑肌層、基底層增厚,較B1組、B2組炎癥細胞浸潤情況明顯加重;哮喘+TrkB/Fc干預組(B4組)小鼠細支氣管周圍可見炎癥細胞浸潤,較B1組明顯減輕,見圖1。
2.1.2 肺組織的病理評分
五組的肺組織病理評分比較差異有統計學意義(P<0.01);B1、B2、B3、B4組的病理評分均顯著高于A組(P<0.01);B2組與B1組病理評分比較差異無統計學意義(P>0.05),B3組病理評分顯著高于B1組(P<0.01),B4組病理評分顯著低于B1組(P<0.01);B3組病理評分顯著高于B2組(P<0.01),B4組病理評分顯著低于B2組(P<0.01);B4組病理評分顯著低于B3組(P<0.01),見表1。
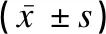
表1 各組小鼠肺組織的病理評分的比較Table 1 Comparison of pathological score of lung tissues of the mice among the five groups
2.2 各組小鼠肺組織中BDNF蛋白的表達
應用Western blot法檢測蛋白的表達,五組的肺組織中BDNF蛋白表達比較差異有統計學意義(P<0.01);B1、B2、B3組的BDNF蛋白表達均高于A組(P<0.01),B4組與A組BDNF蛋白表達比較差異無統計學意義(P>0.05);B2組與B1組BDNF蛋白表達比較差異無統計學意義(P>0.05),B3組BDNF蛋白表達顯著高于B1組(P<0.05),B4組BDNF蛋白表達顯著低于B1組(P<0.01);B3組BDNF蛋白表達顯著高于B2組(P<0.01),B4組BDNF蛋白表達顯著低于B2組(P<0.01);B4組BDNF蛋白表達顯著低于B3組(P<0.01),見圖2、表2。
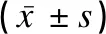
表2 各組小鼠肺組織BDNF蛋白表達的比較Table 2 Comparison of expression level of BDNF protein in lung tissues of the mice among the five groups
2.3 各組小鼠肺組織中IL-17A和Eotaxin水平的表達
2.3.1 各組小鼠肺組織中IL-17A水平的表達
應用ELISA法檢測IL-17A水平,五組的IL-17A水平比較差異有統計學意義(P<0.01);B1、B2、B3、B4組的IL-17A水平均顯著高于A組(P<0.01);B2組與B1組IL-17A水平比較差異無統計學意義(P>0.05),B3組IL-17A水平顯著高于B1組(P<0.01),B4組IL-17A水平顯著低于B1組(P<0.05);B3組IL-17A水平顯著高于B2組(P<0.01),B4組IL-17A水平顯著低于B2組(P<0.01);B4組IL-17A水平顯著低于B3組(P<0.01),見表3。
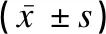
表3 各組小鼠肺組織中IL-17A水平的比較Table 3 Comparison of IL-17 level in lung tissues of the mice among the five groups
2.3.2 各組小鼠肺組織中Eotaxin水平的表達
應用ELISA法檢測Eotaxin水平,五組的Eotaxin水平比較差異有統計學意義(P<0.01);B1、B2、B3、B4組的Eotaxin水平均顯著高于A組(P<0.01);B2組與B1組Eotaxin水平比較差異無統計學意義(P>0.05),B3組Eotaxin水平顯著高于B1組(P<0.01),B4組Eotaxin水平顯著低于B1組(P<0.01);B3組Eotaxin水平顯著高于B2組(P<0.01),B4組Eotaxin水平顯著低于B2組(P<0.01);B4組Eotaxin水平顯著低于B3組(P<0.01),見表4。
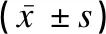
表4 各組小鼠肺組織中Eotaxin水平的比較Table 4 Comparison of Eotaxin level in lung tissues of the mice among the five groups
3 討論
3.1 BDNF促進兒童哮喘氣道炎癥的發生
馮帥等[8]研究表明,BDNF Val66Met基因多態性(Val/Val、Met/Met)在哮喘患兒中顯著升高,說明功能性BDNF的多態性(rs6265)與兒童哮喘呈正相關,且助于兒童嚴重哮喘的形成。本研究發現,哮喘小鼠肺組織中BDNF呈過表達狀態(P<0.01);同時運用重組人BDNF或其抑制劑TrkB/Fc對模型進行干預發現,哮喘+重組人BDNF干預組肺組織中炎癥細胞浸潤較哮喘組明顯加重,而哮喘+TrkB/Fc干預組肺組織中炎癥細胞浸潤較哮喘組明顯減輕,說明BNDF參與哮喘氣道炎癥的發生過程,BDNF高表達可誘導、趨化氣道炎癥因子的釋放。Freeman等[9]研究顯示,在人類氣道平滑肌細胞(ASM)中存在通過囊泡自分泌BDNF,其通過對受體電位3(TRPC3)通道的調節,使Ca2+內流增加氣道張力及促進氣道炎性因子IL-1β、腫瘤壞死因子-α(TNF-α)的釋放。Müller等[10]對6~15歲哮喘持續期患兒的血漿BDNF水平和各種炎癥標志物(CCL3、CCL11、CCL22、CCL24等)進行檢測發現,中、重度哮喘患兒BDNF水平顯著增高,而其他各種炎癥標志物與對照組均無差異,提示BDNF是一種潛在的哮喘患兒臨床嚴重程度的生物標志物。由此提示BDNF參與了兒童哮喘氣道炎癥的發生,在哮喘的發病過程中起促進作用。故本研究通過BDNF對哮喘小鼠進行干預,以氣道炎癥為切入點,了解其下游氣道炎癥介質的變化,進一步明確其分子機制,為兒童哮喘的診斷、預防及治療提供新的思路。
3.2 BDNF介導氣道炎癥因子IL-17A和Eotaxin的釋放促進氣道炎癥的發生
本研究顯示,與正常對照組比較,哮喘小鼠的氣道炎癥因子IL-17A、Eotaxin均呈高表達(P<0.01);而哮喘+重組人BDNF干預組中IL-17A、Eotaxin的表達均較哮喘組顯著升高(P<0.01),哮喘+TrkB/Fc干預組中IL-17A、Eotaxin的表達均顯著低于哮喘組(P<0.05)。IL-17通常是指IL-17A,是IL-17家族中最先被發現的細胞因子,是Th1細胞重要的效應因子;IL-17A通過參與炎癥反應和宿主抗感染免疫,直接或間接地參與了哮喘的病理生理過程[11]。在兒童哮喘發作期,患兒血清中IL-17表達顯著增高,且經治療后IL-17表達顯著下降,故IL-17參與了哮喘的發病,且與兒童哮喘病情嚴重程度正相關[12-13]。在幼年哮喘大鼠模型中,IL-17可通過誘導CCL4、CXCL1、GM-CSF等細胞因子的表達,促進炎性因子的激活和炎性細胞向氣道的浸潤,由此提示IL-17在兒童哮喘氣道炎癥中發揮著重要作用[14]。研究表明,嗜酸性粒細胞(eosinophil,EOS)浸潤是哮喘發生的中心環節,在學齡期哮喘患兒急性發作組、慢性持續組和緩解組血中EOS均顯著升高,且與哮喘患兒肺功能呈負相關[15]。Eotaxin是一種β-趨化因子,能特異性地募集、趨化和活化EOS,在哮喘患兒中顯著增高,與其疾病嚴重程度正相關[16]。Eotaxin通過特異性地與EOS上高表達的Eotaxin特異性受體C-C趨化因子受體-3(C-CR3)結合,激活分裂素活化蛋白(MAP)激酶,細胞外信號調節激酶-2(ERK2)和p38,使EOS聚集浸潤,導致氣道上皮細胞活化、炎癥介質釋放而引起氣道炎癥及氣道高反應[17]。結合本研究通過重組人BDNF或其抑制劑TrkB/Fc對哮喘模型進行干預,發現BDNF可促進哮喘氣道炎癥的發生,同時對肺組織細胞因子IL-17A、Eotaxin起正性調節作用,由此提示BDNF可能通過促進氣道炎癥因子IL-17A、Eotaxin的釋放而參與兒童哮喘的發病過程。
3.3 IL-17A和Eotaxin參與氣道炎癥的可能機制及進一步的研究方向
IL-17A與IL-17R復合物結合后可引起氣道上皮細胞、細胞內皮細胞及成纖維細胞中的IL-1β、IL-6、粒細胞巨噬細胞集落刺激因子(GM-CSF)增加,促使中性粒細胞的聚集而參與哮喘的發生[18]。本研究發現,在BDNF干預下,IL-17A和Eotaxin的表達均顯著升高,由此推測,在過敏性哮喘小鼠模型中,BDNF作用于模型后可上調小鼠氣道IL-17A的分泌增多,誘導相關炎癥因子Eotaxin的表達,使EOS活化、聚集而參與哮喘氣道炎癥的發生。IL-17A、Eotaxin均與兒童哮喘發作密切相關,且與兒童哮喘疾病嚴重程度呈正相關,而本研究顯示在哮喘小鼠中IL-17A和Eotaxin呈同步升高,具有一定的關聯性,因此可進一步研究其在幼年哮喘小鼠中的作用機制,為兒童哮喘的評估及治療提供新的思路。

