阿昔莫司對oxLDL誘導泡沫細胞自噬及AMPK/mTOR通路的影響
楊少君 周乃珍 王曉霞
動脈粥樣硬化(atherosclerosis,AS)是缺血性心血管疾病的潛在病理特征,是目前全球范圍內病死率最高的疾病[1]。當巨噬細胞大量吸取來自于人體內氧化低密度脂蛋白(oxidized lowdensity lipoprotein,oxLDL)時,會極大地增加巨噬細胞中的脂滴含量[2],進而發展成為具有AS特征的巨噬源性泡沫細胞,最終形成AS[3]。避免AS的發生,減少泡沫細胞形成[4],是目前科學家們關注的焦點。大量研究表明,自噬可參與調節AS的發生發展過程,并且抑制自噬會加速AS的發展,促進自噬則可抑制AS[5]。AMPK/mTOR通路是參與細胞自噬調節的通路[6],已有研究證明阿托伐他汀可通過此通路激活細胞自噬,進而延緩AS進程[7]。阿昔莫司是一種煙酰類的降脂藥,可參與調控心血管疾病發生,有研究發現,阿昔莫司可明顯降低大鼠高脂飲食造成的血脂升高及頸動脈粥樣硬化[8]。本研究通過探究阿昔莫司對oxLDL誘導泡沫細胞自噬的影響,并進一步探究AMPK/mTOR通路在此過程中的作用,為阿昔莫司治療AS的分子機制提供新依據。
1 材料與方法
1.1 主要材料 人單核細胞株THP-1購自武漢益普科技生物有限公司(貨號:YCL-0233);10%胎牛血清購自美國GEMINI(貨號:900-108);0.25%胰蛋白酶購自美國Hyclone(貨號:SH30042.01B);RPMI-1640培養基購自北京百奧萊博(貨號:GL0182-LWE);阿昔莫司購自美國NIFDC(貨號:CP-100750);氯喹購自美國MP Biomedicals(貨號:0219391910);佛波醇酯購自中國absin(貨號:abs9107);oxLDL購自上海經科(貨號:JK-002);油紅O染色試劑盒購自美國Sciencell(貨號:SC-0843);LC3、P62、p-AMPK、AMPK、p-mTOR、mTOR、GAPDH抗體均購自中國Bioss;AMPK抑制劑Compound C購自美國Merck(貨號:171260-1MG);HRP標記山羊抗兔IgG購自中國萬類生物(貨號:WLA023);聚偏氟乙烯膜(PVDF膜)購自美國Millipore(貨號:IPVH00010);ECL化學發光試劑盒購自上海碧云天(貨號:P0018FM)。
1.2 實驗方法
1.2.1 細胞培養:在RPMI-1640培養基(含10%胎牛血清)中培養人單核細胞株THP-1,在37℃培養箱培養,當單核細胞生長面積>80%培養瓶面積后,進行1次傳代培養(具體詳細操作步驟參考購買細胞時附帶的細胞培養操作指南)。
1.2.2 細胞分組與處理:收集對數期THP-1細胞,添加佛波醇酯(100 ng/ml)培養48 h誘導形成巨噬細胞,將巨噬細胞分為空白組(不添加oxLDL)、對照組、阿昔莫司組、氯喹組、阿昔莫司+氯喹組、Compound C(AMPK抑制劑)組、阿昔莫司+Compound C組,各組均添加對應藥物作用于細胞0.5 h,隨后再添加oxLDL(50 mg/L)培養48 h。
1.2.3 油紅O染色檢測細胞內脂滴含量:收集培養后的空白組、對照組細胞,使用PBS沖洗3次,4%多聚甲醛固定30 min。再次用PBS沖洗3次,油紅O進行染色大約30 min,60%異丙醇進行沖洗5 s,然后立即使用PBS進行漂洗3次,最后使用蘇木素復染3~5 s,迅速使用流水沖洗,最后在顯微鏡下拍照觀察。
1.2.4 透射電子顯微鏡觀察細胞內超微結構:收集培養后的空白組、對照組細胞,用4%戊二醛固定后用PBS漂洗,然后添加1%餓酸固定,用一定濃度梯度的乙醇丙酮脫水,隨后包埋,切片,最后再將切片用乙酸雙氧鈾及檸檬酸鉛染色,于電子顯微鏡下觀察自噬體結構。
1.2.5 Western Blot檢測細胞中自噬相關蛋白LC3、P62及AMPK/mTOR通路相關蛋白p-AMPK、AMPK、p-mTOR、mTOR表達:收集培養后的對照組、阿昔莫司組、氯喹組、阿昔莫司+氯喹組、Compound C組、阿昔莫司+Compound C組細胞,分別加入裂解液充分裂解細胞,使用蛋白提取試劑盒依次提取細胞總蛋白,BCA試劑盒測定各組蛋白濃度,經電泳、轉膜、封閉過程后,依次添加LC3、P62、p-AMPK、AMPK、p-mTOR、mTOR、GAPDH抗體(GAPDH作為內參),4℃孵育過夜后,添加二抗,然后使用ECL發光液顯色,最后采用凝膠成像系統掃描圖像并分析各目的蛋白表達。
2 結果
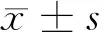
2.1 油紅O染色檢測泡沫細胞模型構建結果 THP-1細胞添加佛波酯誘導后又添加oxLDL培養,與空白組比較,對照組細胞紅色脂滴含量明顯提高(P<0.05),標志著泡沫細胞模型成功構建。見圖1,表1。
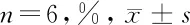
表1 細胞內紅色脂滴含量比較

空白組 對照組
2.2 透射電子顯微鏡觀察細胞內超微結構 oxLDL誘導巨噬細胞后,透射電子顯微鏡觀測細胞內的超微結構。空白組中并未見到自噬體。與空白組比較,對照組細胞內自噬體數量明顯增多(箭頭所示),發現添加oxLDL可增加THP-1細胞自噬。見圖2。
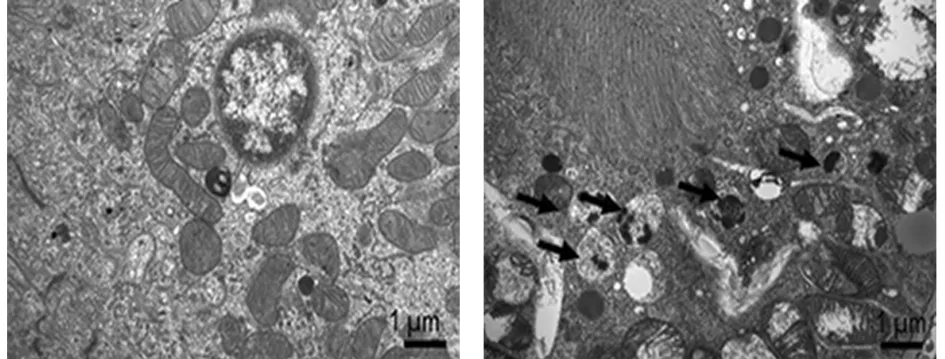
空白組 對照組
2.3 阿昔莫司對oxLDL誘導后細胞中自噬相關蛋白表達的影響 與對照組比較,阿昔莫司組LC3Ⅱ/LC3Ⅰ水平升高(P<0.05),P62水平降低(P<0.05),而氯喹組LC3Ⅱ/LC3Ⅰ水平降低(P<0.05),P62水平升高(P<0.05);與阿昔莫司組比較,阿昔莫司+氯喹組LC3Ⅱ/LC3Ⅰ水平降低(P<0.05),P62水平升高(P<0.05)。見圖3,表2。
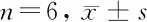
表2 4組細胞中LC3Ⅱ、LC3Ⅰ、P62蛋白表達量比較

圖3 Western Blot檢測細胞中LC3Ⅱ、LC3Ⅰ、P62蛋白水平
2.4 阿昔莫司對oxLDL誘導后細胞中自噬及AMPK/mTOR通路相關蛋白表達的影響 與對照組比較,阿昔莫司組p-AMPK/AMPK和LC3Ⅱ/LC3Ⅰ水平升高(P<0.05),p-mTOR/mTOR和P62水平降低(P<0.05);Compound C組p-AMPK/AMPK和LC3Ⅱ/LC3Ⅰ水平顯著降低(P<0.05),p-mTOR/mTOR和P62水平升高(P<0.05)。與阿昔莫司組比較,阿昔莫司+Compound C組p-AMPK/AMPK和LC3Ⅱ/LC3Ⅰ水平降低(P<0.05),p-mTOR/mTOR和P62水平升高(P<0.05)。見圖4,表3。
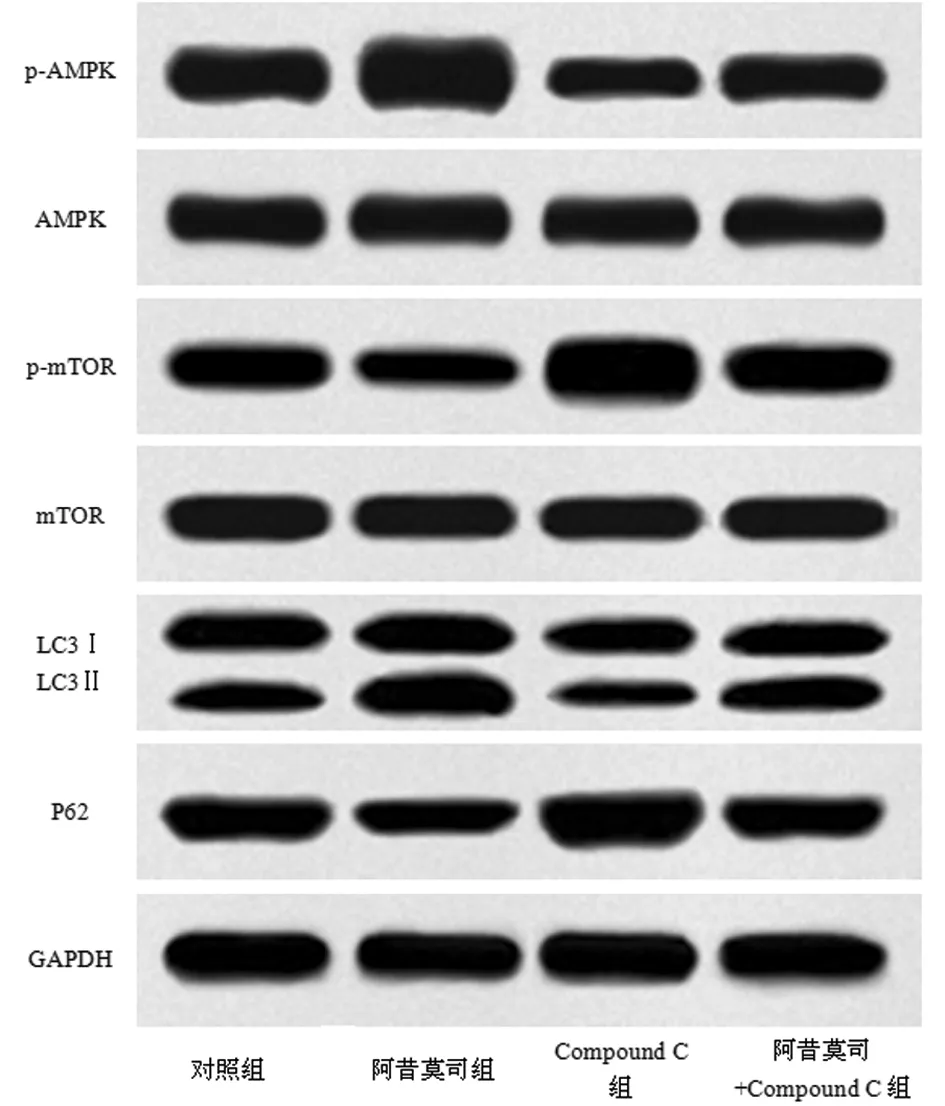
圖4 Western Blot檢測細胞中p-AMPK、AMPK、p-mTOR、mTOR、LC3Ⅱ、LC3Ⅰ、P62水平
表3 4組細胞中p-AMPK、AMPK、p-mTOR、mTOR、LC3Ⅱ、LC3Ⅰ、P62蛋白表達量比較
3 討論
AS屬于血管炎癥疾病的一種,嚴重威脅人類身體健康[9],其特征主要是血管壁中大量積聚脂質、纖維性物質以及礦物質等物質,產生AS損傷有多方面的原因,其中由單核細胞浸潤轉變為的巨噬源性泡沫細胞在此過程中至關重要[10]。大量的脂質沉積引起巨噬細胞中膽固醇脂含量升高,進而形成泡沫細胞,泡沫細胞的形成是AS早期的主要特征之一,參與AS的發生發展過程[11]。有文獻報道,通過使用誘導成為巨噬細胞,進而添加oxLDL誘導48 h形成泡沫細胞,通過油紅O染色發現細胞內有大量的紅色脂滴,則成功構建泡沫細胞模型[2]。本研究結果顯示,對照組細胞內有大量的紅色脂滴,且顯著高于空白組,與之前報道結果相同,驗證了泡沫細胞模型的成功構建。
自噬是機體內一種高度保守的溶酶體降解機制,在維持細胞完整性和能量穩態方面起著至關重要的作用[12],在生物發育及衰老過程中均有可能會發生,是凈化機體自身的一個必要循環機制[13]。在研究自噬機制中廣泛使用的分子標志蛋白有:LC3,Beclin1,P62(SQSTM1),Atg32等多個因子[14],本研究主要選用LC3和P62蛋白。已有研究證明,LC3在形成自噬體膜過程中具有重要作用,主要表現為LC3Ⅱ和LC3Ⅰ兩種相互轉換的形式,檢測LC3Ⅱ/LC3Ⅰ水平可直接反映其自噬水平[15]。P62可以用來作為貨車蛋白,它參與機體多種信號的轉導途徑,且在多種細胞中均能檢測到其表達[16]。P62可以直接與LC3泛素化底物直接作用后進入到自噬體中,進而被其他自噬溶酶體降解,P62蛋白水平在一定意義上可反映出自噬的能力變化[17]。已有研究證實,阿昔莫司可以有效地改善高脂飲食大鼠所引起的血脂水平提高[8]。且阿昔莫司能夠通過激活LXRα通路,誘導ABCA1表達,進而抑制其形成泡沫細胞達到延緩AS發生發展的目的[18]。本研究發現,與對照組比較,阿昔莫司組LC3Ⅱ/LC3Ⅰ表達明顯提高,P62表達顯著降低,而氯喹組LC3Ⅱ/LC3Ⅰ表達降低,P62水平升高;與氯喹組比較,阿昔莫司+氯喹組LC3Ⅱ/LC3Ⅰ水平升高,P62水平降低。此結果表明了阿昔莫司可抑制形成泡沫細胞且可以在一定程度上削弱氯喹對細胞自噬的抑制作用。
本研究為了更深入的探討阿昔莫司與細胞自噬的作用機制,進一步探究了AMPK/mTOR通路對此過程的作用。已有多篇研究報道AMPK/mTOR通路可參與多種疾病過程,也可參與細胞自噬過程[19]。有研究證明,在培養人肺癌細胞A549細胞中,外源添加槲皮素和AMPK抑制劑Compound C后,可降低p-AMPK蛋白水平,升高p-mTOR蛋白水平,且A549細胞自噬泡明顯減少,進而得出槲皮素可能通過激活AMPK/mTOR信號通路誘導A549細胞發生自噬過程[20]。本研究證明了阿昔莫司可以激活AMPK/mTOR通路,可通過此通路在一定程度上增強泡沫細胞的自噬作用。
綜上所述,阿昔莫司可通過調控AMPK/mTOR通路促進oxLDL誘導的泡沫細胞自噬作用。本研究為阿昔莫司在治療AS機制中提供了新的見解,且對AMPK/mTOR通路研究開辟了新的研究方向。但本研究并未深入探究是否還有其他的通路蛋白參與調控細胞自噬,有待后續更加完善的研究。

