4-辛基衣康酸抑制糖酵解調(diào)控M2型巨噬細胞極化*
陳成英,藍 利,2,袁江浪,孔星星,王新航,2,劉彧冰,李 菡,陸彩玲,李習藝,唐 深,2△
(廣西醫(yī)科大學 1.基礎(chǔ)醫(yī)學院;2.廣西高校基礎(chǔ)醫(yī)學研究重點實驗室;3.公共衛(wèi)生學院,南寧 530021)
巨噬細胞(Mφ)是固有免疫的重要細胞,主要分為促炎的M1 型Mφ 和抑炎的M2 型Mφ,在不同炎癥微環(huán)境刺激下會迅速做出反應,發(fā)揮促炎或抑炎功能,調(diào)控炎癥以限制損害和保護人體[1-2]。當暴露于促進Mφ 可塑性和重編程的細胞因子環(huán)境時,M1 和M2 型Mφ 可發(fā)生可逆的功能變化,在調(diào)節(jié)炎癥發(fā)生及消退過程中發(fā)揮著重要作用[3]。
衣康酸(itaconate,ITA)是M1 型Mφ 中最豐富的代謝產(chǎn)物之一,可以通過激活核因子相關(guān)因子2(nuclear factor E2-related factor 2,Nrf2)途徑抑制炎癥[4]。4-辛基衣康酸(4-Octyl itaconate,4OI)是一種可透過細胞膜的ITA 衍生物,在活化的Mφ 中被代謝為ITA,具有抗炎作用[5]。研究報道,4OI 可降低LPS 誘導的肺部炎癥[6]。4OI 可抑制M1 型Mφ 和促炎因子的產(chǎn)生,抑制炎癥反應[5]。研究提示,4OI 發(fā)揮抗炎作用的機制可能是通過調(diào)節(jié)M1 型Mφ 的炎癥極化。目前4OI對M2的作用機制未見詳盡報道,本項目以人髓系白血病單核細胞(THP-1)誘導M2型Mφ 為研究對象,初步研究ITA 衍生物4OI 對M2型Mφ 的影響和作用機制,為ITA 衍生物治療炎癥提供新的科學依據(jù)。
1 材料和方法
1.1 材料
THP-1 細胞(中國科學院典型培養(yǎng)物保藏委員會細胞庫)。佛波酯(phorbol myristate acetate,PMA)、TRIzol、刃天青(Sigma公司);白介素(IL)-4(PeproTech 公 司);4OI(MedChemExpress);RPMI1640 培養(yǎng)液、胎牛血清(Gibco 公司);青霉素、鏈霉素、己糖激酶(Hexokinase,HK)、丙酮酸激酶(Pyruvate kinase,PK)檢測試劑盒(索萊寶生物科技公司)。蛋白定量和RNA提取試劑盒(TaKaRa公司);SYBR?Green Master(Roche公司);引物由Invitrogen 公司合成;Leica 倒置顯微系統(tǒng)、StepOne 熒光定量PCR儀、Multiskan Go全波長酶標儀。
1.2 方法
1.2.1 細胞培養(yǎng)及實驗分組
按細胞密度8.5×105個/孔接種于6 孔板,將Mφ分為M0 組、M2 組、M2+4OI-L 組和M2+4OI-H 組。M0組用含100 nmol/L PMA培養(yǎng)基刺激48 h,M2 組在M0 組基礎(chǔ)上用含20ng/mL IL-4 培養(yǎng)基再誘導48 h,M2+4OI-L 組和M2+4OI-H 組在M2 組基礎(chǔ)上分別用100 μmol/L和200 μmol/L4OI再干預12 h。
1.2.2 細胞形態(tài)觀察和分析
倒置顯微鏡觀察并記錄各實驗組實驗過程和終點的細胞形態(tài)。攝取各實驗組實驗終點細胞圖片,5張/組以上。通過Image J軟件連續(xù)計數(shù)各組觀察視野中1 000個Mφ,并計算偽足伸出細胞和梭形細胞的細胞數(shù)占總細胞數(shù)的百分比。
1.2.3 實時熒光定量PCR(real time quantitative PCR,RT-qPCR)法檢測M2 型Mφ 極化相關(guān)標志物和堿棕櫚酰基轉(zhuǎn)移酶-1α(carnitine palmitoyltransferase 1α,CPT-1α)的mRNA表達水平
到達實驗終點后,去除培養(yǎng)基上清,無菌PBS洗1 次,每孔加入1 mL TRIzol,提取總mRNA 后逆轉(zhuǎn)錄為cDNA。RT-qPCR 反應體系:cDNA 0.4 μL,SYBR green mix 10 μL,RT-qPCR 正反向引物各1 μL,無酶水7.6 μL。反應條件:95 ℃預變性1 min,(95 ℃變性30 s,60 ℃退火20 s)×45 個循環(huán)。RTqPCR 引物:以β-actin為內(nèi)參,采用2-△△CT法計算目的基因的相對表達量。引物序列見表1。

表1 引物序列/(5’~3’)
1.2.4 微量法檢測HK和PK活性
棄去培養(yǎng)基后用PBS 洗3 次,每孔加入200 μL HK 或PK 提取液,將細胞刮下并收集于1.5 mL EP管內(nèi),在冰浴條件下超聲裂解細胞,4 ℃離心10 min,取上清液。按照試劑說明書使用全波長酶標儀檢測各實驗組吸光度值,按照說明書公式計算HK 和PK活性。
1.2.5 刃天青法檢測線粒體呼吸鏈代謝酶活性
THP-1細胞按1.8×104個/孔細胞數(shù)接種于96孔板,按照上述分組處理完成后,每組5 個復孔,每孔加入100 μL 0.02%的刃天青溶液,并設(shè)置背景對照組,37 ℃、5%CO2培養(yǎng)箱中孵育3.5 h,在激發(fā)光波長530 nm,發(fā)射光波長590 nm 處,全波長酶標儀讀取各組熒光信號強度,熒光強度線粒體呼吸鏈代謝酶活性=各組熒光信號強度-背景對照組熒光信號強度。
1.3 統(tǒng)計學方法
采用SPSS 20.0 統(tǒng)計軟件分析數(shù)據(jù),計量資料以均數(shù)±標準差(±s)表示,多組間比較采用方差分析,組間兩兩比較采用LSD-t法;計數(shù)資料以頻數(shù)或百分率(%)表示,率的比較采用卡方檢驗,以P<0.05為差異有統(tǒng)計學意義。
2 結(jié)果
2.1 4OI干預對M2形態(tài)的影響
THP-1 細胞經(jīng)PMA 誘導活化為M0 型,細胞呈灰色煎蛋樣或不規(guī)則型;M0 型經(jīng)IL-4 誘導極化為M2型,細胞偽足形成和梭形樣改變;各組偽足伸出細胞和梭形細胞占比分別為M0 組8.0%、M2 組78.1%、M2+4OI-L 組68.5%和M2+4OI-H 組52.3%,與M2組相比,4OI干預后的偽足伸出細胞和梭形細胞占比減少,且M2+4OI-H 組更明顯(P<0.01),見圖1。
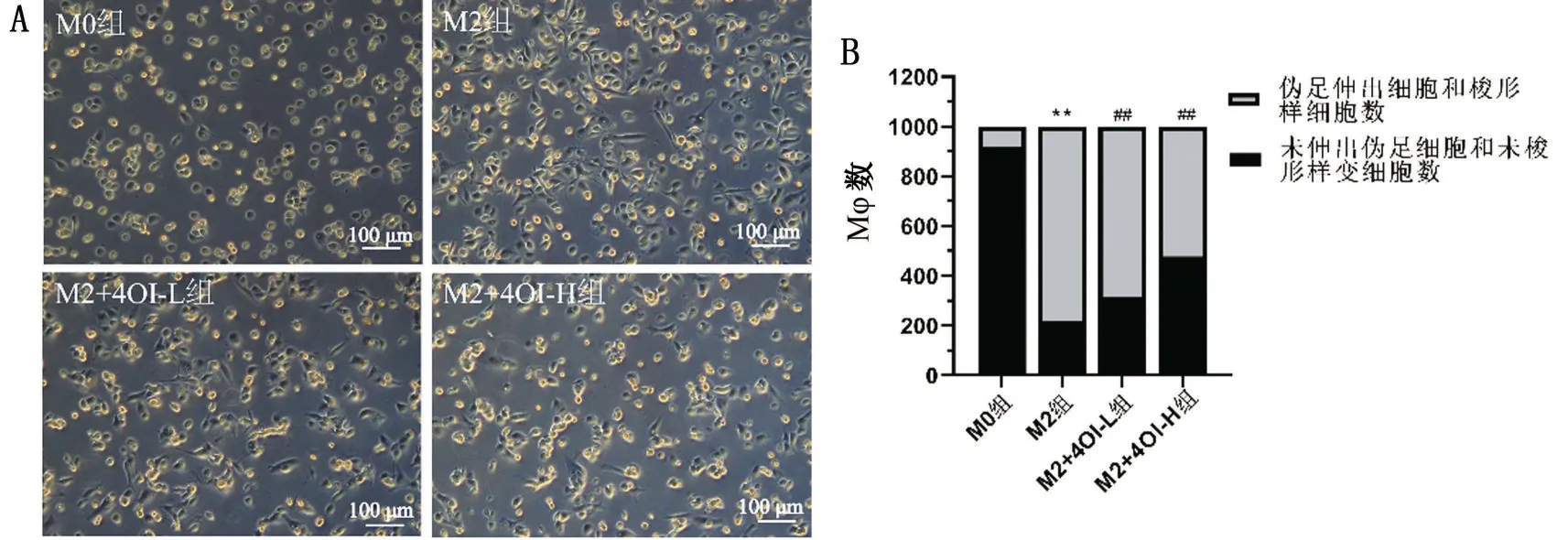
圖1 Mφ極化形態(tài)學變化
2.2 4OI對M2極化相關(guān)基因表達的影響
與M0 組相比,M2 組M2 極化標志物IL-10,MRC-1,CCL22,CD209,SOCS1 和PPAR-γmRNA水平均升高(均P<0.01);與M2組相比,M2+4OI組M2 極化標志物IL-10,MRC-1,CCL22,CD209,SOCS1和PPAR-γmRNA 水平降低,且M2+4OI-H組較M2+4OI-L組干預作用更強(均P<0.05),結(jié)果提示4OI干預降抑制M2極化標志物表達,抑制作用隨劑量增加而增強,見圖2。據(jù)此,本文選擇200 μmol/L 4OI開展后續(xù)實驗研究。
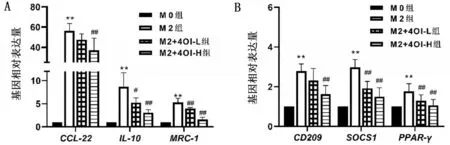
圖2 M2極化相關(guān)基因mRNA表達水平比較
2.3 4OI干預對M2糖酵解限速酶活性的影響
與M0 組相比,M2 組HK 和PK 酶活性均升高(P<0.05);與M2組相比,M2+4OI-H組HK和PK酶活性均降低(P<0.05)。結(jié)果顯示,M2 極化后糖酵解水平增加,4OI干預后降低M2糖酵解水平,見圖3。
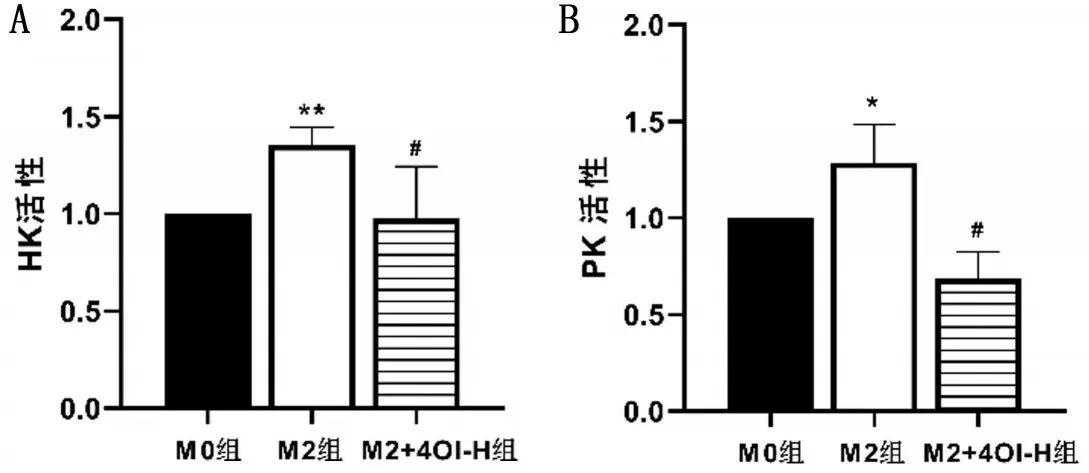
圖3 糖酵解相關(guān)酶活性比較
2.4 4OI干預對M2脂肪酸氧化限速酶基因表達的影響
與M0 組相比,M2 組CPT-1αmRNA 水平升高(P<0.01);與M2 組相比,M2+4OI-H 組CPT-1αmRNA 水平進一步升高(P<0.01)。結(jié)果顯示,M2極化后CPT-1αmRNA表達水平增加,4OI干預后可進一步提高M2CPT-1αmRNA表達水平,見圖4。
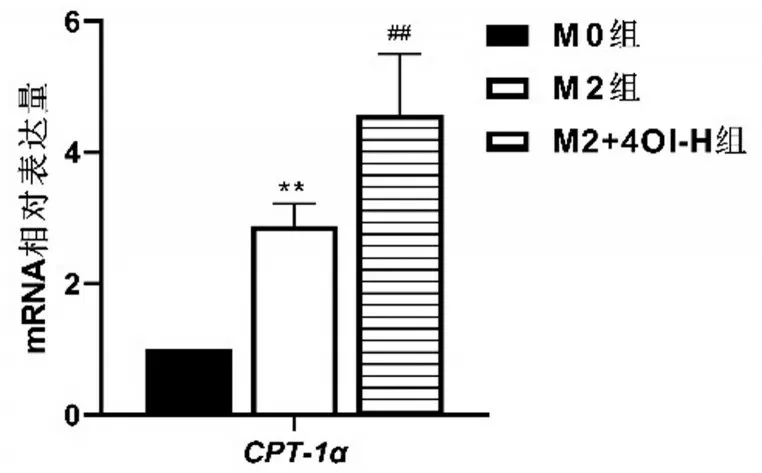
圖4 CPT-1α mRNA表達水平比較
2.5 4OI干預對M2線粒體呼吸鏈代謝酶活性的影響
與M0組相比,M2組線粒體呼吸鏈相關(guān)酶活性水平升高(P<0.05);與M2組相比,M2+4OI-H組中線粒體呼吸鏈相關(guān)酶活性水平無明顯變化(P>0.05)。結(jié)果顯示,M2 極化后線粒體呼吸鏈代謝酶活性增加,4OI干預后不影響M2線粒體呼吸鏈代謝酶活性,見圖5。
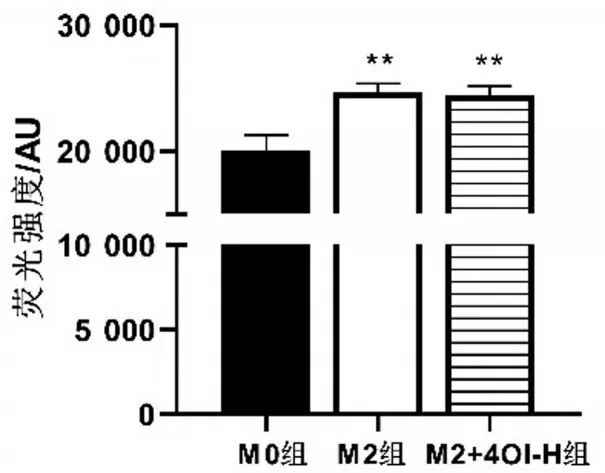
圖5 線粒體呼吸鏈代謝酶活性水平比較
3 討論
Mφ 在炎癥微環(huán)境中可極化為M1 和M2 型。M1 通過釋放IL-1β、IL-6 等介導炎癥反應;M2 通過分泌IL-10、CCL22等介導抗炎和組織修復[7]。在本研究中,與M0 組相比,M2 組細胞偽足形成和呈梭形樣改變,同時M2 極化標志物mRNA 表達量上升。4OI 作為ITA 衍生物在活化的Mφ 內(nèi)可轉(zhuǎn)化為ITA,通過親電應激反應激活Nrf2,發(fā)揮抗炎和抗氧化作用[8]。文獻報道,肝癌細胞HepG2 來源的乳酸可激活Nrf2 使Mφ 向M2 樣表型傾斜[9]。在小鼠急性肝損傷模型中,4OI 飼喂抑制Mφ 從而減輕肝損傷[10]。Katharina 等[11]用4OI 處理THP-1 誘導的M2型Mφ 24 h,發(fā)現(xiàn)促炎因子TNF-α和M2抑炎極化標志物PPAR-γ和IL-10表達均下降,但IL-1β表達增加,這與本研究結(jié)果類似。本研究結(jié)果顯示,4OI可降低M2 型極化標志物mRNA 水平。Runtsch 等[12]認為4OI是通過降低“M1-M2”譜中的所有Mφ功能來發(fā)揮抗炎作用,4OI預處理BMDM后誘導為M2,4OI 可抑制JAK1/STAT6 通路降低M2 的極化水平。
免疫代謝重編程在M1 和M2 極化中有關(guān)鍵的調(diào)節(jié)作用[13]。M1 的能量供應特征是增加有氧糖酵解;M2 的能量供應特點是增加葡萄糖攝取和脂肪酸氧化水平,具備完整的三羧酸循環(huán)維持的高水平氧化磷酸化[14]。IL-4 刺激小鼠Mφ 極化為M2 過程中糖酵解水平上升,參與M2 型的極化供能[15]。本研究結(jié)果顯示,M0極化為M2后,糖酵解限速酶HK和PK 活性增加,脂肪酸氧化限速酶CPT-1αmRNA水平增加,線粒體呼吸鏈酶活性增加,提示M2極化過程中糖酵解和脂肪酸氧化共同參與供能。文獻報道,4OI抑制LPS誘導的小鼠骨髓來源Mφ活化,并抑制細胞糖酵解[4]。Nrf2敲除的小鼠中長鏈脂肪酸和短鏈脂肪酸的脂肪酸氧化水平受到抑制[16]。在本研究中,4OI 抑制M2糖酵解水平,并進一步增加脂肪酸氧化水平和維持線粒體呼吸代謝酶活性水平,這提示細胞的氧化磷酸化水平被維持穩(wěn)定水平。LPS 構(gòu)建的膿毒性心臟病模型中,松果堿通過上調(diào)心肌細胞Nrf2 水平促進脂肪酸氧化水平和三羧酸周期從而保護氧化磷酸化水平穩(wěn)定[17]。結(jié)合本研究結(jié)果,4OI作為Nrf2的激活劑,其可能通過抑制糖酵解水平和促進脂肪酸氧化,以維持線粒體呼吸代謝酶活性水平和氧化磷酸化水平穩(wěn)定,繼而保持M2能量代謝特征和極化穩(wěn)定,避免M2過度極化導致功能失調(diào)。
綜上所述,4OI抑制M2糖酵解引起細胞內(nèi)糖代謝發(fā)生重編程,降低IL-4 誘導的M2 極化標志物表達;伴隨進一步提高脂肪酸氧化水平,這可能作為能量補充以抵消糖酵解受抑制導致的能量缺失,從而維持線粒體呼吸鏈代謝酶活性和氧化磷酸化水平的穩(wěn)定,保持M2 極化代謝特征狀態(tài),避免M2 的過度極化。這可能是4OI作為免疫訓練調(diào)節(jié)劑介導抗炎作用的新機制,本研究為ITA 及其衍生物治療Mφ相關(guān)炎癥性疾病提供新的科學依據(jù)。

