甜瓜鏈格孢菌的鑒定及其CAZymes 活性研究
蔣莉瑩,曾禹睿慷,白羽嘉,*,馮作山,楊 杉,楊 旭
(1.新疆農業大學食品科學與藥學學院,新疆 烏魯木齊 830052;2.新疆果品采后科學與技術重點實驗室,新疆 烏魯木齊 830052)
新疆擁有著得天獨厚的地理優勢,夏季最長光照時長達16 h/d,光熱資源充足,晝夜溫差大,降雨少,極為適合甜瓜的種植,是厚皮甜瓜次生起源中心之一。甜瓜每年的采收期集中在7—8 月,正值夏季炎熱高溫季節,采后果實迅速后熟衰老、抗病性降低,極易遭受病原菌侵染[1-2]。甜瓜采后微生物侵染引起的病害主要有黑斑病、白霉病、軟腐病等[3]。由鏈格孢菌(Alternaria alternata)引起的黑斑病是甜瓜貯藏期危害性最大、發病率最高的病害[4-5]。甜瓜作為新疆農作物生產量最大的水果之一,只有從根源上找到其受侵染原因,才能從根本上解決其生長及貯藏期間產生黑斑病的問題。
鏈格孢菌(Alternaria alternata)屬真菌,是造成果蔬黑斑病的重要致病菌,可侵染杏[6]、梨[7]、伽師瓜[8]、蘋果[9]等水果。鏈格孢菌菌落為絮狀,生長迅速,初期呈白色,老后變暗,侵染水果后,在水果表面形成黑色或深褐色病斑,即黑斑病。致病菌侵染果實所需要突破的第一道防線就是果實的細胞壁,而纖維素和果膠等多糖類物質是植物細胞壁的重要組成成分。因此研究病原菌入侵甜瓜的第一道防線,就是要研究病原菌自身所攜帶的碳水化合物酶(CAZymes)活性[10]。
目前,就甜瓜遭受病原菌侵染方面的研究大多以甜瓜為主體,研究其發病后內部組織結構變化、酶活特性及基因表達規律[11],但以鏈格孢菌為主體,其生長特性及其致病酶活性的研究相對較少。本研究從導致甜瓜發病的病原菌本身鏈格孢為出發點,以甜瓜鏈格孢菌為主體,研究其在侵染甜瓜過程中的生長規律,及其產生的致病相關酶(多聚半乳糖醛酸酶(PG)、果膠甲酯酶(PME)、纖維素酶(Cx)、β-葡萄糖苷酶(β-Glu))的活性表達,從根本出發,探索鏈格孢是如何侵入甜瓜組織內部并分析原因,以期為針對性預防黑斑病的發生提供鏈格孢菌自身酶活特性的理論依據。
1 材料與方法
1.1 材料與設備
1.1.1 材料與試劑
新疆喀什市伽師縣伽師瓜全生育期112 d,采摘后,經過2%過氧化氫浸泡,于4 ℃貯藏,等待其自然發病備用。
菌株A2015:分離自新疆喀什市伽師縣八鄉患病伽師瓜;菌株A2018:分離自新疆喀什市伽師縣十鄉患病伽師瓜;菌株A2019:分離自新疆喀什市伽師縣九鄉患病伽師瓜;菌株3.18017:購自中國微生物菌種保藏管理委員會普通微生物中心(CGMCC)梨黑斑鏈格孢(Alternaria gaisen)。
過氧化氫、冰乙酸、無水醋酸鈉、氯化鈉、多聚半乳糖醛酸、酒石酸鉀鈉、3,5-二硝基水楊酸、葡萄糖、結晶酚、氫氧化鈉、亞硫酸鈉、無水乙醇、檸檬酸、檸檬酸鈉、羧甲基纖維素鈉、水楊苷,以上均為分析純(AR),購自天津市致遠化學試劑有限公司。
馬鈴薯葡萄糖瓊脂(PDA)、孟加拉紅瓊脂,購自海博生物技術有限公司。
1.1.2 儀器與設備
JH-SCA 型凈化工作臺,上海鴻都電子科技有限公司;LDZX-50KBS 立式壓力蒸汽滅菌器,上海申安醫療器械廠;DZKW-S-4 型電熱恒溫培養箱,北京市永光明醫療儀器廠;TGL-16gR 型冷凍離心機,上海安亭科學儀器廠;TU-1810 系列PC 紫外-可見分光光度計,北京普析通用儀器有限責任公司;DZKW-S-4型電熱恒溫水浴鍋,北京市永光明醫療儀器廠。
1.2 方法
1.2.1 分離
取發病甜瓜,用2%過氧化氫擦拭表面,取甜瓜果實病健交界處組織于PDA 固體培養基平板上,于28 ℃培養3 d。
1.2.2 純化
取分離菌邊緣菌塊,分別3 點轉接至孟加拉紅培養基平板上,于28 ℃培養3 d,再取菌落邊緣菌塊,3點轉接至PDA 培養基平板上,于28 ℃培養7 d。
1.2.3 生長曲線的繪制
采用菌斑直徑測量法(十字交叉法)繪制生長曲線。用直徑為0.86 cm 的打孔器取一點轉接于PDA培養基平板上,28 ℃培養,分別于0、1、2、3、4、5、6、7 d測量菌斑直徑,重復3 組,繪制生長曲線。
1.2.4 形態學鑒定
菌落形態觀察:將供試菌株接種于PDA 培養基上,3~5 d 后用直徑為0.86 cm 的無菌打孔器切取菌落邊緣菌絲團塊,轉接于PDA 培養皿中,于28 ℃恒溫培養7 d 后,測量菌落直徑大小,拍照并記錄菌落顏色及形態[12]。
孢子形態觀察:挑取在PDA 培養基上生長3~5 d的供試菌株菌絲制成玻片,顯微鏡下觀察菌體形態,拍照并記錄其分生孢子形態、色澤等[13]。
1.2.5 酶液的提取
參照曹建康等[14]的方法并稍作修改。準確稱取0.20 g 菌體,置于預冷的研缽中,加入2 mL 預冷的醋酸鈉緩沖液,在冰浴條件下研磨勻漿后,低溫放置20 min,12 000 r/min 離心20 min,取上清液,即為酶液,于4 ℃保存備用。
1.2.6 CAZymes 活性的測定
多聚半乳糖醛酸酶、纖維素酶及β-葡萄糖苷酶活性:均參照曹建康等[14]的方法測定;果膠甲酯酶活性:參照Li 等[15]的方法測定。在整個菌體培養過程中,由于菌體生長速度慢,且菌體質量輕,在其培養1~2 d 時,菌體質量過于微小,不足以取樣以測定酶活,因此取樣時間為3~9 d,故酶活測定時間為3~9 d。
1.2.7 數據處理
采用Origin2019 進行圖表繪制,IBMSPSSStatistics 20 進行顯著性分析。
2 結果與分析
2.1 形態學鑒定
根據《中國真菌志》第十六卷[16]鏈格孢屬的相關描述,A2015、A2018、A2019 三個菌株被鑒定為鏈格孢屬(Alternaria Nees)。它們在PDA 培養基上的菌絲都較為松散,初生菌絲白色,菌落呈灰綠色、灰白色或黃褐色至褐色;分生孢子梗單枝或叢生;分生孢子呈倒棍棒形,黃褐色至褐色,孢身(17.5~40.0)μm×(7.5~15.0)μm,喙呈柱狀或錐狀,(6~20)μm×(2.5~5)μm,具橫隔2~6 個,縱(斜)隔0~5 個。菌株3.18017 為梨鏈格孢(Alternaria gaisen),菌株A2015、A2018 從菌落形態上觀察明顯區別于A2019 和3.18017(圖1),菌株A2015 呈黃褐色,A2018 呈深褐色,而A2019 呈灰白色,3.18017 呈灰綠色。
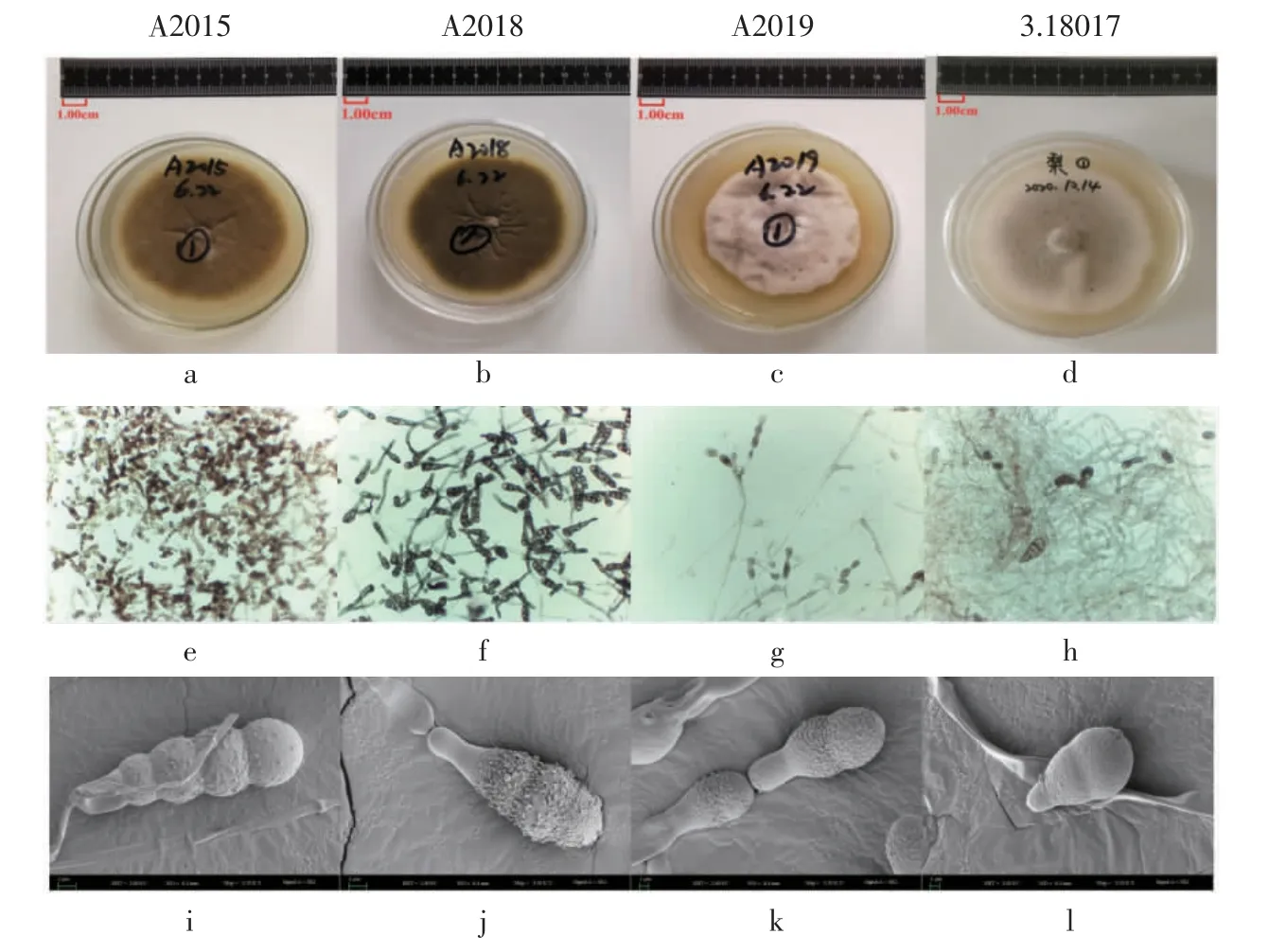
圖1 菌株A2015、A2018、A2019、3.18017 的孢子及菌落形態Fig.1 Spore and colony morphology of strains A2015,A2018,A2019 and 3.18017
2.2 不同鏈格孢菌的生長曲線
圖2 為4 株鏈格孢菌的生長曲線。由圖2 可見,菌落直徑呈逐漸增大的變化趨勢,培養4 d 時,生長趨勢開始出現明顯的差異,對比其他3 種菌株,A2019 的生長趨勢低于其他菌株;于28 ℃培養7 d,菌株A2015、A2018、A2019 和3.18017 菌落直徑分別為7.77、7.55、6.66、7.36 cm。說明鏈格孢菌A2015、A2018、A2019 和3.18017 在生長趨勢上存在一定的差異。

圖2 鏈格孢菌生長曲線Fig.2 Growth curve of Alternaria
2.3 不同鏈格孢菌多聚半乳糖醛酸酶活性比較
由圖3 可見,菌株A2015、A2018、A2019 和3.18017在培養期間PG 活性總體呈降低的變化趨勢,鏈格孢自身能夠產生大量PG,對甜瓜進行初步侵染后,開始降解細胞壁中果膠成分,而后引起甜瓜自身細胞壁代謝的加速,導致甜瓜自身PG 活性不斷增加[17]。菌株A2015、A2018、A2019 和3.18017 培養3 d時,PG 活性分別為20 924.25、17 439.85、14 119.82、19 342.79 μg·h-1·g-1FW,且差異具有顯著性(P<0.05);培養5~6 d 時,菌株A2015 和A2018 的PG 活性以相同的趨勢急速下降,菌株A2019 和3.18017 則呈緩慢下降的趨勢;培養6~9 d 時4 種菌株的PG 活性變化趨于平緩,培養6 d 時,菌株A2015、A2018、A2019和3.18017 酶活性分別為3 689.82、2081.36、8006.12、11 515.09 μg·h-1·g-1FW,且具有顯著性差異(P<0.05)。

圖3 不同鏈格孢菌多聚半乳糖醛酸酶活性變化Fig.3 Changes of polygalacturonase activity of different Alternaria
2.4 不同鏈格孢菌果膠甲酯酶活性比較
由圖4 可見,在培養期間,菌株A2015、A2018、A2019 和3.18017 的PME 活性均呈先上升后下降的趨勢,并且在培養第7 天時達到峰值,分別為0.23、0.24、0.20、0.21 μg·h-1·g-1FW,其中菌株A2018 的PME 活性最高,為0.24 μg·h-1·g-1FW,此時菌株A2015 和A2018 的PME 活性在峰值時明顯高于菌株A2019 和3.18017。培養7~9 d,4 種菌株PME 活性均呈現急速下降的趨勢,且菌株A2015 和A2018 的下降趨勢明顯大于菌株A2019 和3.18017。與朱婉彤等[18]的研究結果相似,甜瓜在采后自身的細胞壁代謝加快,導致PME 活性逐漸升高,而鏈格孢菌的侵染則加速了這一進程,使細胞壁迅速被降解,為鏈格孢在甜瓜組織內部侵染創造有利條件。

圖4 不同鏈格孢菌果膠甲酯酶活性變化Fig.4 Changes of pectin methylesterase(PME)activity of different Alternaria
2.5 不同鏈格孢菌纖維素酶活性比較
纖維素是甜瓜果皮含量最高的組成成分,也是甜瓜抵抗外來微生物侵染最有效的組織成分,因此鏈格孢本身會產生大量纖維素酶來突破防線。由圖5 可見,菌株A2015、A2018、A2019、3.18017 在培養期間Cx 活性總體呈先升高后降低的變化趨勢,菌株A2015、A2019、3.18017 的Cx 活性在6 d 時出現峰值,分別為222.71、250.20、227.71 μg·h-1·g-1FW,三者間具有顯著性差異(P<0.05);A2018 的Cx 活性在8 d 時出現峰值,為192.72 μg·h-1·g-1FW。

圖5 不同鏈格孢菌纖維素酶活性變化Fig.5 Changes of cellulase(Cx)activity of different Alternaria
2.6 不同鏈格孢菌β-葡萄糖苷酶活性比較
由圖6 可以看出,菌株A2015、A2018、A2019、3.18017 在培養期間β-Glu 活性總體呈先升高后降低的變化趨勢,隨著培養時間的不斷延長,β-Glu活性不斷升高,在第6 天時達到酶活峰值,分別為2 121.13、2 408.54、8 619.21、4 670.38 μg·h-1·g-1FW,隨后活性降低,菌株A2019 的β-Glu 活性在第6 天時明顯高于其他3 種菌株,是菌株A2015 的4.06 倍,菌株A2018 的3.58 倍,菌株3.18017 的1.85 倍,呈現顯著性差異(P<0.05)。而菌株A2015 和A2018 較A2019 和3.18017 而言上升和下降的趨勢較為平緩。

圖6 不同鏈格孢菌β-葡萄糖苷酶活性變化Fig.6 Changes of β-glucosidase(β-Glu)activity of different Alternaria
3 結論與討論
上述試驗結果表明,經形態學鑒定,由甜瓜黑斑病病斑中分離出的3 個菌株A2015、A2018、A2019 均為鏈格孢屬真菌。雖然分離出的3 個菌株和3.18017均為鏈格孢屬真菌,但其在生長特性上存在著顯著差異。首先從菌落顏色上看,A2015 和A2018 均呈現褐色,而A2019 呈現出灰白色,3.18017 則為灰綠色;再從生長曲線上看,各菌株生長至第4 天時出現明顯差異。由此可見,不同產區被侵染的甜瓜病斑中分離出的病原菌有所不同,這也有可能導致了在甜瓜采摘后,防治此類病原菌入侵過程中的針對性有所差異。
植物細胞的細胞壁是病原菌進入寄主細胞需要克服的第一道結構[19],因此,鏈格孢菌在侵染甜瓜的過程中首先會產生降解細胞壁主要成分物質的酶。本試驗通過對鏈格孢菌自身所攜帶的此類酶活性的測定來確定鏈格孢菌在侵染過程中細胞壁降解酶活力大小,從而進一步分析出在鏈格孢菌侵染甜瓜過程中是如何穿過防線侵染瓜體。研究結果表明,鏈格孢菌在生長過程中,首先產生最多的為多聚半乳糖醛酸酶,以此來分解甜瓜果皮中的多聚半乳糖醛酸,其次纖維素酶和β-葡萄糖苷酶在第6 天時活性達到最高,果膠甲酯酶的含量在第7 天時達到最高,說明鏈格孢菌在侵染甜瓜時是由此順序,互相協調作用于甜瓜,逐步入侵甜瓜內部,導致甜瓜產生黑斑病。此研究結果可為后期針對性防治黑斑病以及甜瓜抵御鏈格孢的入侵提供病原菌自身特性的理論基礎。

