肝細胞癌患者根治術前后PIVKA-Ⅱ、AFP變化及其臨床意義
楊榮蓉 蔡慧敏 吳玉玲 韓正祥 馮守信
肝細胞癌(hepatocellular carcinoma,HCC)發生率和病死率居惡性腫瘤前列,預后較差[1]。根治性切除術是HCC有效的治療方法,可以顯著延長患者的生存期,但部分患者術后2年內即出現復發,5年復發率超過50%。因此,尋找和分析與腫瘤復發相關的指標,以改善患者的預后具有重要意義[2~5]。血清異常凝血酶原(protein induced by vitamin K absence or antagonist-Ⅱ,PIVKA-Ⅱ)為凝血酶原的異常形式,其所有谷氨酸殘基在未γ-羧化的情況下被釋放到血漿中[6]。甲胎蛋白(alpha-fetoprotein,AFP)是使用最廣泛的HCC生物學標志物,有研究表明,AFP聯合PIVKA-Ⅱ可提高診斷HCC的敏感度及特異性,且二者水平與腫瘤分化和直徑密切相關,高表達甚至可提示血管侵犯[7]。近年來,研究表明比起靜態指標,PIVKA-Ⅱ、AFP的動態變化似乎更能反映HCC的預后,且監測指標變化可以反映非手術治療患者的療效及預后[8~13]。一項法國人群的研究表明,HCC患者治療前后PIVKA-Ⅱ比值能夠較好反映患者生存情況,但在根治術患者中尚未得到充分研究[14]。本研究通過影像學檢查對腫瘤復發進行監測,并收集患者手術前后PIVKA-Ⅱ、AFP水平,以評價其對根治術患者的臨床價值。
對象與方法
1.研究對象:選取2016年1月~2019年5月筆者醫院收治的首次行根治術的HCC患者154例。納入標準:①病理學證實為HCC;②未接受其他治療;③腫瘤未侵犯血管、膽管和鄰近器官,未出現肝內及遠處轉移;④肝功能Child-Pugh分級A級或B級,美國東部腫瘤協作組(Eastern Cooperative Oncology group,ECOG)評分0~2分。排除標準:①彌漫性HCC;②合并其他腫瘤;③嚴重凝血功能障礙;④維生素K缺乏或服用維生素K拮抗劑(如華法林)者。
2.手術方法:分為腹腔鏡和開腹手術,于距離腫瘤邊緣約2cm處切割,完整切除腫瘤及其周圍2cm范圍無瘤組織,術后行病理學檢查。
3.數據收集:收集患者性別、年齡、體重指數(body mass index,BMI)、肝硬化程度、Child-Pugh分級、手術方式、TNM分期、BCLC(the British Columbia Lottery Corporation)分期、病理信息等,收集患者術前1周內及術后1月左右PIVKA-Ⅱ及AFP外周血檢測結果,并計算比值(比值=術后/術前)。
4.術后隨訪:通過門診復查及電話形式進行隨訪,以影像學檢查出現新的病灶定義為復發,隨訪截至2021年5月,每位患者至少隨訪2年,無復發生存期(recurrence free survival,RFS)為手術當日至首次發現腫瘤復發[15]。
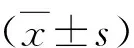
結 果
1.一般資料:共納入154例患者,復發組79例,未復發組75例,兩組患者Child-Pugh 分級、TNM分期、腫瘤直徑、腫瘤數量、分化程度、BCLC分期比較,差異均有統計學意義(P<0.05),兩組在其他指標之間比較,差異無統計學意義(P>0.05,表1)。

表1 復發組與未復發組患者基線資料比較[n(%),M(Q1,Q3)]
2.血清PIVKA-Ⅱ及AFP水平分析:(1)復發組、未復發組患者PIVKA-Ⅱ及AFP水平比較:復發組與未復發組比較,術前PIVKA-Ⅱ、AFP,術后PIVKA-Ⅱ、AFP,PIVKA-Ⅱ、AFP比值比較,差異均有統計學意義(P<0.05,表2)。(2)根治術前后PIVKA-Ⅱ及AFP水平比較:兩組患者術后1月PIVKA-Ⅱ及AFP明顯下降,與術前比較,差異均有統計學意義(P<0.001,圖1)。

表2 復發組與未復發組PIVKA-Ⅱ及AFP水平比較[M(Q1,Q3)]

圖1 患者根治術前后PIVKA-Ⅱ、AFP水平比較A.PIVKA-Ⅱ水平比較;B.AFP水平比較
3.PIVKA-Ⅱ比值及AFP比值預測腫瘤復發:154例患者中,PIVKA-Ⅱ比值診斷復發組的ROC曲線下面積(area under curve,AUC)為0.807 (P<0.001),AFP比值為 0.747(P<0.001),二者聯合為 0.845(P<0.001),當約登指數最大時,PIVKA-Ⅱ比值預測復發的最佳截斷值為0.68,AFP比值為0.53,PIVKA-Ⅱ比值+AFP比值為0.55(圖2)。

圖2 診斷術后腫瘤復發的ROC曲線分析
4.高、低值組復發率及RFS對比:根據最佳截斷值分為高值組及低值組,以Kaplan-Meier法分別繪制高、低值組生存曲線,并比較復發率,結果顯示,低比值復發率更低,RFS更長(P<0.001,表3、圖3)。

表3 高值組與低值組復發率及RFS對比[n(%),M(Q1,Q3)]

圖3 高、低值組無復發生存率的Kaplan-Meier曲線分析A.PIVKA-Ⅱ比值;B.AFP比值;C.PIVKA-Ⅱ比值+AFP比值
5.患者RFS單因素及多因素分析:利用COX回歸模型進行單因素回歸分析,將單因素分析中P<0.1的指標納入多因素分析,結果顯示分化程度、PIVKA-Ⅱ比值、AFP比值及PIVKA-Ⅱ比值+AFP比值為RFS獨立危險因素(表4)。
討 論
流行病學調查顯示,2020 年全球肝癌發病數為 90.6萬,死亡數為 83.0萬,我國肝癌發病和死亡占其45.27%和 47.12%,肝癌患者中大多為HCC,對于早期HCC,手術為首選治療方式,但術后復發率較高。因此,早期篩選出術后復發的高危人群,對于指導治療及改善預后具有重要意義。本研究通過回顧性分析,比較了筆者醫院收治的154例患者臨床特征以及手術前后PIVKA-Ⅱ及AFP水平變化,發現PIVKA-Ⅱ比值及AFP比值可識別人群中復發率較高的患者。其中PIVKA-Ⅱ比值<0.68的患者預后較好[復發率:79.3% vs 34.4%;RFS:16(5,32)個月 vs 32(24,45)個月]。同樣,AFP比值<0.53的患者預后較好[復發率:72.0% vs 31.6%;RFS:20(2,50)個月 vs 32(1,62)個月]。多因素分析結果顯示,低分化、PIVKA-Ⅱ比值≥0.68、AFP比值≥0.53、PIVKA-Ⅱ比值+AFP比值≥0.55為RFS的獨立危險因素。
AFP是一種與HCC有關的糖蛋白,然而,在30%~40%的HCC患者中,AFP水平的升高并不明顯,而且在某些良性疾病(如嚴重肝炎、肝硬化和肝衰竭)、妊娠及生殖系統腫瘤中,AFP水平也會升高。因此,AFP在診斷HCC時敏感度和特異性并不高[16,17]。PIVKA-Ⅱ是由維生素K缺失或拮抗劑-II誘導的異常形式的凝血酶原,目前關于PIVKA-Ⅱ的研究主要集中在HCC的診斷方面。PIVKA-Ⅱ作為藥物靶點通過激活c-Met和其他信號轉導途徑促進HCC細胞增殖、侵襲和轉移[18]。研究表明治療前高水平PIVKA-Ⅱ及AFP患者復發風險較高,部分研究也提示PIVKA-Ⅱ>200是HCC治療后腫瘤復發及總生存期的獨立危險因素[15,19]。另外,有研究顯示與治療前PIVKA-Ⅱ、AFP比較,治療后水平與患者存活率及復發率具有更顯著的相關性,并且是其相關的獨立危險因素[19]。其他研究顯示,術前AFP、術后PIVKA-Ⅱ與復發有關,而術前PIVKA-Ⅱ水平與復發無關[20]。本研究發現,復發組與未復發組比較,術前及術后PIVKA-Ⅱ、AFP比較差異均有統計學意義,且單因素分析表明術前PIVKA-Ⅱ、術前AFP、術后PIVKA-Ⅱ、術后AFP為患者RFS的影響因素。
本研究進一步發現,對于根治術患者,無論術后是否復發,術后指標與術前比較均有明顯降低,且未復發組指標下降的更明顯。根據ROC曲線確定的最佳截斷值分組發現,高值組的復發風險更高,預后更差。目前對于患者術后病情監測主要依賴影像學檢查,但影像學檢查常不能及時發現較小的新病灶。本研究結果顯示PIVKA-Ⅱ比值及AFP比值與術后復發率及RFS有關,這表明其有望成為監測患者術后病情的有效指標,從而減少影像學檢查帶來的重復輻射暴露和造影劑的使用。本研究存在以下不足:(1)本研究是一項回顧性研究,存在選擇偏倚。(2)研究表明,AFP的半衰期為96h,PIVKA-Ⅱ的半衰期為60h,為避免治療后指標的值受治療前升高的影響,筆者選擇收集患者術后1個月左右入院復查時的血清中PIVKA-Ⅱ及AFP水平作為術后指標,并沒有繼續監測患者之后的指標水平以進一步研究[21]。(3)本實驗樣本量較少,隨訪時間較短,只分析了指標與腫瘤復發之間的關系,沒有對患者繼續隨訪研究其術后生存情況,在今后的工作中將進一步擴大樣本量以及隨訪患者的生存時間,以開展相關方面的深入研究予以進一步證實。

