淀粉酶鏈霉菌幾丁質酶克隆表達及催化功能分析
李 芹 王立梅 齊 斌,
(1. 蘇州大學醫學部藥學院,江蘇 蘇州 215123;2. 常熟理工學院蘇州市食品生物技術重點實驗室,江蘇 常熟 215500)
幾丁質是一種天然堿性線性多糖,其結構由多個N-乙酰-D葡萄糖胺通過β-1,4糖苷鍵連接組成,是來自甲殼動物的外骨骼以及真菌和昆蟲細胞壁的第二個最豐富的天然生物聚合物[1]。其年生物合成量約為1 000億t,降解產物中的幾丁寡糖、殼低聚糖和N-乙酰氨基葡萄糖被廣泛應用于食品、紡織、農業等領域,具有普遍的生物活性和廣闊的市場開發前景[2]。幾丁寡糖是由幾丁質或殼聚糖降解獲得的水溶性物質,聚合度為2~20,是目前自然界中唯一帶正電的堿性氨基酸寡糖[3],具有良好的水溶性、抗氧化和抗腫瘤活性[4]。目前,制備幾丁寡糖的方法包括化學和物理降解、酶催化水解[5]和轉糖基化介導的合成[6]。大多數幾丁寡糖是通過化學方法生產的,主要使用酸或氧化劑來降解幾丁質[7],該方法會造成嚴重的環境污染和資源浪費[8]。轉糖基化介導的幾丁寡糖合成是幾丁寡糖酶促生產的新方法,該反應取決于在供體和受體糖之間引入新的糖苷鍵[9]。據報道[10-12],只有少數GH18幾丁質酶具有轉糖基化(TG)活性。酶催化因具有反應條件溫和、酶促副反應少、產品安全性高、無環境污染等優點,將逐步取代傳統的酸性或氧化降解方法[13]。因此,利用幾丁質酶降解法降解幾丁質生產幾丁寡糖的研究較多[14-15]。
幾丁質酶是一類可以催化幾丁質并將其專一性降解為幾丁寡糖、殼聚糖和N-乙酰葡萄糖胺的糖苷鍵水解酶[16]。然而,目前產幾丁質酶活性高、用于工業化生產幾丁寡糖的菌株極少,只有少數黏質沙雷氏菌和木霉菌等。張博陽等[17]對桑氏鏈霉菌幾丁質酶基因ChiKJ40進行克隆表達,得到幾丁質酶活性為0.080 U/mL。Li等[18]采用PCR方法對Streptomycessampsonii(Millard&Burr)Waksman KJ40的幾丁質酶基因ChiKJ406136進行克隆并在大腸桿菌BL21(DE3)中表達,其粗蛋白質和純化蛋白質溶液中的幾丁質酶活性僅為0.045,0.033 U/mL。研究擬對淀粉酶鏈霉菌CS1801幾丁質酶PROKKA01070基因在大腸桿菌中進行克隆,通過原核表達系統獲得可溶性幾丁質酶,對其活性進行探究,結合同源建模、催化域氨基酸比對及其催化域關鍵氨基酸位點突變,驗證其活性口袋內部關鍵氨基酸的功能,揭示這些氨基酸殘基在酶催化中的作用,為該菌的后續深入研究及工業生產幾丁寡糖提供依據。
1 材料與方法
1.1 材料與儀器
1.1.1 材料與試劑
淀粉酶鏈霉菌(Streptomycesdiastaticus)CS1801:由實驗室從蝦醬中篩選得到;
大腸桿菌Top10感受態、大腸桿菌BL21(DE3)、細菌DNA抽提試劑盒、高GC含量PCR擴增試劑盒、DNA凝膠回收試劑盒、質粒小提取試劑盒、定點突變試劑盒、氨芐青霉素鈉:生工生物工程(上海)股份有限公司;
PMD-19T載體基因克隆試劑盒以及限制性內切酶(EcoRⅠ和XhoⅠ):寶日醫生物技術(北京)有限公司;
pET-32a(+)載體:南通柯侎克生物科技有限公司。
1.1.2 儀器與設備
全溫振蕩培養箱:ZQZY-CF型,上海知楚儀器有限公司;
微孔板分光光度計:XMARK型,美國Bio-Rad公司;
恒溫培養箱:GHP-9270型,上海索普儀器有限公司;
電子天平:XS105DU型,瑞士Mettler Toledo公司;
高速臺式離心機:Legend Micro 17R型,德國Thermo公司;
高速冷凍離心機:CR22GⅡ型,日本Hitachi公司;
垂直電泳系統:proteanⅡ型,美國Bio-Rad公司;
PCR基因擴增儀:My Cycler型,美國Bio-Rad公司;
瓊脂糖水平電泳槽:DYCP-31BN型,美國Bio-Rad公司;
凝膠成像系統:Gel Doc X型,美國Bio-Rad公司;
核酸濃度測定儀:NanoDrop 2000型,德國Thermo公司。
1.2 方法
1.2.1 膠體幾丁質制備 稱取10 g幾丁質粉末,加至200 mL濃鹽酸中,均勻攪拌至全部溶解,過濾,加入1 000 mL 蒸餾水,離心,用蒸餾水洗沉淀至中性,4 ℃保存備用。
1.2.2 幾丁質酶ChiA基因擴增和克隆 根據細菌DNA提取試劑盒提取淀粉酶鏈霉菌CS1801(StreptomycesdiastaticusCS1801)基因組DNA。根據已獲得的淀粉酶鏈霉菌全基因組測序數據庫信息中,幾丁質酶PROKKA01070基因序列用Primer Premier 5.0生物軟件設計兩條引物,在兩條引物的5’端分別引入酶切位點,如表1所示。

表1 引物序列Table 1 Primer sequences
去除幾丁質酶PROKKA01070基因序列的信號肽,PCR擴增目的基因片段,PCR反應條件:95 ℃ 3 min,95 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,共30個循環,72 ℃ 30 min,4 ℃保存。瓊脂糖凝膠電泳檢測PCR結果,將PCR產物與pMD19-T載體通過T4連接酶16 ℃連接過夜后轉化至Top10感受態細胞中并進行藍白斑篩選,挑選白色單克隆菌落進行菌液PCR驗證,將鑒定為陽性的重組菌株送生工生物工程(上海)股份有限公司進行測序。
1.2.3 表達載體的構建 將測序正確的ChiA/pMD19-T質粒與表達載體pET-32a(+)分別用EcoRⅠ酶和XhoⅠ酶雙酶切。驗證酶切產物后,切膠回收質粒和基因片段。酶切的ChiA基因片段用T4連接酶與酶切的pET-32a(+)連接。轉化Top10感受態細胞,培養過夜。菌落PCR和質粒酶切鑒定后,獲得的陽性重組菌ChiA/pET-32a(+)/Top10送至生工生物工程(上海)股份有限公司進行測序。
1.2.4 重組幾丁質酶SDS-PAGE分析 將測序正確的ChiA/pET-32a(+)轉化至大腸桿菌BL21(DE3)感受態細胞,涂布于含有氨芐青霉素的LB平板上,挑取陽性克隆于50 mL含氨芐青霉素的LB液體培養基中,37 ℃、200 r/min培養過夜。按2%接種量接種至新鮮的LB液體培養基中,37 ℃、200 r/min震蕩培養至OD600 nm為0.6~0.8,用終濃度為0.5 mmol/L的IPTG,16 ℃誘導24 h。收集菌體,按1 g/5 mL加入裂解液,加入溶菌酶1 mg/mL,冰育45 min,分別于-20 ℃、室溫下進行凍融循環。破壁后,10 000 r/min離心20 min,取菌體、上清和沉淀進行SDS-PAGE分析[19]。
1.2.5 酶活測定 采用DNS(3,5二硝基水楊酸)法[20-21]。N-乙酰-D-氨基葡萄糖標準曲線為y=3.310 6x-0.077 4,R2=0.995 9。
1.2.6 重組幾丁質酶的表征
(1) 反應溫度:采用標準幾丁質酶活性測定法測定20~70 ℃下幾丁質酶活性。
(2) pH值:分別在檸檬酸—檸檬酸鈉緩沖液(pH 3.0~5.0)、磷酸氫二鈉—磷酸二氫鈉緩沖液(pH 6.0~8.0)、Tris-HCl緩沖液(pH 9.0)和碳酸氫鈉—氫氧化鈉緩沖液(pH 10.0~11.0)中進行標準酶活性測定,確定ChiA的最佳反應pH,所有緩沖液濃度均為50 mmol/L。
(3) 金屬離子及化學試劑:分別用1,5,10 mmol/L的MgCl2、FeCl3、ZnCl2、CaCl2、KCl、NaCl、C2H3O2Li、EDTA、巰基乙醇、SDS,在標準幾丁質酶測定條件下探究幾丁質酶活性。
(4) 底物:用1%的膠體幾丁質、粉狀幾丁質、蝦殼粉、蟹殼粉、殼聚糖、羧甲基纖維素鈉,于磷酸氫二鈉—磷酸二氫鈉鹽緩沖液(pH 7.0)中,50 ℃反應30 min,測定ChiA的底物特異性。
1.2.7 同源建模 在NCBI的PDB結構數據庫中,將幾丁質酶ChiA的氨基酸序列進行BLAST,將檢索出的同源性高的蛋白作為模板,利用同源模建的方法構建幾丁質酶ChiA的三維結構。幾丁質酶同源建模選用SWISS-MODEL在線軟件[22],建模后用PROCHECK作拉氏圖評估預測三維結構的可信度[23]。
1.2.8 氨基酸多序列比對 根據幾丁質酶ChiA同源建模模型,利用Clustal Omega在線軟件,比對分析幾丁質酶ChiA編碼的催化域氨基酸序列與其他同源性高并且晶體結構確定的幾丁質酶催化域的氨基酸序列,推測幾丁質酶ChiA的催化反應機制。
1.2.9 催化域關鍵氨基酸的突變 以ChiA/pET32a(+)/Top10作為出發菌株,采用定點突變試劑盒[24],根據18家族幾丁質酶ChiA催化域氨基酸比對結果,選擇催化結構域中的關鍵氨基酸位點進行定點突變,探究其催化活性。為了確保所需的突變是序列中唯一的突變,在生工生物工程(上海)股份有限公司中對插入的DNA的整個區域進行測序。
1.2.10 突變體在大腸桿菌BL21(DE3)中的表達 將序列突變正確的重組質粒轉化至大腸桿菌BL21(DE3)中,挑取單菌落至50 mL含有Amp(100 μg/mL)的LB培養基中,37 ℃、200 r/min培養過夜。按2%接種量接種至新鮮的LB液體培養基中,37 ℃、200 r/min震蕩培養至OD600 nm為0.6~0.8,用終濃度為0.5 mmol/L的IPTG,16 ℃ 誘導24 h。收集菌體,按1 g/5 mL加入裂解液,加入溶菌酶1 mg/mL,冰育45 min,于-20 ℃、室溫下進行凍融循環。破壁后,10 000 r/min離心20 min,去沉淀留上清酶液。
1.2.11 突變體酶活力和動力學參數測定 用DNS法測定突變體酶活。動力學參數測定:在反應管中加入不同質量濃度(1.25,2.50,5.00,7.50,10.00,12.50 mg/mL)的底物膠體幾丁質,加入相同量的適量酶液,50 ℃、200 r/min 搖床反應30 min。加入1.5 mL DNS,煮沸5 min 顯色,冰水中冷卻至室溫,10 000 r/min離心5 min,取上清液于540 nm處測定吸光值。通過制作Michaelis-Menten動力學曲線測定Km、Vmax和kcat值。
2 結果與分析
2.1 基因克隆及鑒定
由圖1可知,幾丁質酶PROKKA01070基因擴增結果與實驗室前期全基因組測序結果一致,大小為1 065 bp;菌液PCR驗證結果在約1 065 bp處有目的條帶,與測序結果一致,說明陽性克隆ChiA/pMD19-T/Top10構建成功。

表2 用于定點突變的引物序列Table 2 The primer sequences used in site-directed mutation
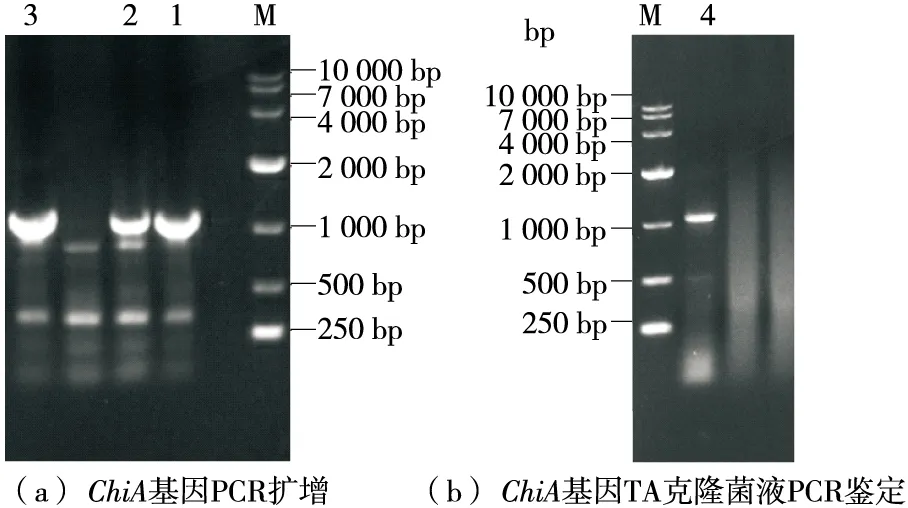
M.10 kb DNA Marker 1~3.ChiA基因PCR擴增產物 4.ChiA/pMD19-T PCR產物圖1 ChiA基因PCR擴增及克隆鑒定Figure 1 PCR amplification and clone identification of ChiA gene
2.2 ChiA/pET32a(+)表達載體的構建與鑒定
由圖2可知,菌落PCR電泳顯示在約1 065 bp處有一目的條帶。雙酶切驗證結果表明,約在1 065,6 000 bp有目的條帶,大小與預期結果相符,表明目的基因和表達載體連接方向正確,證明原核表達載體ChiA/pET32a(+)構建成功。
2.3 表達產物的鑒定及酶活檢測
由圖3可知,45 kDa附近有目的條帶,與預測蛋白大小相差無幾,說明該重組菌成功表達蛋白。將構建好的重組菌株誘導表達后,在pH 7.0,50 ℃下,誘導后的酶活為132 U/L,而未誘導的檢測不到酶活性,說明重組幾丁質酶ChiA在大腸桿菌中成功表達且重組幾丁質酶活性比原始酶活性(100 U/L)提高了32%。
2.4 重組幾丁質酶的表征
2.4.1 pH和反應溫度 由圖4可知,重組酶在pH 7.0下顯示出最高的活性,最佳反應溫度為50 ℃。
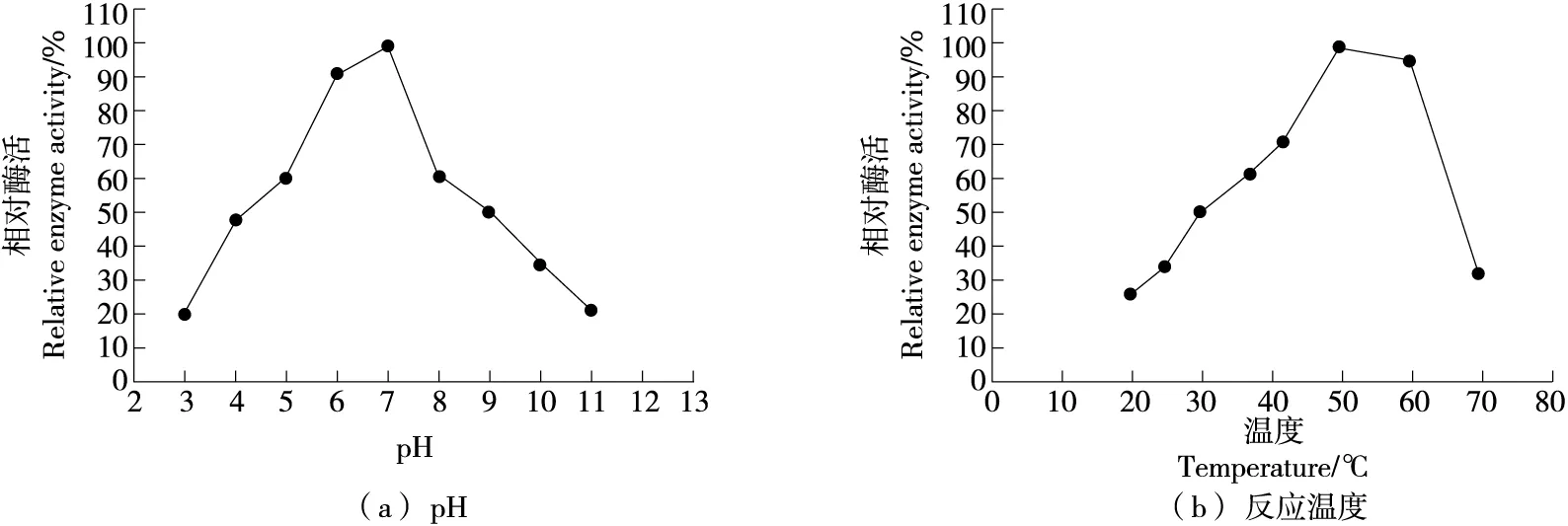
圖4 pH和反應溫度對ChiA活性的影響Figure 4 Effects of pH and temperature on ChiA activity
2.4.2 金屬離子和化學試劑 由表3可知,10 mmol/L濃度下,Zn2+和Fe3+對該重組酶有較強烈的抑制作用,相對酶活力只有37.7%和35.3%;Mg2+、Ca2+、SDS、巰基乙醇、EDTA對該酶也有不同程度的抑制,但K+、Na+、Li+對該酶分別有6.3%,10.6%,8.6%的促進作用。1,5 mmol/L 濃度下,Zn2+和SDS對重組酶有較強的抑制作用,其他離子和試劑對該酶無明顯影響。1 mmol/L濃度下,Ca2+、Fe3+和Mg2+對該酶有一定的促進作用。試驗濃度下,Na+和Li+對該酶均有促進作用。
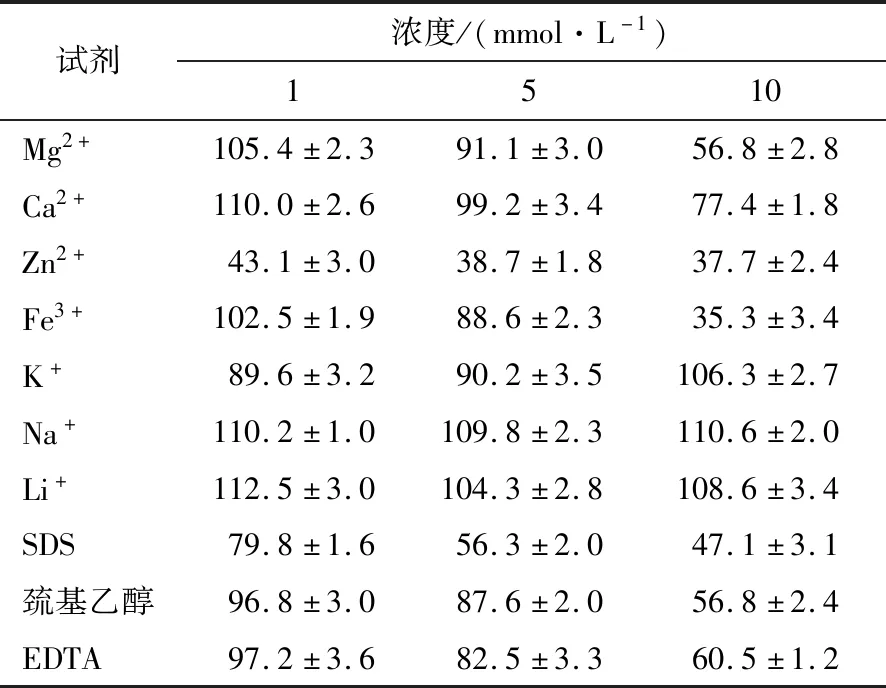
表3 離子和化學試劑對重組酶ChiA酶活力的影響Table 3 Effects of different metal ions and chemicals on ChiA activity %
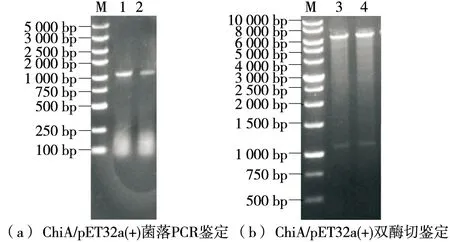
M.5 000 bp DNA marker 1~2.ChiA/pET32a(+) PCR產物 3~4.ChiA/pET32a(+) 雙酶切條帶圖2 重組質粒ChiA/pET32a(+)鑒定Figure 2 Identification of recombinant plasmid ChiA/pET32a(+)
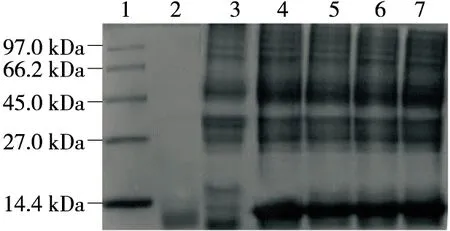
1.蛋白Marker 2.誘導前全菌體 3.誘導后全菌體 4~5.試劑盒提取酶蛋白 6~7.誘導后破壁上清圖3 重組蛋白SDS-PAGE分析Figure 3 SDS-PAGE analysis of recombinant protein
2.4.3 底物 由表4可知,當以膠體幾丁質為底物時,重組酶的相對酶活性最高;當以粉末為底物時,重組酶的相對酶活性為9.8%。當以1%蝦殼粉和蟹殼粉為底物時,只檢測到微弱酶活;當以殼聚糖和羧甲基纖維素鈉為底物時,檢測不到酶活。綜上,重組酶可以有效地降解膠體幾丁質,對幾丁質具有底物特異性,而殼聚糖、羧甲基纖維素鈉等幾丁質結構類似物不能與重組酶特異性結合。
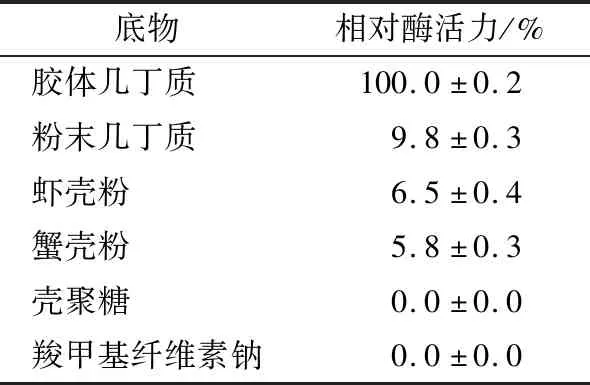
表4 ChiA的底物特異性測定結果Table 4 Determination of substrate specificity of ChiA
2.5 同源建模
經比對分析,選擇與幾丁質酶ChiA催化結構域中的結構基序(PDBID:4w5u)在相應的密碼子區域具有69.03% 的氨基酸序列相似性的嗜熱鏈霉菌(StChi40)的幾丁質酶作為ChiA同源建模的模板。由圖5可知,ChiA屬于18家族糖苷水解酶,其結構由8個α-螺旋內桶和8個β-折疊外桶組成,它們緊密地擠在一起,并由一個不規則的卷曲段連接。18家族中對應β-3和β-4鏈的兩個高度保守的氨基酸片段具有相似的結構,底物結合位點位于β-3和β-4鏈的保守序列形成的環縫中。
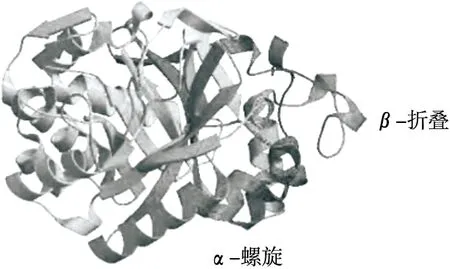
圖5 幾丁質酶ChiA的三級結構模型Figure 5 Three-dimensional structure model of chitinase ChiA
由圖6可知,90.4%,8.6%,1.0%和0%的氨基酸分別落入核心區、偏好允許區、一般允許區和不允許區。總的來說,90%以上的氨基酸在其偏好區,說明預測的幾丁質酶三維結構可信。
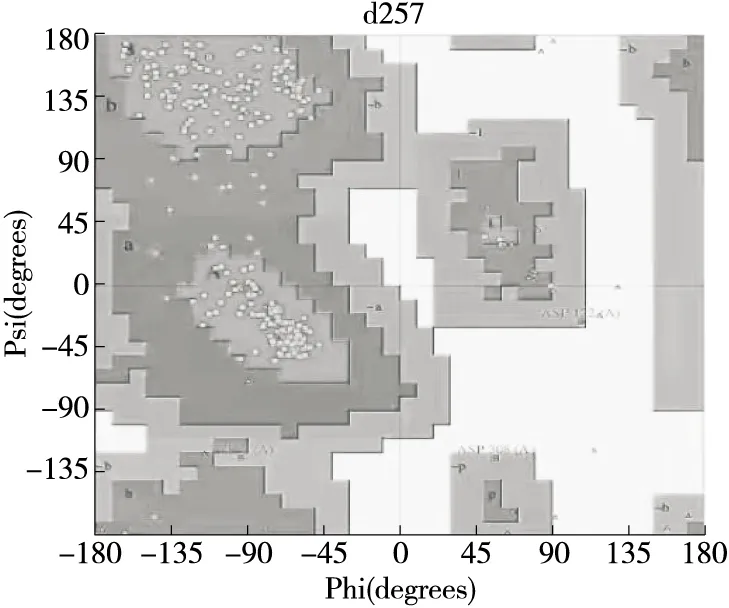
圖6 幾丁質酶三維結構拉氏圖Figure 6 Ramachandran plot of the modeled 3D structure of chitinase
2.6 ChiA催化氨基酸序列分析
序列比對分析所選序列,包括環狀芽孢桿菌(BacilluscirculansWl-12)菌株Chitinase A1的A鏈(PDB:1ITX_A)、嗜熱鏈霉菌(StreptomycesthermoviolaceusStChi40)菌株幾丁質酶的A鏈(PDB:4W5U)、關節桿菌(Arthrobactersp.TAD20)菌株Chitinase B的A鏈(PDB:1KFW)、黏質沙雷氏菌(Serratiamarcescens)菌株Chitinase A的A鏈(PDB:1X6L)、黏質沙雷氏菌(Serratiamarcescens)菌株Chitinase A的A鏈(PDB:2WK2)、黏質沙雷氏菌(Serratiamarcescens)菌株Chitinase A的A鏈(PDB:1RD6)和哈氏弧菌(VibrioHarveyi)菌株幾丁質酶的A鏈(PDB:3B8S_A)。由圖7可知,8種菌的氨基酸序列和功能有差異性,但都具有高度保守的催化域的關鍵氨基酸。ChiA具有兩個典型的18家族糖苷水解酶的保守域,分別為87~90位的“SxGG”結構和125~132位的“DxxDxDxE”結構,在催化域的環縫部位。有研究[25-27]表明,幾丁質酶“SxGG”保守模塊的活性中心負責酶與底物結合,“DxxDxDxE”保守域的催化活性中心具有催化降解底物功能。125DxxDxDxE132形成即(βα)8桶的β-4鏈,構成催化域的核心部位。
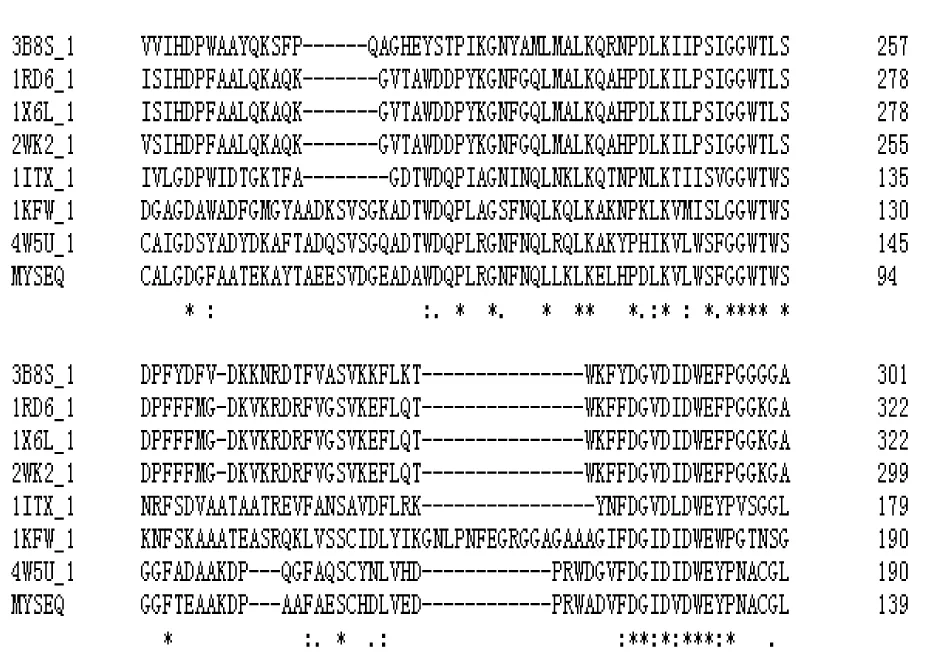
圖7 幾丁質酶ChiA催化域與其他生物體的催化域多重序列比對Figure 7 Multiple sequence alignment of the catalytic domain of chitinase ChiA with that of other organisms
2.7 重組菌株中活性位點氨基酸的定點突變
為了證實ChiA中保守氨基酸的功能,將D128、D130和E132殘基用Asn、Ala或Gln取代,產生6個突變體:D128N、D128A、D130N、D130A、E132Q和E132A。
由圖8可知,突變體的比活性大大降低,特別是E132A、E132Q幾乎完全失活(12.7,13.2 U/L),證實了Glu-132在酶催化中起重要作用;在突變體中,D128N、D128A、D130N和D130A也表現出較低的比活性,證實了D128、D130、E132氨基酸在18家族的保守區域中起重要作用。有研究[28]報道,Glu-132在催化反應中作為質子供體起著關鍵作用。突變體D130N的比活性在陰性突變體中最高,因為天冬酰胺提供的氫鍵可以取代天冬氨酸提供的氫鍵,而丙氨酸不能產生氫鍵[25]。天冬氨酸在130位的催化作用主要由氫鍵支持,因此氫鍵的存在極大地穩定了ChiA的催化活性[29]。第128位的天冬氨酸被認為是D130的輔助因子,增加了D130的pKa[30]。此外,DXXDXDXE保守結構域中的中間Asp可以增加幾丁質酶的轉糖基活性[31]。
2.8 重組幾丁質酶突變體的動力學常數
由表5可知,6個突變體的催化效率與重組酶相比顯著降低,其Km值明顯升高,可能是突變體與底物膠體幾丁質之間的親和力減小,證明了D128、D130、E132是催化幾丁質酶降解幾丁質生產幾丁寡糖的關鍵氨基酸活性位點。
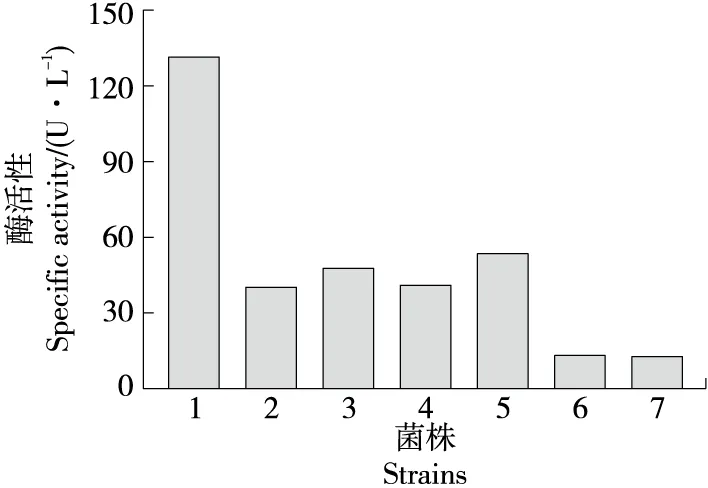
1~7分別為ChiA、D128A、D128N、D130A、D130N、E132Q和E132A菌株圖8 各個突變體酶活Figure 8 The specific activities of the mutants
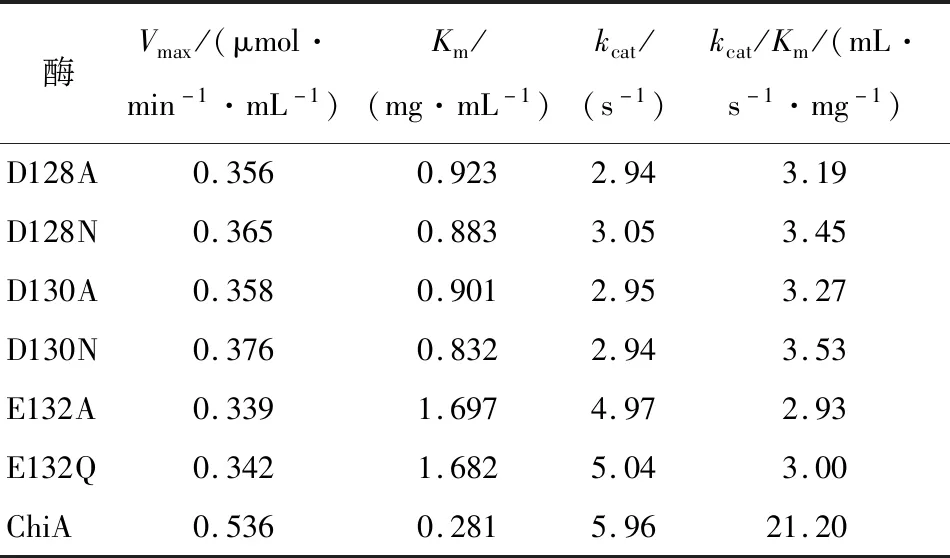
表5 ChiA及其突變體的動力學參數Table 5 Kinetic parameters of ChiA and its mutants
3 結論
以淀粉酶鏈霉菌CS1801幾丁質酶基因序列為研究對象,以大腸桿菌BL21(DE3)為表達宿主,成功表達了幾丁質酶ChiA。結果表明,幾丁質酶重組工程菌培養周期縮短至24 h,酶活為132 U/L,較原始酶提高了32%。重組幾丁質酶的最適反應溫度為50 ℃,pH為7.0,且該酶具有膠體幾丁質底物特異性。第128,130位的天冬氨酸和132位的谷氨酸是幾丁質酶ChiA催化結構域內的催化活性氨基酸。為進一步提高幾丁質酶的活性及酶法生產幾丁寡糖的效率,可通過分離純化、酶固定化等技術對幾丁質酶進行研究,獲得催化生產幾丁寡糖效率得到提高的幾丁質酶。

