康柏西普聯合復合式小梁切除術及視網膜光凝治療新生血管性青光眼
王偉偉,梁京亞,閆歡歡,楊 欣,朱 娟,孫 娜,劉建榮
0引言
新生血管性青光眼(neovascular glaucoma,NVG)是繼發于視網膜缺血性疾病的一類難治性青光眼,最常見的病因為糖尿病視網膜病變(diabetic retinopathy,DR)和視網膜靜脈阻塞(retinal vein occlusion,RVO)[1]。缺血的視網膜促使血管內皮生長因子(vascular endothelial growth factor,VEGF)合成釋放增加,導致虹膜及房角新生血管形成,阻礙房水外流、眼壓升高;隨著病情的進展,新生血管膜收縮導致虹膜前黏連、房角關閉,引起藥物難以控制的高眼壓、劇烈眼痛以及視功能嚴重受損甚至喪失[2-3]。目前治療NVG的主流手術方法包括Ahmed引流閥植入術、EX-PRESS引流釘植入術和復合式小梁切除術,復合式小梁切除術相比于前兩種手術方式,無需引流閥和引流釘的耗材費用而在臨床應用廣泛。但是,單純復合式小梁切除術治療NVG,術中出血、術后前房積血、濾過泡瘢痕化等并發癥常導致眼壓居高不下或眼壓再次升高而使手術失敗。近年來,應用抗VEGF藥物、復合式小梁切除術及視網膜光凝的聯合治療方案可以有效控制NVG患者的眼壓,挽救患者的視功能[4-6]。本研究探索玻璃體腔注射康柏西普聯合復合式小梁切除術以及視網膜光凝術治療NVG的安全性及有效性。
1對象和方法
1.1對象回顧性分析2018-01/2020-12在我院治療的NVG患者47例47眼(納入患者僅分析單眼數據,雙眼均為NVG者取第一次手術眼的數據資料進行分析),其中女16例,男31例;年齡45~83(平均60.6±10.1)歲;右眼23眼,左眼24眼;合并2型糖尿病患者16例,高血壓患者17例;原發病為DR者16眼,視網膜中央靜脈阻塞(central retinal vein occlusion,CRVO)者26眼,視網膜分支靜脈阻塞(branch retinal vein occlusion,BRVO)者4眼,視網膜靜脈周圍炎1眼;術前視力為0.1~0.3者3眼(6%),0.02~0.1者3眼(6%),手動/30cm者15眼(32%),指數/30cm者6眼(13%),光感/30cm者12眼(26%),無光感者8眼(17%);術前眼壓25.4~71.7(平均46.0±11.9)mmHg。根據中國新生血管性青光眼診療專家共識(2019年)[7]將NVG分三期,即青光眼前期、開角型青光眼期和閉角型青光眼期,本研究納入患者中開角型青光眼期2眼(4%)、閉角型青光眼期45眼(96%)。納入標準:(1)年齡≥40歲;(2)虹膜出現新生血管合并高眼壓(圖1A、D),眼底有缺血性視網膜疾病(圖2A);(3)拒絕睫狀體光凝術。排除標準:(1)既往有眼部手術史;(2)有眼部外傷史;(3)有除外屈光不正、白內障、眼底缺血性視網膜疾病的其他眼部疾病史。本研究遵循《赫爾辛基宣言》,經醫院倫理委員會批準,所有患者均對治療方案知情同意并簽署知情同意書。

圖1 眼前節圖像 A、D:抗VEGF治療前,角膜水腫,虹膜大量新生血管;B、E:抗VEGF治療后,角膜水腫,虹膜新生血管消退;C:小梁切除術后,角膜透明,瞳孔區凝血膜,前房積血3mm;F:小梁切除術后,角膜透明,濾過泡表面血管豐富(箭頭)。
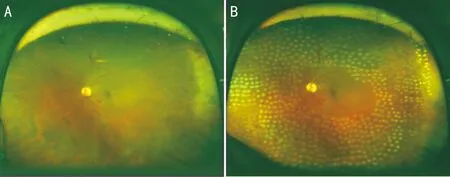
圖2 眼底照相 A:視網膜散在出血,視網膜周邊血管白線狀;B:全視網膜光凝后,激光斑清晰可見。
1.2方法
1.2.1治療方法所有患者均給予眼局部降眼壓藥物治療,根據患者腎功能情況聯合甘露醇靜脈滴注和醋甲唑胺口服治療,均由同一位青光眼醫師實施復合式小梁切除術,并由激光治療中心同一位醫師完成視網膜光凝術。
1.2.1.1玻璃體腔注射康柏西普表面麻醉,前房穿刺緩慢放出房水,指測眼壓T-1。于顳下方角膜緣后4mm處,向玻璃體腔注入康柏西普0.05mL,指測眼壓Tn。結膜囊涂氧氟沙星眼膏包眼。
1.2.1.2復合式小梁切除術本研究納入患者玻璃體腔注射康柏西普后視力無變化,聯合降眼壓藥物后眼壓25.3~65.6(平均39.9±12.5)mmHg,3~7d后實施復合式小梁切除術。球后阻滯麻醉,做以穹窿為基底的結膜瓣,大小3mm×4mm、1/2鞏膜厚度的矩形鞏膜瓣,70歲以下患者鞏膜瓣及結膜瓣下放置濃度0.4mg/mL絲裂霉素C棉片2~5min,平衡鹽溶液沖洗,切除2mm×1.5mm小梁組織,虹膜周邊切除,縫合鞏膜瓣2針,均為可調節縫線。
1.2.1.3視網膜光凝術復合式小梁切除術后2wk進行熒光素眼底血管造影(fundus fluorescein angiography, FFA)檢查(圖3)。DR、CRVO、視網膜靜脈周圍炎患者分3~4次完成全視網膜光凝(圖2B),總點數約2 000;BRVO患者1次完成視網膜光凝,點數約300~500。曝光時間0.1~0.2s,光斑直徑200μm,Ⅲ級光斑。
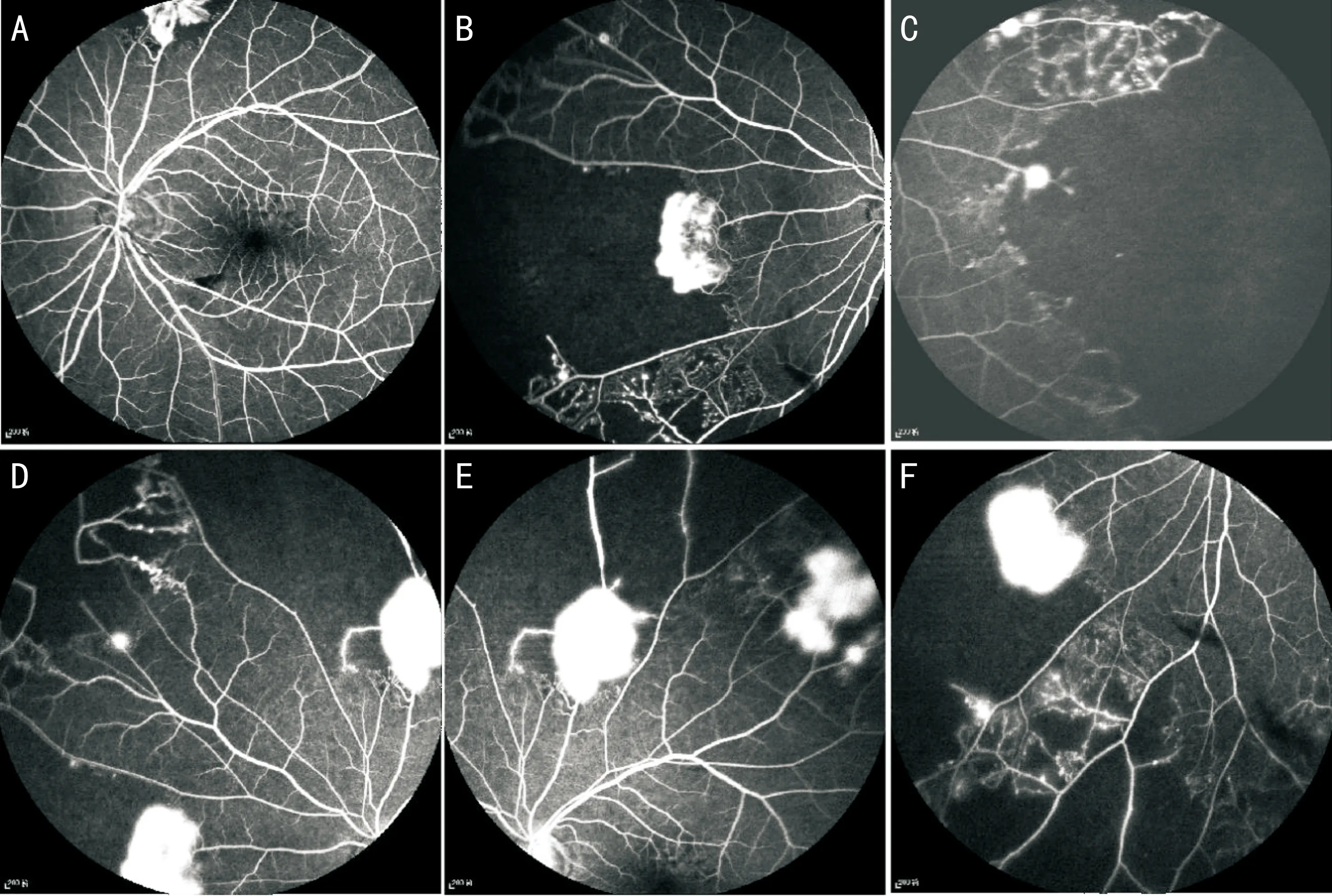
圖3 FFA圖像 A:FFA 24s,視盤顳下方線狀出血遮蔽熒光,視盤上方3PD處可見新生血管;B:FFA 28s,視盤鼻側可見新生血管滲漏及大片狀無灌注區;C:FFA 40s,黃斑顳側可見新生血管滲漏及大片狀無灌注區;D:FFA 45s,視盤鼻上方可見新生血管滲漏、大片狀無灌注區及側支循環;E:FFA 48s,視盤顳上方可見新生血管滲漏及大片狀無灌注區;F:FFA 64s,視盤鼻下方可見新生血管滲漏、大片狀無灌注區及側支循環。
1.2.2觀察指標隨訪6mo,觀察視力(國際標準視力表)、眼壓(非接觸眼壓計)、虹膜新生血管(裂隙燈顯微鏡)、前房積血(裂隙燈顯微鏡)、濾過泡(裂隙燈顯微鏡)等情況。
視力評定標準:視力提高/下降1行或1個等級為提高/下降,否則為無變化。
手術療效評定標準:復合式小梁切除術后6mo,未使用降眼壓藥物(完全成功)或使用降眼壓藥物(條件成功)的情況下,眼壓<21mmHg。
2結果
2.1新生血管消退情況注藥后2~5d,本組患者中40眼新生血管全部消退(圖1B、E),7眼殘留少許新生血管。
2.2視力變化情況復合式小梁切除術后6mo,本組患者中視力提高25眼(53%),其中術前無光感8眼中,提高至0.2、0.02各1眼,提高至手動/30cm 2眼,從無光感恢復光感2眼;視力無變化19眼(40%);視力下降3眼(6%),其中2眼因白內障明顯加重所致,1眼因視網膜靜脈周圍炎導致玻璃體積血,患者放棄手術治療。
2.3手術情況復合式小梁切除術后6mo,本組患者中40例40眼未用任何降眼壓藥物,眼壓<21mmHg,手術完全成功率為85%(40/47);4例4眼應用1~2種降眼壓藥物后眼壓<21mmHg,手術條件成功率為94%(44/47);余3例3眼應用4種降眼壓藥物后眼壓>21mmHg。
2.4眼壓變化情況本組患者入院時眼壓46.0±11.9mmHg,玻璃體腔注射康柏西普3d后眼壓39.9±12.5mmHg,復合式小梁切除術后1、7d,1、3、6mo眼壓分別為15.6±6.2、12.8±5.9、14.7±5.3、17.1±6.9、18.3±6.7mmHg,各時間點眼壓的差異具有統計學意義(F=106.65,P<0.001)。復合式小梁切除術后1d眼壓與入院時、玻璃體腔注射康柏西普3d后眼壓相比差異有統計學意義(均P<0.001),與其他時間點眼壓相比差異無統計學意義(P=0.111、0.649、0.511、0.268)。復合式小梁切除術后7d眼壓與入院時、玻璃體腔注射康柏西普3d后、復合式小梁切除術后6mo眼壓相比差異有統計學意義(P<0.001、<0.001、=0.025),與其他時間點眼壓相比差異無統計學意義(P=0.111、0.304、0.059)。復合式小梁切除術后1mo眼壓與入院時、玻璃體腔注射康柏西普3d后眼壓相比差異有統計學意義(均P<0.001),與其他時間點眼壓相比差異無統計學意義(P=0.649、0.304、0.323、0.162)。復合式小梁切除術后3mo眼壓與入院時、玻璃體腔注射康柏西普3d后眼壓相比差異有統計學意義(均P<0.001),與其他時間點眼壓相比差異無統計學意義(P=0.511、0.059、0.323、0.665)。復合式小梁切除術后6mo眼壓與入院時、玻璃體腔注射康柏西普3d后、復合式小梁切除術后7d眼壓相比差異有統計學意義(P<0.001、<0.001、=0.025),與其他時間點眼壓相比差異無統計學意義(P=0.268、0.162、0.665)。本組患者中7例7眼復合式小梁切除術后1mo出現眼壓升高,結膜下注射5-氟尿嘧啶、指壓眼球、應用局部降眼壓藥物后眼壓<21mmHg,其中4例4眼復合式小梁切除術后6mo眼壓<21mmHg。
2.5并發癥情況本組患者復合式小梁切除術后出現前房積血3眼(圖1C),給予藥物保守治療后3~7d積血完全吸收;復合式小梁切除術后1mo時7眼(15%)濾過泡表面血管豐富(圖1F),出現瘢痕化傾向,眼壓>21mmHg,給予結膜下注射5-氟尿嘧啶(原液)0.3mL,根據是否出現眼瞼腫脹,連續或隔日注射3~5次,指導患者指壓眼球,每天3次,持續1~3mo,加用眼局部降眼壓藥物等綜合療法,復合式小梁切除術后3mo時眼壓均<21mmHg,其中4眼復合式小梁切除術后6mo眼壓<21mmHg。
3討論
多數NVG患者就診時已處于第Ⅲ期,即閉角型青光眼期,藥物難以控制眼壓,治療較為棘手,預后較差。對于尚有視功能的NVG患者,主要的手術方式有復合式小梁切除術、房水引流閥植入術和EX-PRESS引流釘植入術等。復合式小梁切除術性價比最高,對于沒有眼部手術史的NVG患者而言,術中聯合使用抗代謝藥物,術后及時治療原發病,可有效控制眼壓[4-6,8]。但小梁切除術并未消除新生血管生成的原因,圍手術期容易發生前房積血,并且由于難治性青光眼術后炎癥反應強烈,釋放出的炎性因子及VEGF等均會刺激纖維組織增生、濾過通道瘢痕化,導致手術失敗。近年來抗VEGF藥物已成為NVG治療的有效輔助方法[5,6,8-10]。小梁切除術前行玻璃體腔注射抗VEGF藥物,促使新生血管消退,為青光眼手術創造條件,避免術中、術后出血,減輕術后炎癥反應,可提高手術成功率,降低手術并發癥發生率[9-10]。但抗VEGF藥物不能預防VEGF進一步產生,在此基礎上聯合視網膜光凝治療非常重要[5]。因此,目前對NVG的治療常采用藥物、手術、激光等聯合療法。
康柏西普是利用中國倉鼠卵巢細胞表達系統生產的重組融合蛋白,核心區域是全人源化氨基酸序列,比天然單克隆抗體與VEGF結合得更緊密,可完全跨越視網膜,抑制VEGF誘導的血管內皮細胞增殖和血管新生,促進NVG患者虹膜及房角新生血管消退[11-12]。但是,康柏西普不能改善視網膜缺血缺氧狀況,亦不能預防VEGF進一步產生。在終末階段的閉角型青光眼期,由于新生血管膜收縮,房角黏連關閉,即使應用抗VEGF藥物使新生血管消退,亦不能重新開放房角降低眼壓。因此,在玻璃體腔注射康柏西普促使虹膜及房角新生血管消退后,及時行復合式小梁切除術降低眼壓,促使角膜水腫消退,為FFA檢查和視網膜光凝術創造條件。視網膜光凝可封閉視網膜毛細血管無灌注區,破壞感光細胞耗氧量大的線粒體,且光凝后脈絡膜毛細血管彌散至視網膜內層的氧張力提高,使視網膜缺血得到改善,減少眼內VEGF的進一步釋放。
NVG患者的視網膜處于嚴重缺血狀態,高眼壓可進一步降低視網膜的血流灌注,加重視網膜缺血和視神經損傷,急性高眼壓可導致屈光間質混濁、視網膜神經纖維水腫增厚,使受損的視功能雪上加霜,視覺信息傳遞進一步加重甚至出現視力喪失。本研究發現對于及時治療的NVG患者,盡快降低眼壓后部分患者可恢復一定程度的視力。本組患者復合式小梁切除術后6mo時視力提高者占53%,與Jiang等[6]研究結果類似(58.6%)。對于急性高眼壓導致的無光感眼,經過積極救治降低眼壓,亦存在恢復視力的可能性。本組8例8眼無光感患者中,6例6眼恢復了光感或光感以上視力,這6例患者從出現眼脹痛至入院治療的時間為10~30(平均19.6)d。在開放性眼外傷中,視神經的直接或間接損傷均可導致視力無光感,占開放性眼外傷6%~22%[13]。國內多中心前瞻性隊列研究結果顯示,開放性眼外傷無光感眼行玻璃體視網膜手術后,約25%外傷眼可恢復光感以上視力[14]。由此可見,無論是眼外傷還是急性高眼壓導致的無光感,針對具體病情積極救治,仍有恢復一定視力的希望。本研究中,另有2例無光感患者均因腎功能衰竭行透析治療,其中1例患者因高血壓導致腎功能衰竭,出現眼脹痛3mo;1例患者因2型糖尿病導致腎功能衰竭,出現間斷性眼脹痛4a,頭痛伴惡心、嘔吐1wk。雖然這2例患者青光眼手術后眼壓控制在8.6~10.4mmHg,但因全身及眼部微循環嚴重障礙,視神經功能嚴重受損,無法恢復視力。
本組患者玻璃體腔注射康柏西普2~5d后虹膜新生血管消退明顯,85%完全消退,與Alkawas等[5]和Elmekawey等[8]研究結果類似(虹膜新生血管消退率分別為82.4%和86.7%)。由于本組患者治療前96%進入NVG Ⅲ期,即閉角型青光眼期,眼壓居高不下,采用球后阻滯麻醉方法聯合術前靜脈滴注甘露醇(腎功能衰竭患者除外),可減輕高眼壓下手術患者的疼痛感,降低手術風險。做好鞏膜瓣后,通過前房穿刺口緩慢放出房水,逐漸降低眼壓至Tn后行小梁切除術,可避免高眼壓下由于眼壓劇烈波動發生爆發性脈絡膜上腔出血。術中應用絲裂霉素C聯合可調節縫線,可提高手術成功率。術后強化抗炎治療,密切觀察濾過泡的形態變化[15],在出現瘢痕化傾向時,及時予以結膜下注射5-氟尿嘧啶,并指導患者指壓眼球,促使形成功能性濾過泡,從而達到良好的降眼壓效果。術后7d眼壓達到最低值,術后1mo眼壓逐漸升高,與Alkawas等[5]研究結果一致。因此,術后1mo時的密切隨訪和治療方案至關重要。本組患者術后6mo時手術完全成功率為85%,與Jiang等[6]研究結果類似(86.2%)。
NVG治療成功的關鍵在于早期發現虹膜和(或)房角新生血管,進行有效的抑制新生血管治療。此外,還應積極治療原發病,才能有效控制NVG的發生和發展。終末期NVG患者出現藥物難以控制的高眼壓和角膜水腫,阻礙了對原發病的檢查和治療。同時,高眼壓導致眼部炎癥充血狀態,虹膜和房角的新生血管使青光眼手術失敗的風險明顯增加。因此,NVG不是單一的眼科疾病,需全面分析、綜合治療,推薦抗VEGF治療和青光眼手術相結合、同時完成視網膜光凝治療原發病的綜合治療方法,可有效控制眼壓,最大限度保護患者的視功能。對于急性高眼壓導致患者短期內喪失視力,應與患者和家屬做好充分的溝通,積極治療,部分患者可恢復一定程度的視力。本研究發現,玻璃體腔注射康柏西普聯合復合式小梁切除術及視網膜光凝治療NVG具有較高的手術安全性和有效性。

