5-羥色胺基因缺陷增強急性應激后高喚醒狀態*
周萍 肖華 李勇輝 董昕文
(1 湖南師范大學教育科學學院心理學系,長沙 410018) (2 中國科學院心理研究所心理健康重點實驗室,北京 100101)(3 中國科學院大學心理學系,北京 100049)
1 引言
應激刺激是對機體的生存、繁衍過程有傷害或干擾的刺激,能夠誘發機體的應激反應以降低應激刺激造成的傷害。當應激刺激的強度過大,超出應激系統的承受能力,達到創傷應激程度,則會打破應激系統的穩態(McEwen,2017),使機體產生持續的過度反應,出現急性應激障礙、創傷后應激障礙等應激相關精神障礙(American Psychiatric Association,2013)。
喚醒狀態持續處于高水平是創傷應激引起的過度應激反應之一,對創傷相關記憶的闖入性回憶、負性心境、情緒麻木等心理癥狀有預測性(Bryant et al.,2008,2017;Gelkopf et al.,2019)。高喚醒癥狀的強度和表現受到創傷類型和強度的影響,如暴力傷害比意外事故能引起更嚴重的高喚醒癥狀(Agarwal et al.,2020),但是也有研究發現,高喚醒癥狀相比其他PTSD 癥狀,在不同創傷類型之間變異性更低(Boal et al.,2017)。應激引起的高喚醒狀態受到多個神經化學系統的調節,包括去甲腎上腺素系統、5-羥色胺(5-hydroxytryptamine,5-HT)系統、應激激素系統及其它多個神經肽系統(Stam,2007)。其中5-HT 對慢性高喚醒癥狀有重要作用(Young,2013)。5-HT 是一種單胺類神經遞質,又稱血清素,分泌5-HT 的細胞胞體主要位于腦干中縫核,并投射到多個應激相關的前腦區域,包括杏仁核、終紋床核、海馬和前額葉(McQuade &Sharp,2002)。5-HT 不僅參與調節睡眠、覺醒狀態(Monti,2011),還參與調節應激引起的喚醒上升(Linthorst&Reul,2008;Wankhar et al.,2020)。在中等應激強度下,5-HT 在前額葉的釋放可以減少煩躁不安和焦慮(Sherin &Nemeroff,2011),嚴重的創傷應激則會導致5-HT 系統短時間內過度激活,隨后導致5-HT的耗竭(Kaehler et al.,2000),出現煩躁不安、易激惹、注意力不集中等高喚醒表現(Young,2013)。當前對于5-HT 與高喚醒關系的研究很少,作用機制不明確。
基于動物模型對創傷應激反應進行的研究,通常采用兩類應激方式,分別是心理應激方式,比如天敵或天敵氣味暴露、(無接觸的)社交挫敗等,和生理與心理應激相結合的應激方式,比如束縛、電擊、水下應激等(Stam,2007;T?r?k et al.,2019)。目前沒有研究系統對比過動物模型中應激類型對高喚醒狀態的強度和持續時間的影響。高喚醒的具體表現包括心率、血壓等心血管活動提高,入睡困難或睡眠維持困難,注意力無法集中,易激惹,持續的驚嚇反射上升等。其中驚嚇反射(startle reflex)是個體對外界突發性強刺激作出的防御反射,表現為面部與軀干肌肉的快速收縮。相比其它高喚醒的生理或行為表現,驚嚇反射用于實驗研究具有諸多優點,包括在哺乳動物中廣泛存在,反應幅度相對穩定,可反復測試而沒有明顯的習慣化現象,測量方法簡單易操作,因此是反映高喚醒程度的穩定客觀指標(Lang et al.,1990),適用于前臨床研究和臨床轉化研究。
本研究關注5-HT 在創傷應激造成的持續高喚醒狀態中的調節作用,基于實驗室先前建立的創傷后應激障礙動物模型(Dong &Li,2014),通過測量驚嚇反射幅度反映喚醒水平,采用色氨酸羥化酶(tryptophan hydroxylase,Tph)基因缺失小鼠考察不同5-HT 水平對創傷引起的高喚醒的影響。Tph是將色氨酸轉化為 5-羥色氨酸的催化酶,共有Tph1 和Tph2 兩種亞型,中樞神經系統內以Tph2為主(Walther et al.,2003)。基因完全敲除(-/-)的小鼠腦內 5-HT 合成減少約 95%(Gutknecht et al.,2012;Liu et al.,2011),極易夭折,健康狀態差。雜合型(+/-)小鼠腦內5-HT 合成減少約20%~25% (Liu et al.,2011),沒有明顯的健康問題。因此,本研究采用雜合型基因缺失小鼠,與野生型小鼠對比,并采用純心理應激(天敵暴露應激)和生理心理應激相結合(足底電擊應激)兩種應激方式,考察5-HT 降低對創傷應激引起的高喚醒的產生、發展的作用,同時考察其中的性別差異。
2 實驗材料和方法
2.1 實驗動物
實驗采用野生型小鼠和基因缺失的雜合型(+/-)小鼠共136只,其中雄性野生型小鼠26只,雌性野生型小鼠35 只,雄性+/-小鼠40只,雌性+/-小鼠 35 只。野生型小鼠為C57/BL6J 型小鼠,+/-小鼠遺傳背景同為C57/BL6J,從北京大學實驗動物中心購入,購入時體重23~26 g,10 周齡。購入后在中國科學院心理研究所動物實驗平臺進行繁育。小鼠出生后21 天,進行基因鑒定,然后根據基因型分籠飼養,每盒2~5 只。實驗均在光照期進行(8:00 至20:00),溫度21~24 ℃,濕度40%~60%。實驗期間保持動物自由進食和飲水,每周至少更換一次墊料。正式實驗開始前,實驗人員對小鼠進行抓取、撫摸等操作,每次5 分鐘,每天一次,連續進行7 天,使其適應實驗人員操作。所有實驗操作符合《實驗動物管理條例》,并且經中國科學院心理研究所倫理委員會審核通過。
2.2 實驗基本流程與分組
所有小鼠在適應實驗人員操作一周后進行聽覺驚嚇反射測試,每天一次,共兩次。第一次測試作為動物適應測試環境和測試過程的適應,數據未進行統計。根據第二次驚嚇反射測試基線值,對所有小鼠進行偽隨機平衡分組,不同組動物在兩天后接受不同應激處理,分別為無應激組(控制組)、天敵暴露應激組(天敵組)、足底電擊應激組(電擊組)。其中,野生型雄鼠控制組8 只,天敵組9 只,電擊組9 只;+/-雄鼠控制組13 只,天敵組13 只,電擊組14 只;野生型雌鼠控制組12 只,天敵組12只,電擊組11 只;+/-雌鼠控制組12 只,天敵組12 只,電擊組11 只。由于部分小鼠在接受天敵應激時受到天敵(貓)的直接攻擊,實際納入數據分析的天敵應激組動物數量為:雄性野生型9 只,雄性+/-型10 只,雌性野生型8 只,雌性+/-型6 只。在應激后不同時間點,對所有動物進行多次聽覺驚嚇反射測試,分別為應激后1 天、2 天、10 天、18 天,考察不同應激誘發的聽覺驚嚇反射幅度變化過程。
2.3 基因型鑒定方法
從鼠尾末端組織中提取DNA,采用以下序列的引物進行聚合酶鏈式反應(polymerase chain reaction,PCR)擴增:5′-GGGCATCTCAGGACGTAGTAG;5′-GGGCCTGCCGATAGTAA CAC;5′-GCAGCCAGTAGACGTCTCTTAC;之后根據凝膠電泳成像結果判斷小鼠基因型。
2.4 應激方法
無應激組(控制組)小鼠,轉移至非飼養間的實驗室中,在與飼養盒相似大小的盒中獨處10 分鐘,回到原飼養盒。
天敵暴露應激組(天敵組)小鼠,被放入貓所在的敞口開放空間(2 m × 1 m × 1 m),實驗人員在旁邊監控,如果二者間距離小于20 cm 則立即將小鼠轉移至空間內遠離貓的位置,避免直接接觸及可能的軀體傷害。部分小鼠受到貓的直接攻擊,未納入后續測試和數據分析(詳見2.2)。5 分鐘后取出小鼠,回到飼養間。
足底電擊應激組(電擊組)小鼠,被放入電擊箱(30 cm × 30 cm × 27 cm,天鳴宏遠科技發展有限公司),3 分鐘后接受第一次足底電擊,電流強度1.5 mA,持續5 秒,共接受5 次電擊,間隔60~120 s,最后一次電擊后,在電擊箱中停留1 分鐘,之后放回到飼養盒。電擊箱采用5%酒精清潔。
2.5 聽覺驚嚇反射測試
聽覺驚嚇反射通過聽覺驚反射系統(San Diego Instruments 公司)進行測量。從飼養盒取出小鼠,放入適配小鼠的固定盒,將固定盒放入隔音箱中,隔音箱內揚聲器持續播放65 dB 白噪音直至實驗結束。進入隔音箱5 分鐘后,給予90 dB、100 dB、110 dB,持續50 ms 的白噪音刺激各10 次,刺激順序隨機,刺激間隔10~50 s 隨機。通過小鼠固定盒底部的加速度傳感器,記錄小鼠在聲音刺激開始前200 ms 到聲音結束后1000 ms 的重力變化,采樣率為每秒1000 次。結束后,取出小鼠,放回到飼養籠,用5%酒精清潔動物固定盒。
2.6 統計分析
使用R 1.70 和RStudio 1.3.959 軟件進行數據處理。由于多數小鼠在90 dB 噪音刺激下沒有出現明顯的驚嚇反射反應,沒有將90 dB 條件下的驚嚇反射反應納入統計分析,而采用了100 dB 和110 dB誘發的驚嚇反射的平均值。對雄性和雌性小鼠的聽覺驚嚇反射幅度分別進行三因素混合方差分析(基因型×應激類型×測量時間,測量時間為重復測量因素),并進行事后檢驗和簡單效應分析(均采用TukeyHSD 校正),以< 0.05 為差異顯著標準,并報告效應量η和95%置信區間。
3 結果
3.1 性別、基因型對小鼠聽覺驚嚇反射基線水平的影響
應激前對所有動物進行了聽覺驚嚇反射測量,考察性別、基因型(野生型或+/-)對聽覺驚嚇反射幅度的影響。組間方差分析結果顯示,性別主效應顯著((1,119)=18.6,< 0.001,η=0.135,圖1),雄性動物的驚嚇反射幅值顯著大于雌性動物,95% CI=[36.5,99.5],基因型主效應不顯著,性別與基因型的交互作用不顯著。根據基線測試結果,對不同性別、不同基因型的小鼠進行平衡分組,分別接受不同類型應激刺激。
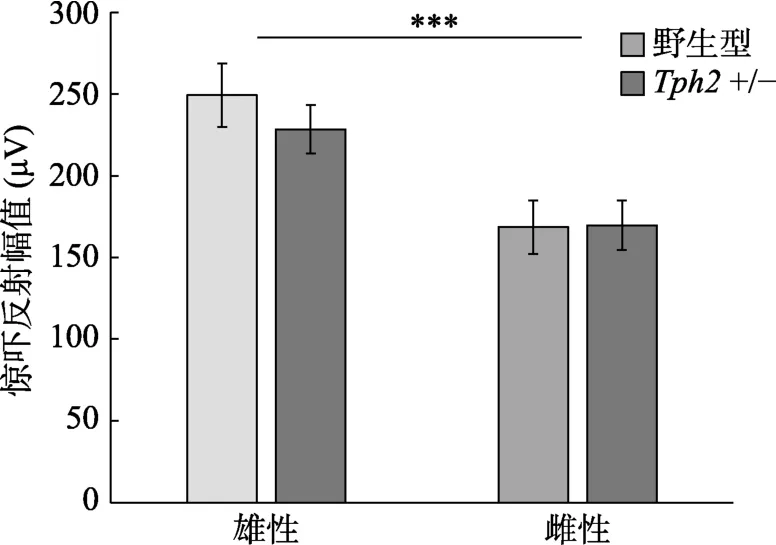
圖1 性別、基因型對小鼠聽覺驚嚇反射幅值的影響
3.2 Tph2 基因對雄性小鼠應激后聽覺驚嚇反射的影響
基于驚嚇反射基線值對不同基因型小鼠進行平衡分組后,分別進行了天敵暴露應激、足底電擊應激及無應激操作,并在1 天、2 天、10 天、18 天后進行4 次聽覺驚嚇反射測試。以測量時間為重復測量變量,應激類型和基因型為組間變量,分別對不同性別小鼠的驚嚇反射幅值進行了方差分析。
結果顯示,應激類型對雄性小鼠驚嚇反射反應幅度有顯著影響((2,57)=7.17,=0.002,η=0.09,圖2),在天敵暴露應激和電擊應激后均出現了驚嚇反射上升(天敵組與控制組,=0.001,95%CI=[22.6,109.0];電擊組與控制組,< 0.001,95%CI=[53.0,136.0]);基因型主效應不顯著;基因型與應激類型交互作用顯著,(2,57)=3.20,=0.048,η=0.043。進一步的簡單效應分析顯示,經歷電擊應激的雄性+/-小鼠相比控制組和天敵應激組,聽覺驚嚇反射幅度更高(電擊組與控制組,< 0.001,95% CI=[63.5,192.0];電擊組與天敵組,=0.022,95% CI=[6.76,145.0]),而不同應激處理組的野生型雄性小鼠驚嚇反射幅值無差異(> 0.05)。不同測量時間驚嚇反射有顯著變化,(3.37,192.34)=20.4,< 0.001,η=0.18 (圖2)。對應激效果的簡單效應分析顯示,在應激后1 天、2天、10 天,電擊組雄性+/-小鼠的驚嚇反射幅值均顯著高于控制組(應激后1 天,=0.031,95%CI=[13.0,312];應激后2 天,< 0.001,95% CI=[84.4,325];應激后10 天,=0.002,95% CI=[68.3,311]),天敵組雄性+/-小鼠與控制組在各個時間點無顯著差異;野生型小鼠,僅在應激后1 天,天敵應激組驚嚇反射顯著高于控制組(=0.025,95% CI=[22.6,374]),在其它時間點天敵組和電擊組小鼠的驚嚇反射幅值均與控制組無顯著差異。對基因型影響的簡單效應分析顯示,在應激后第10天,經足底電擊的雄性+/-小鼠驚嚇反射幅值顯著高于野生型(=0.010,95% CI=[42.4,283]),其他時間點各處理組之間不同基因型小鼠驚嚇反射無顯著差異(> 0.05)。上述結果說明,+/-小鼠在電擊應激后產生了持續10 天以上的驚嚇反射上升表現;基因型對應激引起的驚嚇反射幅度上升的影響表現在應激后數天,而非即刻影響。
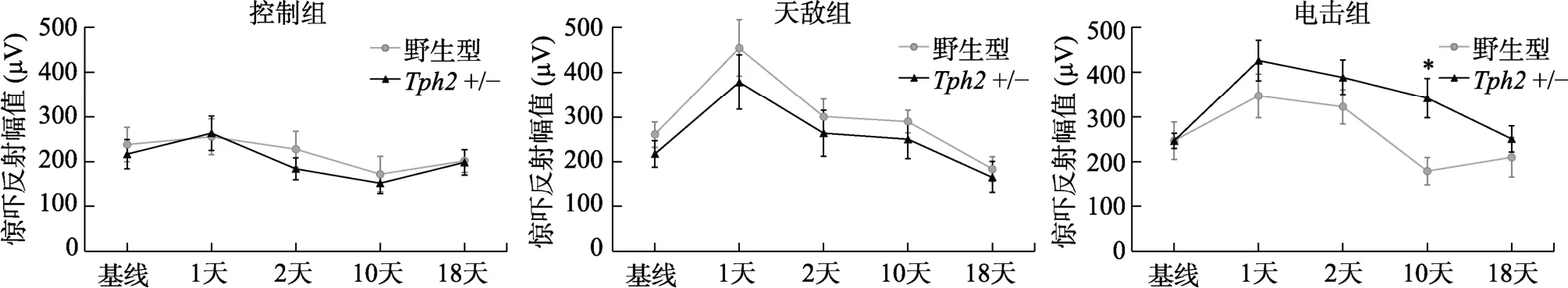
圖2 雄性小鼠在應激前后聽覺驚嚇反射幅值變化
3.3 Tph2 基因對雌性小鼠應激后聽覺驚嚇反射的影響
不同于雄性小鼠在應激后出現明顯的驚嚇反射上升現象,雌性小鼠在天敵或電擊應激后均沒有明顯的驚嚇反射變化,不同基因型間無差異,但是應激刺激、基因型與測試時間三者之間存在顯著的交互作用,(6.16,166.39)=2.62,=0.018,η=0.027 (圖3)。進一步的簡單效應分析顯示,在應激后10 天,接受天敵應激的雌性+/-小鼠驚嚇反射幅值顯著高于野生型(=0.021,95% CI=[20.5,207]);其他時間點,各個應激組的不同基因型小鼠之間無顯著差異。上述結果說明,雌性小鼠在天敵暴露應激和足底電擊應激后早期(應激后1天)沒有出現明顯的驚嚇反射幅度變化,天敵應激后10天+/-小鼠有驚嚇反射小幅上升現象。
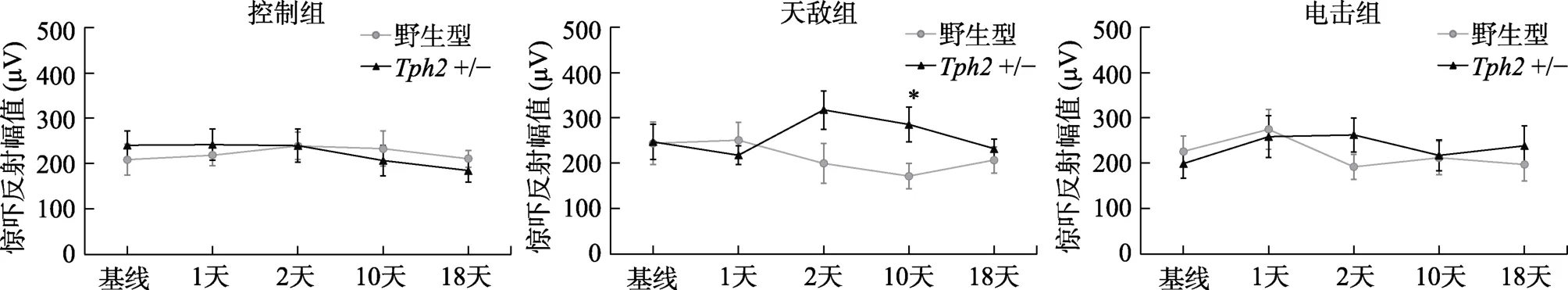
圖3 雌性小鼠在應激前后聽覺驚嚇反射幅值變化
4 討論
本研究關注5-HT 對創傷應激誘發的高喚醒的影響,通過天敵暴露和足底電擊兩種創傷應激手段,以聽覺驚嚇反射作為喚醒水平客觀指標,對比了5-HT 合成酶基因缺失小鼠與野生型小鼠在創傷應激后急性與慢性高喚醒反應變化。結果發現,雄性野生型小鼠在創傷應激后出現明顯的急性高喚醒表現,隨后逐漸恢復,慢性反應不明顯,而雄性基因缺失小鼠在創傷應激后不僅有明顯的急性高喚醒表現,并且能持續10 天以上,具有一定程度的慢性高喚醒,體現了基因與環境的交互作用;雌性小鼠的驚嚇反射幅度明顯低于雄性小鼠,野生型小鼠在創傷應激后沒有表現出驚嚇反射水平波動,雌性基因缺失小鼠在天敵暴露應激后有相對較弱的慢性喚醒上升表現。
對雄性小鼠應激前后多次聽覺驚嚇反射測量結果顯示,+/-小鼠與野生型小鼠的喚醒基線水平沒有明顯差異,但是在應激后約兩周內+/-小鼠喚醒水平持續處于較高狀態。這一結果提示,基因缺失導致的較低水平5-HT 可能參與創傷應激后高喚醒狀態的保持,說明5-HT 可能具有促進應激反應恢復的作用。有研究顯示,功能失調小鼠對社會挫敗應激、束縛應激、天敵應激等急性應激表現出更高的易感性(Brivio et al.,2018;Lieb et al.,2019;Russo et al.,2019;Sachs et al.,2015;Weidner et al.,2019),同時也有研究發現基因缺陷小鼠在多個焦慮行為測試中與野生型沒有顯著差異(Mosienko et al.,2014;Savelieva et al.,2008;Strekalova et al.,2021)。結合本研究中+/-小鼠在應激后才出現喚醒水平持續上升的現象,我們推測基因缺陷引起的5-HT 低水平主要參與強應激后相對緩慢的恢復過程,但是不影響較弱應激刺激引起的即時反應。Tph2 分布在中縫核的5-HT 神經元內,是中樞神經系統內5-HT 合成過程中的重要催化酶,相關的基因缺陷會引起5-HT 合成的效率和總量降低(Abela et al.,2020;Gutknecht et al.,2012;Jacobsen et al.,2012;Liu et al.,2011)。通過光遺傳等技術對5-HT神經元進行調控的研究發現,激活中縫核的5-HT神經元會引起焦慮和恐懼行為增強,損毀神經元或阻斷下游受體則降低焦慮(da Silva Soares et al.,2019),具體的神經通路是中縫核到基底杏仁核或到背側海馬的5-HT 投射(Abela et al.,2020;Bernabe et al.,2020;Sengupta &Holmes,2019)。上述結果提示,短期內5-HT 釋放增加具有增強焦慮、恐懼等應激反應的效果。但是,在我們的研究中,經過基因敲除的小鼠Tph2 一直處于低水平,對5-HT 系統及其下游神經結構的功能有持續影響及代償效果,因此得到不同于光遺傳或藥理實驗中急性干預5-HT 系統的行為結果。對基因缺陷動物的研究發現,5-HT 系統出現 5-HT 分解速度降低(Mosienko et al.,2014)、5-HT1A 受體功能和表達量改變(Gutknecht et al.,2012;Jacobsen et al.,2012)。因此,基因缺損引起的強應激后持續高喚醒可能不僅與5-HT 合成降低有關,還與5-HT 遞質-受體系統的整體平衡失調有關。
本研究結果提示,雄性基因缺陷小鼠在強應激后出現持續時間更長的高喚醒狀態。對應激后高喚醒狀態與PTSD 其他癥狀發展的研究發現,高喚醒能夠預測其他癥狀的發生或嚴重程度(Coronas et al.,2011;Greene et al.,2020;Shaikh al arab et al.,2012),高喚醒可能是驅動PTSD 病程發展的關鍵因素。另一方面,有研究發現基因的單核苷酸多態性與PTSD 和抑郁癥的癥狀發展、治療效果有關(Cao et al.,2014;Tao et al.,2018;Xu et al.,2016)。基于本研究結果,我們認為基因缺陷可能通過加劇急性應激后的高喚醒狀態增加PTSD 或抑郁癥的患病率,同時提示在創傷應激后早期對5-HT系統的干預可能降低PTSD 的發生率。目前選擇性5-羥色胺重攝取抑制劑(selective serotonin re-uptake inhibitors,SSRIs)是治療PTSD 的主要臨床藥物,盡管治愈率僅為20%~30%,仍然高于其他類型藥物(Akiki &Abdallah,2018;Thakur et al.,2021)。目前對 SSRIs 用于創傷后早期干預的報道十分有限(Sijbrandij et al.,2015),創傷后使用SSRIs 能否降低PTSD 的發生率或嚴重程度仍需要更多臨床證據。我們的結果提示,在應激后數日內使用SSRIs,增加可用的5-HT,可能緩解基因缺損造成的中樞神經系統5-HT 不足的個體的高喚醒狀態。
本研究采用了天敵暴露和足底電擊兩種急性應激方式誘發持續的高喚醒反應。結果發現,天敵應激對雄性野生型和+/-小鼠的驚嚇反射反應沒有造成持續影響,與控制組的差異只在應激后24 小時達到統計顯著水平,而較強的足底電擊引起雄性+/-小鼠驚嚇反射持續處于較高水平。兩種應激方式都是當前動物模型中常見的誘發PTSD 樣行為的強刺激,均能引起多種PTSD 樣行為,且持續時間超過一個月(Cohen et al.,2011;Cohen &Zohar,2004;Smith et al.,2019;T?r?k et al.,2019)。兩種應激方式相比,天敵應激是純粹的心理應激,而電擊應激伴隨以痛覺為主的傷害性體驗,二者受到不同神經環路的調節,誘發的應激反應存在一些差異(Gross &Canteras,2012)。對創傷應激后驚嚇反射變化的研究相對較少,其中Cohen 實驗室的結果顯示,天敵或天敵氣味暴露10 分鐘能夠引起應激后一個月時出現驚嚇反射上升。但是,該反應存在明顯的個體差異,在雄性大鼠中,驚嚇反射明顯上升的個體約占40%,而雌性大鼠的比例較低,只有約16% (Koresh et al.,2016)。也有研究發現,天敵應激和電擊應激均對驚嚇反射幅值沒有明顯影響(Smith et al.,2019;Zoladz et al.,2019),甚至有降低驚嚇反射的效果(Gonzales et al.,2008)。我們的研究中,雄性小鼠在應激后短期出現了明顯的驚嚇反射上升,而基因缺陷雄性小鼠在電擊應激后出現了超過10 天的驚嚇反射上升現象。這種現象可能是由于我們選擇的小鼠具有更高的基因相似性,個體差異小于Cohen 實驗室采用的封閉群大鼠,并且基因缺損導致的5-HT 系統失衡增強了驚嚇反射上升的持續時間。
本研究對比了雄性和雌性野生型和+/-小鼠在創傷應激后的驚嚇反射反應,發現雌性小鼠的驚嚇反射基線水平低于雄性小鼠,且在強應激后早期沒有出現幅度變化,僅在應激后10 天經天敵應激的雌性+/-小鼠發現了較弱的驚嚇反射上升現象。這一結果說明,應激引起的驚嚇反射反應性別差異明顯。對人的驚嚇反射研究沒有發現男性與女性基線反應存在差異(Hubbard et al.,2011;Verona&Kilmer,2007),但是對雌性大鼠驚嚇反射的研究發現,雌性動物的驚嚇反射幅度低于雄性(Voulo &Parsons,2017),我們的結果認為小鼠也同樣有此現象。雌性動物驚嚇反射偏低可能與性激素的調節有關,因為有研究顯示,卵巢切除的雌性動物驚嚇反射有所上升(Zoladz et al.,2019)。我們的結果還發現,雌性小鼠在應激后沒有出現雄性小鼠中發現的驚嚇反射急性上升現象,這同樣與以往研究報道的雌性大鼠應激后的表現相似(Voulo &Parsons,2017,2019)。事實上,女性中PTSD患病率高于男性(Kessler et al.,1995;Kilpatrick et al.,2013),與睡眠相關的高喚醒癥狀比男性更嚴重(Kobayashi &Mellman,2012)。性別差異對驚嚇反射的影響及其機制可能不同于其他PTSD 癥狀,目前尚無相關研究證據。本研究結果顯示雌性基因缺陷小鼠在天敵應激后10 天相比野生型小鼠有驚嚇反射幅度上升,但是相比同組動物應激前的驚嚇反射水平并沒有明顯差異,與未經歷應激的控制組轉基因雌鼠相比亦無差異。這一結果可能提示,雌性動物腦內較低水平的5-HT 可能引起應激后慢性的喚醒增強。對5-HT 調節慢性應激反應中的性別差異的研究較少,僅有少量研究顯示,雌性基因缺陷小鼠在應激后沒有明顯焦慮反應(Auth et al.,2018),5-HT 轉運體相關基因缺陷的雌性小鼠在應激后腦內杏仁核區域腦血流無明顯變化,而雄性小鼠該腦區的腦血流受到相關基因的明顯調控(Kolter et al.,2021)。
綜上所述,本研究結果發現,5HT 合成中關鍵催化酶基因缺陷的雄性小鼠在創傷應激后高喚醒持續時間更長,體現了基因和環境共同影響PTSD 高喚醒癥狀的發生、發展,也驗證了5-HT 在高喚醒的產生發展中的關鍵作用,說明5-HT 不足會導致應激后更高的喚醒水平,難以恢復。這一結果為進一步研究PTSD 高喚醒癥狀以及其5-HT 機制提供了行為遺傳模型。

