肝癌患者采用微創介入治療對患者T細胞免疫功能的影響
李雨遙 李棟 孫艷麗
(榆林市第二醫院 (1.腫瘤科放療科; (2.介入科; (3.呼吸與危重癥醫學科,陜西 榆林 719000)
肝癌起病隱匿、惡性程度較嚴重者,確診后已處于中晚期,故選擇手術也無法改善預后,多采用其他非手術治療方案延長生存時間[1]。現肝動脈化療栓塞術、射頻消融術成為肝癌的重要治療方法[2]。其中肝動脈化療栓塞術主要通過栓塞腫瘤供血動脈,抑制腫瘤生長;射頻消融術主要通過超聲引導直接作用于病灶,定位較準確,且損傷較小[3]。調查發現,微創介入治療可對患者T細胞免疫功能造成影響,多數學者均存在爭議[7]。因此,本文分析肝癌治療中微創介入治療對肝癌患者T細胞免疫功能的重要影響。
1 資料與方法
1.1一般資料 選取2019年8月至2020年8月在本院接受治療的肝癌患者260例,隨機分為對照組和觀察組,各130例。對照組中男59例,女71例,平均年齡(68.52±3.64)歲,平均病程(3.24±1.01)月;觀察組男58例,女72例,平均年齡(69.47±3.52)歲,平均病程(3.51±1.02)月。納入標準:經CT、核磁等影像學檢查、病理學檢查結果綜合診斷,均確立收治患者為肝癌;年齡58~75歲;肝癌單發病灶直徑在5 cm及以下;預測生存時間均在三個月及以上;臨床資料完整;肝功能衰竭且全身情況無法耐受手術。排除標準:精神疾病者;臨床資料不完整者;無法積極配合治療者;造影劑、局部麻醉藥物過敏者;手術不耐受者者;嚴重心血管疾病者;轉移范圍較廣者;骨髓抑制者;免疫系統疾病者。本研究通過本院倫理會已審核并批準。兩組患者一般資料比較無統計學意義(P>0.05)
1.2方法 對照組實施肝動脈化療栓塞術治療:對患者行全身麻醉,經皮動脈穿刺,選擇短導絲置入導管鞘,隨之在X線引導下實施進一步插管等操作。導管插入致腫瘤供血動脈后,注入適量造影劑,詳細觀察并記錄患者供血動脈、腫瘤血管等分布,隨之經導管注入栓塞藥物,栓塞劑可選擇明膠海綿及藥物微球等。治療完成,拔管、止血。觀察組實施射頻消融術治療:行氣管插管,給予麻醉藥物進行麻醉,可選擇鹽酸哌替啶等藥物進行注射,在腹部超聲引導范圍內,插入射頻消融儀電極致腫瘤部位,并進行固定,調節射頻脈,同時需要維持腫瘤局部溫度為70℃~95℃之間,通過超聲不同切面掃查,實施監控消融情況,逐點治療,消融期間需要保持安全邊界(0.5 cm)。消融完成后,拔針,在其拔針期間繼續行針道消融,最后進行止血、術后處理。
1.3觀察指標 比較兩組患者治療前后T細胞免疫功能[CD3+(成熟T淋巴細胞)、CD4/CD8];比較兩組患者治療后并發癥情況;比較兩組患者治療前后肝功能指標水平[ALT(血清谷丙轉氨酶)、AST(谷草轉氨酶)]。
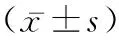
2 結 果
2.1兩組患者T細胞免疫功能指標水平比 治療前,兩組患者T細胞免疫功能指標水平比較無統計學意義(P>0.05);治療后,觀察組T細胞免疫功能指標CD3+、CD4/CD8水平高于對照組(P<0.05)。見表1。

表1 兩組患者T細胞免疫功能指標水平比
2.2兩組患者并發癥總發生率比較 治療后,對照組患者發生腹痛4例,發熱2例,穿刺部位出血4例,惡心嘔吐3例,肝功能損害2例,并發癥總發生率11.54%;觀察組患者發生腹痛、發熱各1例,惡心嘔吐2例,并發癥總發生率3.08%。觀察組并發癥總發生率低于對照組(χ2=6.870,P<0.05)。
2.3兩組患者肝功能指標水平比較 治療前,兩組患者肝功能指標水平比較無統計學意義(P>0.05);治療后,觀察組肝功能指標水平低于對照組(P<0.05)。見表2。

表2 兩組患者肝功能指標水平比較
3 討 論
目前為止,對于肝癌治療,介入微創治療已成為主要治療手段、有效方法。介入微創治療中肝動脈化療栓塞術、射頻消融術,均以精準、微創、高效為理念進行治療,可在殺滅腫瘤的同時,最大限度保證患者安全,保護基本生理功能,以減少對患者的損傷,同時兼顧規范化、個體化質量[4-5]。
本文結果顯示,治療后,觀察組T細胞免疫功能指標水平高于對照組(P<0.05),分析原因,T淋巴細胞主要發揮細胞免疫、免疫調節功能,故在實施介入微創治療期間,需要注重T淋巴細胞的影響,以抑制腫瘤細胞的轉移。肝動脈化療栓塞術可因腫瘤細胞壞死減少免疫抑制因子的釋放,減弱機體免疫功能抑制作用,故可對T細胞免疫功能產生抑制作用[6]。治療后,觀察組并發癥總發生率低于對照組(P<0.05),分析原因,射頻消融術較肝動脈化療栓塞術,可避免化療藥物引發的并發癥,且無放射性損傷,故安全性更高,除此之外,因易于觀察血管及周圍組織變化,故可減少對肝臟正常組織的損傷。治療后,觀察組ALT水平低、AST水平低于對照組(P<0.05)。說明射頻消融術可通過微創向肝臟病灶行注射消融,消融針電極釋放的溫度較高,在超聲引導下準確、實時治療,可殺死腫瘤組織,改善患者預后,此種方案不僅與肝動脈化療栓塞術微創等優點一致,亦因對肝臟等要求較低,更適用于肝功能不好等多種類型患者[7]。而射頻消融術使腫瘤局部發生凝固型壞死的同時,可產生腫瘤碎片,隨之可誘導機體產生抗腫瘤免疫反應,較肝動脈栓塞術治療,可減少免疫抑制因子的釋放,且該治療中熱休克蛋白可作為載體,結合腫瘤抗原形成復合物,活化T淋巴細胞,誘發特定腫瘤特異性細胞免疫功能,射頻消融中高溫特點亦可增加癌細胞的免疫應答[8]。
綜上,微創介入治療肝癌有其特殊優勢,射頻消融術治療更能改善T細胞免疫功能、肝功能,預防或降低并發癥發生,值得應用。

