用氯化亞鐵從高鹽固廢浸出液中去除氰化物試驗研究
丘 能,林宏飛,周郁文,陸立海,楊崎峰
(廣西博世科環保科技股份有限公司,廣西 南寧 530006)
電解鋁生產過程中,電解槽陰極內襯維修、更換會產生大量廢渣。這些廢渣屬于危險廢物,其中含有大量無機氟化物和氰化物等毒性物質,浸出毒性分別達7 638 mg/L和18.2 mg/L[1],遠高于標準要求的100 mg/L和5 mg/L[2];同時,也含有其他可溶性鹽類物質,如氯化鈉、氯化鋁等。
廢渣中的氰化物主要以Na4Fe(CN)6、NaCN形式存在[3],遇水會釋放出有毒氣體HCN。高溫是去除氰化物最簡單有效的方式:氰化物加熱至550 ℃以上可分解為N2和CO2,在700 ℃下分解完全[4-5];但高溫處理成本相對較高,且存在二次污染的可能。
廢渣中的氟化物、氰化物及其他鹽類大部分易溶于水,因此,其浸出液鹽度高,毒性大,氰化物形態復雜、濃度高,必須處理達標后才能排放。目前,國內外針對含氰廢水的處理手段主要有堿氯氧化法、雙氧水氧化法和微生物降解法等[6-8]。堿氯氧化法主要采用二氧化氯、次氯酸鈉或次氯酸鈣等將氰根離子氧化成無毒無害的N2和CO2被排出[9-11];但此廢渣浸除液中的氰化物主要以亞鐵氰配合物(占98%以上)形式存在,穩定性高,在溶液中基本不解離出游離CN-,很難被常規氧化劑直接氧化,也很難被微生物分解[12-13]。
復雜氰化物—亞鐵氰配合物的處理主要采用光解法[14]、活性炭吸附法[14]和氰化鐵沉淀法等。光解法是在一定波長紫外光或可見光作用下,將亞鐵氰化物分解成CN-,然后通過氯堿法氧化分解去除氰化物,對高鹽、并含有其他硅、鋁等雜質離子及膠體物質的色度較高的廢液,因此法對光的透過性差,效果不佳。活性炭吸附法是利用活性炭的活性位點吸附去除氰化物,但粉末活性炭材料存在粒徑小、容易堵塞、活性位點少、用量大、運行成本高等缺點,僅適用于低濃度氰化物的去除[15-16]。氰化鐵沉淀法是向廢水中加入FeSO4,利用Fe2+和游離CN-反應生成穩定的普魯士藍沉淀而去除氰化物[16-17];但現有研究均采用硫酸亞鐵作試劑,尚未見有用氯化亞鐵作試劑的研究報道。由于此廢渣浸出液中含有大量Ca2+[18],加入硫酸亞鐵后,Ca2+和CN-會分別與硫酸亞鐵反應生成硫酸鈣沉淀和普魯士藍沉淀,會加大硫酸亞鐵消耗量,且引起除氰后液中雜質硫酸根離子累積,進而增加處理成本,也會影響蒸發分鹽后工業鹽產品品質及后續回收氟[19]。而用氯化亞鐵作除氰劑,可以避免這些問題,試驗研究了用氯化亞鐵作除氰劑從高鹽分、高雜質含量的電解鋁廠固體廢渣浸出液中氧化除氰。
1 試驗部分
1.1 試驗原料、試劑與設備
含氰溶液:廣西某鋁電解廠的固體廢渣通過濕法浸出后所得,主要成分為氟化物和氰化物,pH=12.53,主要組成見表1。

表1 電解鋁廠固體廢渣浸出液的主要組成 mg/L
主要試劑:氯化亞鐵(FeCl2·4H2O,≥99%),鹽酸(1+1),均為分析純。
試驗主要設備:PFS-80型氟度計,GZ-120型懸臂式電動攪拌器,DF-1015型集熱式恒溫加熱磁力攪拌器,SHZ-D(Ⅲ)水循環式真空泵,PHSJ-4F型pH計,BSA12AS型電子天平,DNG-9246A型電熱恒溫鼓風干燥箱。
1.2 試驗原理與方法
Fe2+與溶液中的CN-反應生成亞鐵氰配合物,亞鐵氰配合物再與Fe2+反應生成無毒的藍色沉淀,之后被氧化成普魯士藍(Fe4[Fe(CN)6]3)沉淀[20]。


2Fe4[Fe(CN)6]3↓+4Fe(OH)3↓。
Fe2+與CN-生成普魯士藍的反應分2步進行:第1步,Fe2+與CN-配合形成亞鐵氰配合物,這一步需在偏堿性條件下進行;第2步,亞鐵氰化物被氧化進一步轉化成穩定的普魯士藍不溶性化合物,這一步需在弱堿性條件下進行[9]。要使氰化物去除徹底,pH控制是關鍵。
試驗在燒杯中進行,采用懸臂式電動攪拌,恒溫水浴控溫。攪拌條件下,溶液中加入一定量氯化亞鐵,生成藍色沉淀,一段時間后,用水循環式真空泵過濾,得到濾液和濾渣。濾液分析氰化物質量濃度及pH,計算氰化物去除率。
2 試驗結果與討論
2.1 溶液pH對氰化物去除率的影響
溶液體積80 mL,溶液pH=12.53,初始氰化物質量濃度15.58 mg/L,用鹽酸(1+1)調pH,溫度25 ℃,反應時間10 min,氯化亞鐵加入量31.25 g/L,溶液pH對氰化物去除率的影響試驗結果如圖1所示。

圖1 溶液pH對氰化物去除率的影響
由圖1看出:溶液pH對氰化物去除率影響較大,隨溶液pH升高,溶液中殘余氰化物濃度升高,氰化物去除率大幅下降。氯化亞鐵在溶液中發生兩個主要反應:一是Fe2+與OH-生成Fe(OH)2沉淀;二是Fe2+與[Fe(CN)6]4-發生配合反應生成普魯士藍沉淀。溶液pH越高,溶液中OH-濃度越高,OH-與Fe2+之間碰撞概率也就越大,生成Fe(OH)2沉淀的速度就會很快,導致溶液中游離Fe2+濃度降低,與[Fe(CN)6]4-反應的Fe2+減少,從而影響氰化物去除率。溶液pH=6.0時,溶液中殘余氰化物質量濃度降至0.45 mg/L,氰化物去除率達97.11%。
根據試驗原理:pH過低,第1步Fe2+與CN-配合不完全,CN-去除率低;但根據表1,溶液中游離CN-質量濃度很低,僅0.32 mg/L,所以第2步反應是主要的控速反應,以[Fe(CN)6]4-與Fe2+反應為主。溶液pH下降并不影響主反應,溶液中殘余氰化物質量濃度變化不大,氰化物去除率較為穩定。綜合考慮,確定溶液以pH=6.0為宜。
2.2 氯化亞鐵加入量對氰化物去除率的影響
溶液體積80 mL,pH=6.0,初始氰化物質量濃度15.58 mg/L,反應溫度25 ℃,反應時間10 min,氯化亞鐵加入量對氰化物去除率的影響試驗結果如圖2所示。

圖2 氯化亞鐵加入量對氰化物去除率的影響
由圖2看出:隨氯化亞鐵加入量增加,溶液中氰化物殘余質量濃度下降,去除率提高;氯化亞鐵用量為2.5 g時,溶液中殘余氰化物質量濃度0.47 mg/L,氰化物去除率96.98%。綜合考慮,確定氯化亞鐵加入量以2.5 g(即31.25 g/L)為宜。
2.3 反應時間對氰化物去除率的影響
溶液體積80 mL,pH=6.0,初始氰化物質量濃度15.58 mg/L,反應溫度25 ℃,氯化亞鐵加入量31.25 g/L,反應時間對氰化物去除率的影響試驗結果如圖3所示。

圖3 反應時間對氰化物去除率影響
由圖3看出:隨反應進行,溶液中殘余氰化物質量濃度下降幅度較大,氰化物去除率提高幅度較大,說明反應速度很快,反應約1 min后,溶液中就有藍色沉淀出現;反應5 min時,溶液中殘余氰化物質量濃度就降至0.18 mg/L,氰化物去除率達98.84%。CN-屬于強場配體,對金屬離子特別是Fe2+具有超強配合能力,所以,二者的反應速度非常快。綜合考慮,確實反應時間以5 min為宜。
2.4 反應溫度對氰化物去除率的影響
溶液體積80 mL,pH=6.0,初始氰化物質量濃度15.58 mg/L,反應時間5 min,氯化亞鐵加入量31.25 g/L,反應溫度對氰化物去除率的影響試驗結果如圖4所示。

圖4 反應溫度對氰化物去除率影響
由圖4看出:隨反應溫度升高,氰化物去除率變化不大,維持在97%左右。因此,反應在室溫下(25 ℃)進行即可。
2.5 雜質離子對氰化物去除率的影響
溶液體積80 mL,pH=12.53,初始氰化物質量濃度15.58 mg/L,反應時間5 min,反應溫度25 ℃,氯化亞鐵加入量31.25 g/L,考察雜質離子對氰化物去除率的影響。反應后溶液pH=6.03,組成見表2。
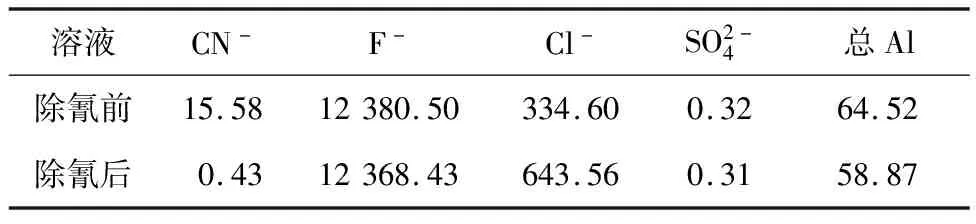
表2 溶液雜質組成對氰化物去除的影響 mg/L
由表2看出:以氯化亞鐵除氰,體系中不會引起硫酸根離子;氟離子損失不大,可以在后續處理中加以回收;而氯離子累積,有利于后續回收氯化鈉工業鹽產品。
3 結論
用氯化亞鐵作除氰劑,可以有效脫除高鹽固廢浸出液中的復雜氰化物,適宜條件下,溶液中殘余氰化物質量濃度可降至0.46 mg/L,氰化物去除率達97.05%。用氯化亞鐵代替硫酸亞鐵,可以在保證除氰效果的同時,不引起溶液中雜質元素累積,也不影響后續氟及氯化鈉產品的回收。

