肺癌患者化療后藥物性肝損傷的臨床特點
李 娜
(鐵嶺市中心醫院腫瘤內科,遼寧 鐵嶺 112000)
近年來,人們的生活節奏越來越快,生活壓力也越來越大,導致人們忽視了自身的健康問題,使得惡性腫瘤的發病率呈逐年上升趨勢[1]。當前,惡性腫瘤的主要治療方式為化療、手術、放療3種。其中化療和靶向治療是惡性腫瘤疾病中最為常見的方法,是國內外公認的當前治療惡性腫瘤最有效的方法,對延長患者生命周期、緩解患者病痛具有重要意義。但是長期化療并使用抗腫瘤藥物,會增加藥物不良反應[2-3]。抗腫瘤藥物多為細胞毒類藥物,對殺傷腫瘤細胞具有良好的效果,但同時也會不可避免的對人體正常細胞帶來損傷。肝臟作為人體器官中重要的排毒、代謝系統,一旦腫瘤藥物對肝臟產生損傷,極易導致肝臟排毒不暢而產生毒素淤積,給患者疾病的綜合治療帶來不良的影響。因此,在肺癌患者化療后藥物治療過程中要注重保肝治療。相關數據顯示,化療藥物所致肝損傷導致的肝病患者死亡因素已上升到第5位[4-5]。化療藥物所致肝損傷誘發的急性肝衰竭成為該疾病病因的第2位。因此,需提高對化療后藥物性肝損傷的認識,這也成為腫瘤學界重要的研究課題之一。基于此,本研究特選取我院于2017年1月至2019年6月收治的80例患者的病歷資料進行回顧性分析,以期提升對化療后藥物性肝損傷的認識,為以后的臨床診治提供參考依據。
1 資料與方法
1.1 一般資料 選取2017年1月至2019年6月收治160例肺癌患者的病歷資料進行回顧性分析。入選患者中男性104例,女性56例;年齡范圍在27~72歲,平均年齡為(44.78±5.33)歲;年齡≤40歲者34例(21.25%),40~60歲者82例(51.25%),≥60歲者44例(27.50%);同時合并其他肝病者12例(7.50%),化驗前檢查,患者肝功能均正常;肝癌分期:Ⅰ期12例,Ⅱ期30例,Ⅲ期58例,Ⅳ期60例。患者肝損傷參照WHO抗癌藥物不良反應分度標準。納入標準:病歷資料完整者;原發性肺癌,早中期肺癌術后或晚期轉移者;化療前肝功能指標正常者。排除標準:病歷資料不全者;回訪失聯者;患有基礎性肝病者,如病毒性肝炎、自身免疫性肝病、遺傳性肝病等;已經發生肝轉移者;肝功能已經受損者。本次研究經我院倫理委員會審核批準。
1.2 方法 對患者的病歷資料(包括患者性別、年齡、原發性腫瘤類型、肝功能、肝損傷發生時間、保肝藥物應用情況、化療藥物種類、經治療后肝損傷轉歸等)進行回顧性統計分析。
1.3 化療后藥物性肝損傷分級 按照2015年中華醫學會肝病學分會《藥物性肝損傷診治指南》[1]確定的診斷標準,可以分出化療后藥物性肝損傷級別。①0級(無肝損傷):患者可以耐受暴露藥物,沒有出現肝毒性反應。②Ⅰ級(肝損傷輕度):血清ALT和(或)ALP具備較強的可恢復性,TBIL<2.5倍正常值上限(2.5 mg/dL或42.75 μmol/L,而且INR<1.5);可適應的患者占到了絕大多數;可能會出現乏力、虛弱、惡心、厭食等不良反應癥狀。③Ⅱ級(肝損傷中度):血清ALT和ALP明顯高于正常值,TBIL大于2.5倍上限,或者TBIL正常,但是INR≥1.5;而且癥狀出現了加重的趨勢。④Ⅲ級(肝損傷重度):血清ALT和ALP出現了明顯升高的癥狀,TBIL達到了正常值的5倍以上,可能會同時出現INR≥1.5的情況;癥狀不斷加重,嚴重的情況下患者需要入院治療。⑤Ⅳ級(肝衰竭):血清ALT和ALP出現了大幅度上升,TBIL大于正常值10倍以上,每日升高≥1.0 mg/dL,INR≥2.0,凝血酶原活動度<40%;會發生嚴重的腹水,或者出現嚴重的肝性腦病,并伴隨出現嚴重的器官功能衰竭。⑥Ⅴ級(致命):因為藥物性影響造成肝功能全部失去,不進行肝移植就會死亡。
1.4 化療后藥物性肝損傷類型判定 目前國際醫學組織理事會將化療后藥物性肝損傷類型劃分為3種,肝細胞損傷型、膽汁淤積型、混合型,主要通過患者ALT值進行判斷[6]。具體標準是:肝細胞損傷,ALT大于3倍正常值,同時且INR大于5;膽汁淤積型,ALP大于2倍正常值,且INR低于2;混合型,AL大于3倍正常值,ALP大于2倍正常值,且2<INR<5。若ALT、ALP不符合上述標準,就說明肝臟生化檢查出現了異常的情況。
1.5 肺癌化療方案 本次肺癌患者病例報告中根據患者病情差異,共有3種具體化療方案。DP方案:順鉑75 mg/m2,第1日分3次給予,聯合多西他賽75 mg/m2,使用1個周期的21 d,治療周期為6個。EP方案:順鉑和泊苷各100 mg/m2,1個周期的21 d,治療周期6個。GP方案:使用吉西他濱1 250 mg/m2與順鉑75 mg/m2,1個周期21 d,治療周期為6個。
1.6 統計學方法 使用SPSS 21.0統計學軟件分析綜合起來的數據。要使用()表示計量資料,組間比較行t檢驗;用[n(%)]表示計量資料,組間比較行χ2檢驗;P<0.05表示數據差異具有統計學意義。
2 結果
2.1 不同化療方案所致患者藥物性肝損傷發生情況 對患者的病歷資料進行統計,采用DP方案化療的患者50例,EP方案化療的患者44例,GP方案化療的患者66例。其中DP方案肝損傷發生4例(8.00%),EP方案肝損傷發生3例(6.82%),GP方案肝損傷發生10例(15.15%)。得出3種化療方案造成的肝損傷基本都是1級和2級,經檢驗3種方案都具有統計學意義,P<0.05。見表1。

表1 不同化療方案所致患者藥物性肝損傷發生情況對比
2.2 不同化療方案患者肝細胞損傷類型 DP方案患者肝細胞損傷類型以膽汁淤積性為主,GP方案患者肝細胞損傷類型以肝細胞損傷為主以方案患者肝細胞損傷類型以混合型為主。見表2。

表2 3種不同化療方案患者肝細胞損傷類型[n(%)]
2.3 不同化療方案所致藥物性肝損傷患者治療及愈后 經統計,不同化療方案所致患者藥物性肝損傷后,對患者進行針對性藥物治療患者均好轉或治愈,但差異無統計學意義,P>0.05。見表3。
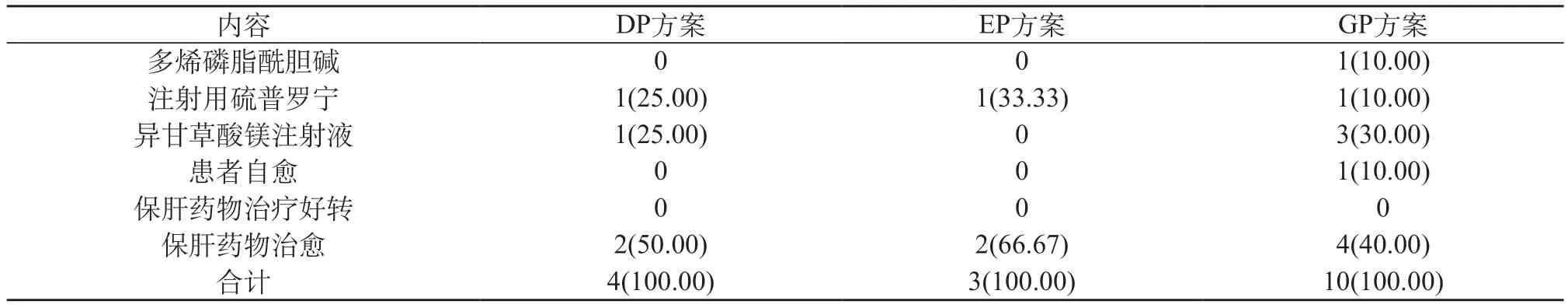
表3 不同化療方案所致藥物性肝損傷患者治療及愈后對比[n(%)]
3 討 論
所謂的藥物性肝損傷,是因為人體暴露于特定藥物或者在藥物代謝過程中造成的肝損傷。這是藥物不良反應中最常見的類型之一,是新藥能否進入臨床治療的重要參照之一[6]。在臨床方面,藥物性肝損傷主要體現為急性、亞急性或慢性肝損傷類型,最輕的是無癥狀的肝酶升,最嚴重的可能導致死亡[7]。目前已知存在潛在肝毒性藥物共有1 000多種,具體包括了化學藥物、生物制劑、中草藥、保健品、膳食補充劑等[8]。目前,這些潛在肝毒性藥物在醫學和我們的生活領域得到了廣泛的應用,而且沒有得到有效的控制,因此在化療過程中極易成為造成藥物性肝損傷的重要因素,下一步我們必須對此引起高度的重視,在化療過程中要重分考慮上述元素的影響,制訂出科學合理的方案,避免這些因素導致患者出現肝損傷。
患者的年齡、性別、種族、乙醇、妊娠、營養不良等都會對藥物肝損傷產生較大的影響,同時藥物、環境也會對其產生重要的影響[9-10]。①年齡:通常來說,年齡越大的患者越容易產生藥物性肝損傷,對于如阿莫西林-克拉維酸這些特殊的藥物來說,高齡是導致藥物性肝損傷的最重要的因素。這與高齡人群的藥代謝能力較低有著較大的關系。除了易感性提高以外,肝細胞損傷型藥物性肝損傷最容易在年輕人群中發生,膽汁淤積型藥物性肝損傷更容易在老年人群中發生,且容易造成藥物性肝損傷持續出現。在兒童人群中幾乎不會產生藥物性肝損傷,兒童藥物性肝損傷的占比低于10%,引起兒童藥物性肝損傷的藥物主要是中樞神經系統藥物。②性別:學術界一致認為,女性比男性更容易發生藥物性肝損傷,特別是對于呋喃妥因這類藥物來說,女性的藥物性肝損傷更易發展為急性肝衰竭。但研究表明,性別在藥物性肝損傷方面沒有差別。③研究表明,遺傳易感性會對發生藥物性肝損傷產生決定性的影響。人類白細胞抗原基因型與藥物代謝酶的基因多態性都與藥物性肝損傷存在密切的關系。如N-乙酰轉移酶、UDP葡萄糖醛酸轉移酶和谷胱甘肽S-轉移酶等藥物代謝酶的異常活性,都使得亞洲人群發生藥物性肝損傷的風險大大增加,但是否對歐洲人群產生影響并不清楚[11]。人類白細胞抗原的多態性是不同人群患上藥物性肝損傷存在差異的重要原因。④乙醇和妊娠乙醇攝入是特定藥物(如異煙肼、甲氨蝶呤和氟烷)導致藥物性肝損傷的風險因素。針對上述會造成患者肝損傷的藥物,我們要制訂妥善的方案,針對各種人群患者會受到不同類型的藥物引起肝損傷的特點,在化療過程中盡量避免使用這些藥物,或者盡可能將這些藥物對患者帶來的危害降到最低,在保證患者的病情可以得到緩解的同時,也要盡量避免發生肝損傷,這樣的治療方案才可以起到最好的效果。
藥物性肝損傷是腫瘤疾病化療后藥物治療中最為常見的并發癥之一。目前,我國肺癌患者化療后藥物引起的肝功能發生率在1.5%~8.0%[12-13]。由于化療后藥物性肝損傷屬于異質性疾病,臨床表現比較復雜,主要依靠血清生化指標來進行判定。化療后藥物性肝損傷對患者的治療及愈后帶來嚴重影響,嚴重時會導致患者肝功能衰竭甚至死亡。因此,深入了解不同化療方案對患者可能產生的藥物性肝損傷具有重要意義[14]。
隨著全球醫療技術水平不斷發展,目前抗腫瘤藥物種類也越來越多,價格平民化的藥物也明顯增多,為提升患者的治療效果帶來了新的希望。目前諸多學者在對肺癌患者化療后藥物性肝損傷的研究大多立足于單一的化療方式,難以全面呈現出化療后藥物性肝損傷的特點及規律。基于此,本文從3種最為常見的化療方式進行統計分析,其中GP方案肝損傷發生率最高(15.15%),DP方案為8.00%,EP方案為6.82%。GP方案研究結果與相關研究結果較為相近[15-16]。DP、EP方案結果有一定出入,可能是因為本次研究樣本數選取不足,難以細化數據得到更為精確的計算結果。所以本研究得出來的結果雖可以作為化療治療的參照,但是具體方案的制訂還需要我們進一步細化研究,針對不同的患者制訂出有針對性的治療方案,這樣的治療才會取得更好的效果。
在本次研究中,3種不同化療方案化療后,患者化療后藥物性肝損傷嚴重程度主要集中在1級和2級中,經過藥物治療后患者均得到了很好的轉歸和治愈。本研究中3種化療方案均包含順鉑,但出現的肝損傷差異較大,可能與患者體質、年齡或藥動學等有關。這還有待于其他學者更加深入的研究。在這些研究沒有得出結果以前,我們在化療過程中要充分重視這些因素對藥物肝損傷產生的影響,并記錄相關的數據資料,為專家研究這方面的內容提供可靠的參考。這樣就可以為今后這方面的研究做出有力的支持,并對本文的研究做出有效的補充。
當前,化療后給予患者保肝類藥物種類較多,各類藥物的藥理機制存在較大差異。保肝類藥物種類主要分為:解毒類保肝藥物(以硫普羅寧為代表,能有效參與患者體內糖、脂肪、蛋白質代謝,實現解毒護肝之功效)、肝細胞修復類保肝藥(以多烯磷脂酰膽堿為代表,能提供肝細胞結構原料卵磷脂,促進患者干細胞修復,從而實現保肝護肝)、抗炎類保肝藥物(以異甘草酸鎂注射液為代表,能夠改善患者體內膽紅素代謝,抑制患者肝纖維化)[17-19]。當前臨床缺乏對化療后藥物性肝損傷的準確分析和對癥用藥,化療后藥物性肝損傷過去一直不受重視,因而化療后藥物性肝損不能得到有效的治療,臨床醫師往往忽略其病因分析及對因治療,對不同化療方案所致的化療后藥物性肝損缺乏準確分析和相應判定,難以明確界定化療后藥物性肝損的類型,造成在保肝藥的選擇上缺乏一定的針對性。部分醫師化療后隨意開具某種保肝藥物,或開具多種保肝藥物,在保肝藥的治療選擇中仍然存在一定的盲目性[20-24]。本研究可能有助于臨床醫師對涉及上述3種常見肺癌化療方案患者可能發生的化療后藥物性肝損類型進行判定,包括化療后藥物性肝損的特點等,還可提供針對性的保肝治療方案。本研究不足之處在于所分析的樣本量較小。希望有更多大型的隨機對照試驗來支持本研究的結論,包括不同化療方案發生化療后藥物性肝損的規律性以及針對性的保肝藥治療療效的評價,以期為臨床保肝治療提供精準的治療數據參考,減少化療所致化療后藥物性肝損的發生,促進臨床合理用藥。
綜上所述,3種不同肺癌化療中GP方案所致的患者化療后藥物性肝損傷發生率最高,EP方案、DP方案的肝損傷均存在不同特點。在臨床治療中需充分考慮并對癥使用保肝類藥物,以提升患者的治療效果。

