miRNA-148/152 家族成員在惡性腫瘤中的生物學功能研究進展
張一帆 周 梁
(復旦大學附屬眼耳鼻喉科醫院耳鼻喉科 上海 200031)
microRNAs(miRNA)是長度約19~25 個核苷酸的非編碼RNA,對許多生物過程至關重要。microRNA-148/152(miR-148/152)家族的成員,包括miR-148a、miR-148b 和miR-152,這 一 家 族 在 惡性腫瘤的發生發展中扮演了重要的角色。本綜述從miRNA 的特征和產生、miR-148/152 家族成員結構特點、miR-148/152 家族成員與靶基因、miR-148/152 家族成員的表達與惡性腫瘤的相關性、miR-148/152 家族促進腫瘤發生發展的相關機制以及miR-148/152 家族在惡性腫瘤免疫逃逸中的作用共六部分進行了系統總結。
miRNA 的特征和產生miRNA 長度約19~25 個核苷酸,在幾乎所有真核細胞中都起著重要的基因表達調節的作用。基因組通過RNA 聚合酶Ⅱ轉錄產生miRNA 初始體(pri-miRNA),RNAseⅢ內切酶將primiRNA 切割成miRNA 前體(pre-miRNA)[1]。核轉運受體Exportin-5將pre-miRNA由細胞核轉運至細胞質,隨后通過Dicer 酶切割pre-miRNA 形成成熟的雙鏈miRNA[2]。miRNA 是轉錄后調節因子,通過互補堿基配對與靶基因mRNA 的3'-非翻譯區(3'-untranslated region,3'-UTR)中的序列結合,從而導致靶基因表達的下調[3]。越來越多的證據表明,miRNA 在廣泛的生物學過程中起著關鍵作用,通過表達的上調和下調改變靶基因的表達,從而改變細胞增殖、死亡和能量代謝等多種生物學過程[4]。
miR-148/152 家族成員結構特點miR-148/152 家族成員包括miR-148a、miR-148b以及miR-152[5]。miR-148/152 家族成員位于人類第7、12 和17 號染色體。miR-148/152 家族成員前體具有莖環結構,該前體通過一系列核內和胞質內酶加工成成熟miR-148/152 家族成員。成熟miR-148/152 家族成員長度為21~22 個核苷酸,相同的種子序列約為6~7 個核苷酸(圖1)。種子序列是miRNA 與靶mRNA 結合的重要區域。通過種子序列與靶mRNA 的3'-UTR 之間的互補結合,miR-148/152 家族成員參與了多種生物學過程。許多惡性腫瘤和正常組織中存在miR-148/152 家族成員的差異表達。因此,miR-148/152 家族成員對腫瘤的發生和發展可能至關重要。

圖1 miR-148/152 家族成員的成熟序列Fig 1 Mature miRNA sequence of miR-148/152 family members
miR-148/152 家族成員與靶基因在不同的細胞環境中,相同的miRNA 可能通過結合不同的靶基因調節多種途徑并引起多種表型。miR-148/152家族成員具有很多不同的靶基因,在多種生物學過程中發揮重要作用。多種生物信息學方法可用于預測miRNA 的靶基因。miRanda[6],Diana-microTCDS[7]和TargetScan[8]是 目 前miRNA 研 究 中 最 常用的3 種預測方式。TargetScan 使用多種線性回歸模型將可分析元素分解為14 個特征,然后使用種子匹配(長度和頻率)、3′補償和折疊自由能作為預測特征,是目前科學界使用最廣泛的miRNA 靶基因預測工具。此外,熒光素酶報告、PCR(polymerase chain reaction)和免疫蛋白印跡(Western blot)等實驗方法可用于驗證miRNA 的靶基因。熒光素酶報告實驗可以識別miRNA 與其靶向mRNA 區域之間的直接相互作用,而qPCR 和免疫蛋白印跡可以評估由相互作用引起的轉錄和翻譯抑制。驗證miR-148/152 的靶基因需滿足以下兩個標準:靶基因具有帶有互補序列的miR-148/152 家族成員結合位點,可以直接與miR-148/152 家族成員結合;miR-148/152 的表達能夠抑制靶基因在RNA 和蛋白水平上的表達。miR-148/152 家族成員的靶基因(表1)。
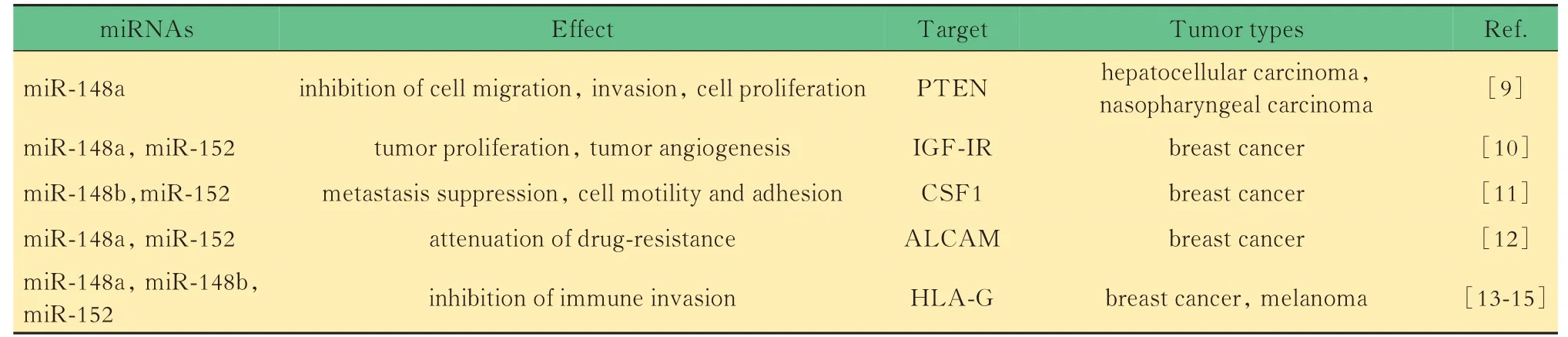
表1 miR-148/152 的靶基因及其在惡性腫瘤中的功能Tab 1 Validated targets of the miR-148/-152 family and its function in malignant tumor
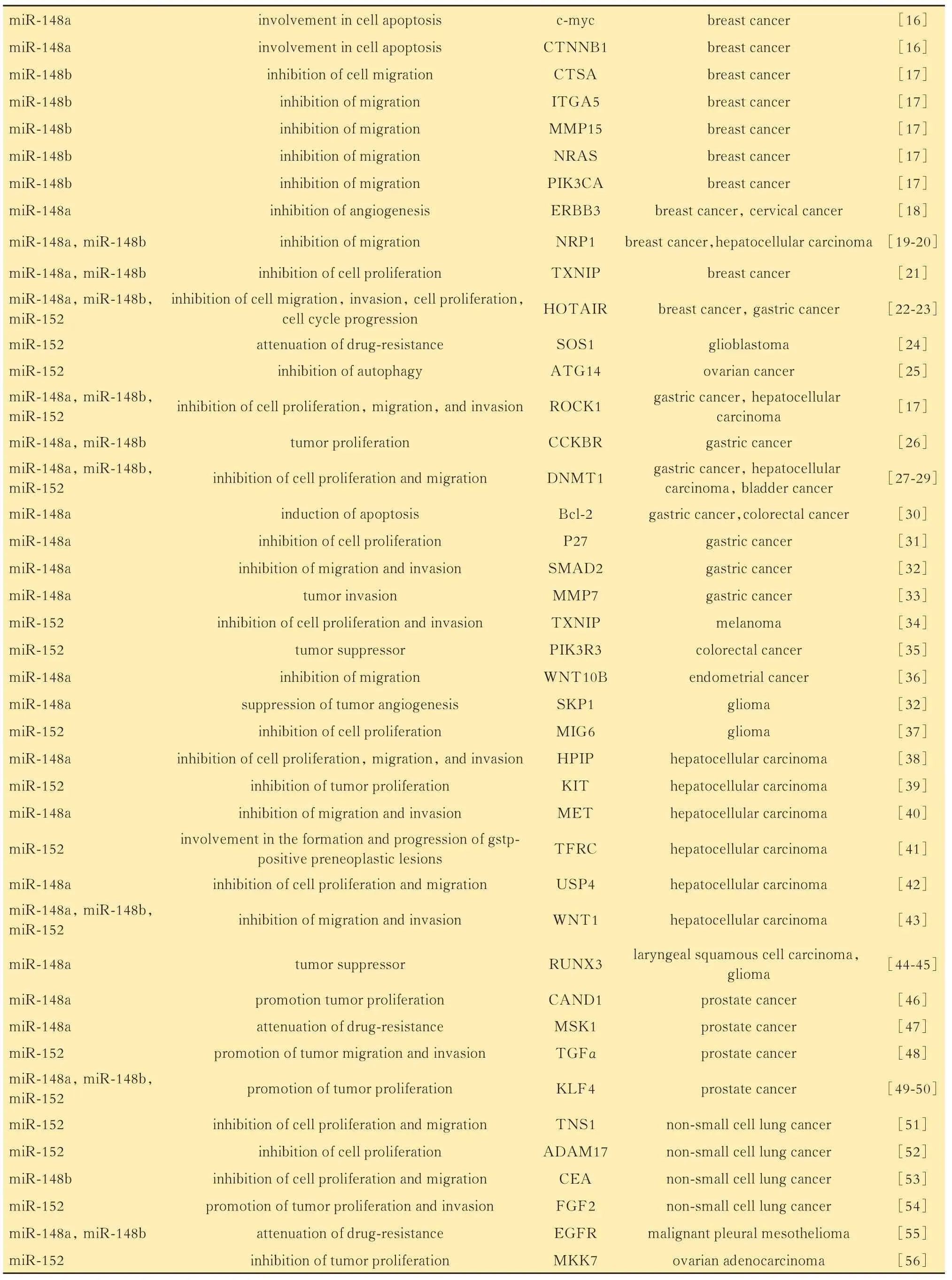
(續表1)
miR-148/152 家族成員的表達與惡性腫瘤的相關性miR-148/152 家族成員在許多惡性腫瘤中表達上調。據報道,包括miR-148a 在內的6 種miRNA在多發性骨髓瘤(multiple myeloma,MM)血漿中顯著上調,高水平的miR-148a 與更短的無復發生存時間 相 關[57]。同 樣 在 血 漿 中,Cuk 等[58]注 意 到miR-148b 在乳腺癌患者中明顯上調。此外,Gokhale等[59]發現miR-148a 在髓母細胞瘤中過表達,并可能與WNT 信號通路相關。另外,miR-148a 在與肝細胞癌(hepatocellular,HCC)相關的乙型肝炎細胞中被上調[60]。因此,在這些腫瘤中,miR-148a 和miR-148b 可能是重要的生物標志物,并具有早期診斷的潛在價值。
在多種惡性腫瘤類型中發現miR-148/152 家族成員的表達都有下調,表明它們可能具有腫瘤抑制的作用。在肝細胞癌中,相對于肝細胞系L02,miR-148b 在肝癌細胞系HepG2、MHCC97L 和MHCC97 H 中表達下調[60]。miR-148a 和miR-152 在胃腸道腫瘤組織及其細胞系中的表達被下調,并通過靶向膽囊收縮素-2 受體(cholecystokinin B receptor,CCK2R)抑制細胞生長[26]。在卵巢癌組織及其細胞系中,miR-152 表達降低,但miR-148a 僅在卵巢癌細胞系中表達降低[61]。
miR-148/152 家族促進腫瘤發生發展的相關機制目前在許多腫瘤中都發現了miR-148/152 家族成員基因的甲基化。此前有研究發現,在胃癌中,DNMT1(DNA methyltransferase 1)的過表達能夠促進miR-148a 基因啟動子的超甲基化從而抑制其表達,而沉默miR-148a 會降低其對DNMT1 的抑制作用,這可能會導致DNMT1 的過表達,從而促進DNA 超甲基化[62]。Lujambio 等[63]發現使用DNA 脫甲基劑后,與正常組織相比,miR-148a、miR-34b/c和miR-9 在癌細胞中出現了特定的高甲基化相關沉默;最重要的是,他們發現與DNA 甲基化相關的抑癌miRNA 沉默可能有助于人類癌癥的轉移。Stumpel 等[64]鑒定出11 種miRNA,包括miR-152,它們由于CpG 甲基化而在t(4;11)陽性嬰兒急性淋巴細胞白血病中下調。進一步的研究表明,髓樣/淋巴樣白血病(myeloid-lymphoid leukemia,MLL)中,DNMT1 是miR-152 的 潛 在 靶 基 因,miR-152 CpG島的高度甲基化與不良的臨床預后密切相關。
近年來多項研究表明miR-148/152 家族成員通過靶向多條通路從而產生對腫瘤的抑制作用。Feng 等[49]發 現 前 列 腺 癌 中miR-148-3p 和miR-152-3p 可通過抑制KLF4(Kruppel like factor 4)發揮抗腫瘤作用。除前列腺癌外,結直腸癌等多種腫瘤中都發現miR-148/152 家族成員可靶向KLF4 并抑制腫瘤的生長[50]。在乳腺癌中,miR-152 的過表達通過靶向IGF-1R(insulin-like growth factor 1 receptor)和IRS1(insulin receptor substrate 1)并抑制其下游AKT 和MAPK 信號通路來顯著抑制細胞增殖、集落形成和腫瘤血管生成[10]。非小細胞肺癌中,miR-152/TNS1 軸通過Akt/mTOR/RhoA 通路抑制腫瘤的增殖和遷移[51]。
DNMT1 是一種DNA 甲基轉移酶,在疾病的發生發展中發揮重要的作用。研究表明,DNMT1 在多種腫瘤中差異表達[65],并能被miR-148/152 家族成員調節其表達,包括肝細胞癌[27]、急性淋巴細胞白血病[28]、子宮內膜癌[29]等。在乳腺癌中,多項研究表明miR-148a/152-DNMT1 調節回路在腫瘤的發生發展中發揮極其重要的作用[10]。
PTEN(phosphatase and tensin homolog)是一種磷酸酶,可催化脂質第二信使PtdIns(3,4,5)P3 轉化為磷脂酰肌醇(4,5)-雙磷酸[PtdIns(4,5)P2][66]。PTEN 突變在多種腫瘤中頻繁發生,例如子宮內膜癌[67]、多形膠質母細胞瘤[68]、皮膚[69]和前列腺癌[70]。據報道,PTEN 作為靶基因受多種基因調控。在miR-148/152 家 族 成 員 中,miR-148a 和miR-152 已被實驗證實可調控PTEN 的表達[9],但相關研究仍較少,需要進一步探究。此外,一項關于膀胱癌的研究表明,miR-152-3p 通過抑制DNMT1 來調節PTEN 啟動子中DNA 甲基化的狀態從而調控PTEN 的表達[71]。
CAND1 (cullin associated and neddylation dissociated 1)等基因也被證明是miR-148/152 家族成員的靶基因,并調控惡性腫瘤的發生與發展。Murata 等[46]發 現miR-148a 通 過 與CAND1 mRNA的3'-UTR 結合而降低了CAND1 的表達,并促進了人 類 前 列 腺 癌 的 生 長。此 外,Bcl-2[30],p27[31]和CSF-1(colony stimulating factor 1)[11]也 被 證 明 是miR-148/152 家族成員的靶基因。
miR-148/152 家族成員與惡性腫瘤對藥物的敏感性也密切相關。在膠質母細胞瘤細胞(T98G 和U87)中,miR-152-3p 通過靶向SOS1(SOS Ras/Rac guanine nucleotide exchange factor 1)增強了對順鉑的敏感性[24],在卵巢癌順鉑耐藥系細胞中,miR-152的表達顯著下調。進一步研究發現,miR-152 可以通過調控ATG14(autophagy related 14)減少順鉑誘導的自噬,增強順鉑誘導的細胞凋亡和抑制細胞增殖[25]。在乳腺癌中,miR-148a 和miR-152 通過調控ALCAM (activated leukocyte cell adhesion molecule)的表達,降低ER+乳腺癌的他莫昔芬耐藥性[12]。
miR-148/152 家族在惡性腫瘤免疫逃逸中的作用人白細胞抗原G(major histocompatibility complex,class I,G,HLA-G)是一類在孕婦中對胎兒提供免疫耐受保護的重要蛋白。研究發現,HLA-G 也具有免疫抑制的作用,在腫瘤的發生發展中作為免疫檢查點發揮重要的功能。在多種不同起源的人類腫瘤中,HLA-G 經常表達,從而抑制T細胞和自然殺傷(nature killer,NK)細胞的細胞毒活性。HLA-G 能在免疫細胞(NK、T、B、單核細胞/樹突狀細胞)上牢固結合其抑制性受體,抑制這些免疫細胞的功能,誘導免疫抑制。當腫瘤表達HLA-G時,可保護其免受抗腫瘤免疫的殺傷[13]。最近的研究表明,miR-148/152 對HLA-G 的轉錄后基因調控很強。Fu 等[14]的研究表明,在非小細胞肺癌中,miR-152 能夠靶向HLA-G,調控其表達并影響腫瘤對NK 細胞的免疫逃避。研究表明,miR-148 在腎細胞癌中與HLA-G mRNA 直接結合并調控其表達。HLA-G 表達的腎細胞癌細胞系(NIH/3TS)中,miR-152 的過表達能大幅下調HLA-G 的表達并增進 其 對NK 或LAK(lymphokine activated killer)細胞介導的細胞毒性[15]。
結語目前已發現miR-148/152 家族成員在多種惡性腫瘤中差異表達并發揮不同的作用。無論是在組織中上調還是下調,miR-148/152 家族成員都參與靶基因的調節并調控多種信號通路,影響細胞的增殖、分化和凋亡。同時,miR-148/152 家族成員在增強腫瘤對藥物敏感性以及免疫逃逸中都發揮了重要作用。miR-148/152 受到其CpG 島甲基化的調節,并可能存在miR-148a/152-DNMT1 調節環路。盡管近年來對于miR-148/152 家族的研究取得了很大進展,然而,關于其在不同腫瘤和組織中的功能仍不清楚,尤其是miR-148/152 家族在腫瘤的免疫逃逸等多種生物學過程中的功能和分子機制仍亟待更多的研究探討。
作者貢獻聲明張一帆 文獻查閱,繪制圖表,論文撰寫和修訂。周梁 獲取資助,論文指導和修訂。
利益沖突聲明所有作者均聲明不存在利益沖突。

